SLE患者外周血T细胞亚群凋亡特点及其相关机制的研究①
2010-06-21王晓乐邱潮林吴秀梅季晓辉张冬青上海市公利医院检验科上海200135
王晓乐 邱潮林 吴秀梅 季晓辉 张冬青 (上海市公利医院检验科,上海 200135)
SLE是一种复杂的自身免疫性疾病,免疫学异常主要表现为T细胞依赖的B细胞功能亢进,大量致病性自身抗体及免疫复合物产生。T细胞亚群凋亡异常是导致SLE T细胞免疫调节紊乱和免疫应答异常的重要机制[1]。已证实,活化的T细胞发生激活诱导的细胞凋亡(Activation-induced cell death,AICD),导致T细胞免疫应答功能紊乱,加速了SLE病理进程。Fas介导的死亡信号受体途径是T细胞发生AICD的主要途径,Fas与之在体内的天然配体FasL相结合从而发挥凋亡诱导作用。大量研究表明,IL-10是有效的T细胞和抗原递呈细胞的抑制因子,SLE患者血清IL-10水平异常升高,很可能促进了异常活化的T细胞高表达FasL,T细胞膜表面FasL通过膜内陷或折叠与自身或邻近T细胞Fas结合引起了AICD[2]。2005年Wang H等报告:SLE患者PBMCs中CD3+、CD4+、CD8+T细胞亚群凋亡均明显增加;体外SLE患者血清可诱导T细胞亚群凋亡增多;SLE患者PBMCs培养上清中sFas、sFasL水平升高;细胞内Fas mRNA的表达水平升高[3]。本研究探讨了不同病程阶段SLE患者T细胞亚群发生凋亡的特点,以及 IL-10与T细胞亚群凋亡之间的联系,试图更深入地阐明SLE T细胞的凋亡机制。
1 材料与方法
1.1 对象 选取2005年4月至2008年4月在南京医科大学附属常州二院风湿免疫科就诊的SLE患者,共45例,均符合美国风湿病协会(ARA)1997年修订的SLE诊断标准[4],活动性判定以多伦多大学的SLE活动指数(SLEDAI)为标准[5]。其中的35例SLE患者按疾病活动性分成两组,包括:高活动性患者(SLEDAI≥10)25例,男性 2例、女性 23例,年龄19~58岁、平均(36±9)岁;低/非活动性患者(SLEDAI<10)10例,包括男性2例、女性 8例,年龄17~53岁、平均(38±11)岁。35例SLE患者临床检验改变特点见表1。另外10例SLE患者进行跟踪试验:其中初诊患者5例,均为女性,年龄19~68岁、平均(39±21.51)岁;SLE活动期(SLEDAI≥10)患者5例,其中 1例为男性,年龄 18~57岁、平均(33.8±15.16)岁。从以上45例SLE患者中选取10例血清IL-10水平升高(IL-10≥20)的患者进行体外抗体中和实验,均为女性,年龄22~46岁、平均(34.70±8.92)岁。20例正常人对照选自来我院健康体检合格者,包括男性3例、女17例,年龄23~53岁、平均(32±7)岁。
1.2 主要试剂 血清抗ds-DNA抗体放射免疫分析试剂盒为北京北方生物技术研究所产品。血清IgG、C3、C4检测试剂为芬兰Orion诊断公司产品。人血清IL-10 ELISA检测试剂盒、荧光标记抗体包括抗CD4-FITC、抗CD8-PE、抗 CD3-PerCP以及 PE-Cy5标记的CD3、CD4、CD8单抗及其同型对照单抗、FITC标记的Fas单抗及小鼠IgG1同型对照单抗、PE标记的FasL单抗及小鼠IgG1同型对照单抗、Annexin V-FITC凋亡试剂盒等均为上海晶美生物工程有限公司产品。纯化的IgG1类鼠抗人IL-10单克隆抗体及其同型对照为Biolegend公司产品。纯化的IgG1类鼠抗人FasL单克隆抗体及其同型对照为Biolegend公司产品。RMPI Medium 1640,pH7.4,不含血清,为Gibco公司产品。胎牛血清(FCS)为Biosource公司产品。淋巴细胞分离液为上海恒信化学试剂有限公司提供产品。
1.3 实验方法
1.3.1 标本采集与处理 无菌条件下取SLE患者或正常对照者外周血10 ml,2 ml置于干燥管,收集血清,保存于-20℃冰箱中,用于血清IL-10的检测,检测于冻存后一周内完成;另外8 ml外周肝素钠抗凝,其中2 ml用于相关流式检测,6 ml用于外周血单个核细胞(PBMCs)的分离培养。需注意:抗凝血应及时放入25℃水浴箱中,且所有检测、处理应在4小时内完成。
1.3.2 T细胞亚群百分比例的检测 取SLE患者或正常对照者肝素抗凝血1 ml,按照CD4/CD8/CD3荧光标记单抗试剂盒的要求操作,流式细胞仪FACs Calibur由美国BD公司生产,以FSC/SCC二维散射光图确定淋巴细胞群体,检测10 000个淋巴细胞,每例样本设一组同型对照,利用功能软件得到CD3+、CD4+、CD8+细胞亚群占总细胞数的百分比,并得到CD4+/CD8+比值。
表1 35例SLE患者主要临床检验指标的变化特点(±s)Tab.1 The results of clinical examinations in 35 SLE patients(±s)

表1 35例SLE患者主要临床检验指标的变化特点(±s)Tab.1 The results of clinical examinations in 35 SLE patients(±s)
Note:Compared with low-level active SLE group,1)P<0.05;2)P<0.01.
Groups n SLEDAI ds-DNA antibody binding rate(%) ESR(mm/h) WBC(109L-1) IgG(g/L) C3(g/L) C4(g/L)Hyperactive SLE 25 12.28±1.97 37.27±20.711) 47.60±17.492) 3.83±0.912) 18.66±4.872) 0.61±0.302) 0.13±0.082)Low-level active SLE 10 6.10±1.91 18.39±16.42 28.80±10.35 4.96±0.76 12.20±2.58 1.08±0.43 0.25±0.10
1.3.3 T细胞亚群早期凋亡的检测 PBMCs常规培养48小时后,用3 ml PBS洗涤一遍,1 500 r/min离心15分钟后弃上清,按Annexin V凋亡试剂盒操作要求,对CD3+、CD4+、CD8+T细胞进行Annexin V凋亡检测,在功能软件上对AV+PI-的T细胞亚群作早期凋亡分析,每例样本同时设立一组同型对照。
1.3.4 T细胞亚群Fas、FasL表达率的检测 取SLE患者或正常对照者肝素抗凝血1 ml,按照试剂盒的操作要求,分别检测CD3+、CD4+、CD8+T细胞Fas+/FasL+的表达率,每例样本设一组同型对照。
1.3.5 SLE患者PBMCs常规培养中加入抗IL-10单抗后T细胞亚群Fas/FasL表达及早期凋亡的检测
1.3.5.1 SLE患者PBMCs常规培养中加入抗IL-10单抗 按照PBMCs常规培养规程操作,24孔培养板上每孔PBMCs细胞悬液中加入3.0 μ l抗 IL-10单抗[6],置于37℃、5%CO2的二氧化碳培养箱中培养48小时。
1.3.5.2 PBMCs 48小时培养后的处理与检测 用1 ml PBS稀释成PBMCs细胞悬液,平均分装于2支玻璃管中。一管中加入3 ml PBS洗涤一遍,1 500 r/min离心15分钟后弃上清,再用PBS将PBMCs稀释至5×105ml-1的浓度,用于T细胞亚群Fas、FasL表达率的检测,步骤详见1.3.4;另一管中加入2 ml结合缓冲液洗涤一遍,1 500 r/min离心15分钟后弃上清,再用结合缓冲液将PBMCs稀释至5×105ml-1的浓度,用于流式T细胞亚群凋亡的检测,步骤详见1.3.3。
1.3.6 SLE患者PBMCs常规培养中加入抗FasL单抗后T细胞亚群凋亡的检测
1.3.6.1 SLE患者PBMCs常规培养中加入抗FasL单抗 按照PBMCs常规培养规程操作,24孔培养板上每孔PBMCs细胞悬液中加入2.0 μ l抗FasL单抗[7],置于37℃、5%CO2的二氧化碳培养箱中培养48小时。
1.3.6.2 PBMCs 48小时培养后的处理与检测 用2 ml结合缓冲液洗涤PBMCs,1 500 r/min离心15分钟后弃上清,再用结合缓冲液将PBMCs稀释至5×105ml-1的浓度,用于流式T细胞亚群凋亡的检测,步骤详见1.3.3。
1.3.7 血清IL-10检测 取SLE患者或正常对照者外周血血清,按试剂盒说明书操作步骤,ABC-ELISA法检测血清中IL-10水平。
1.3.8 两组SLE患者的跟踪实验 跟踪实验第一组:5例SLE初诊患者,跟踪其初发住院阶段和治疗两个月后明显好转(退热,蛋白尿减轻,皮肤、关节症状缓解,SLEDAI指数下降6分以上)阶段;跟踪实验第二组:5例SLE高活动期患者,跟踪其活动阶段(SLEDAI≥10)和一年后活动性明显降低(SLEDAI<10)的稳定阶段。
①血清IL-10水平检测操作步骤详见1.3.7。②T细胞亚群Fas、FasL表达率的检测操作步骤详见1.3.4。③每例患者每个阶段T细胞亚群早期凋亡的检测操作步骤详见1.3.3。
1.4 统计学分析 采用SPSS12.0统计分析软件分析各组数据,符合正态分布使用t检验,不符合正态分布使用秩和检验,各组之间指标比较使用两个独立样本检验,相关分析使用Spearman相关分析。
2 结果
2.1 SLE患者外周血T细胞亚群的凋亡异常增多
SLE患者外周血T细胞亚群凋亡比正常人明显增多(P<0.05),以CD4+亚群更为显著,结果见表2、图1。
T细胞亚群的凋亡与SLE病情活动性相关,以CD4+亚群更为显著:CD4+T细胞的凋亡在高活动性组显著高于低/非活动性组(P<0.05),且与SLEDAI呈正相关性(r=0.45,P <0.05)。T细胞亚群凋亡的不均一性导致T细胞亚群中CD4+T细胞比例下降,CD4+/CD8+的比值下降(P<0.01),且高活动性SLE组比低/非活动性组更显著(P<0.05),结果见图2。
表2 SLE患者外周血T细胞及其亚群凋亡的改变(±s)Tab.2 The apoptosis of T lymphocyte subsets in SLE patients(±s)
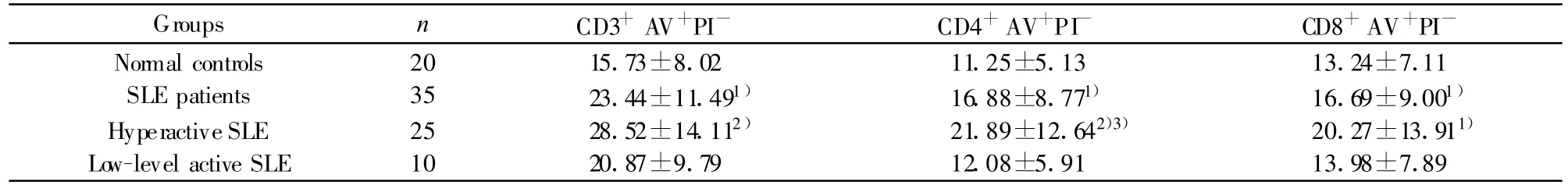
表2 SLE患者外周血T细胞及其亚群凋亡的改变(±s)Tab.2 The apoptosis of T lymphocyte subsets in SLE patients(±s)
Note:Compared with nomal controls group,1)P<0.05;2)P<0.01;Compared with low-level active SLE group,3)P<0.05.
Groups n CD3+AV+PI- CD4+AV+PI- CD8+AV+PINormal controls 20 15.73±8.02 11.25±5.13 13.24±7.11 SLE patients 35 23.44±11.491) 16.88±8.771) 16.69±9.001)Hyperactive SLE 25 28.52±14.112) 21.89±12.642)3) 20.27±13.911)Low-level active SLE 10 20.87±9.79 12.08±5.91 13.98±7.89
2.2 SLE患者T细胞亚群膜表面Fas/FasL的表达率异常增高 SLE患者外周血T细胞膜表面Fas的表达率无论是在高活动性组或低/非活动组均明显高于正常人(P<0.01);FasL的表达率亦高于正常人,但主要表现在高活动组(P<0.01)。这其中,以CD4+T细胞亚群的Fas表达率增高最为显著,尤其是在高活动性组中,结果见表3。
SLE患者外周血T细胞膜表面Fas/FasL表达率的异常增高与SLE病情活动性相关,主要表现在高活动性组中:Fas表达率与SLEDAI正相关(r=0.46,P<0.05);FasL表达率与SLEDAI亦正相关(r=0.49,P<0.05)。
2.3 SLE患者外周血T细胞高表达Fas/FasL与T细胞凋亡增多正相关 高活动性SLE患者CD4+T细胞的凋亡增高与其高表达Fas(r=0.45,P<0.05)、FasL(r=0.43,P<0.05)和CD8+T细胞高表达FasL(r=0.42,P<0.05)呈现正相关性;而CD8+T细胞的凋亡与其自身高表达Fas(r=0.48,P<0.05)和FasL(r=0.49,P<0.05)呈正相关。
将抗FasL单抗加入SLE患者PBMCs常规培养中后,SLE患者T细胞各亚群凋亡均明显减少(P<0.01),并以CD4+T细胞凋亡减少最为显著,其凋亡平均减少率超过50%,明显高于CD8+T细胞,且两组差异有统计学意义(P<0.01),结果见图3。
2.4 SLE患者血清中异常增高的IL-10水平与T细胞凋亡密切相关 SLE患者血清IL-10水平较正常人显著升高(P<0.01),高活动性SLE患者与低/非活动性患者比较更为明显(P<0.01),结果见表4。
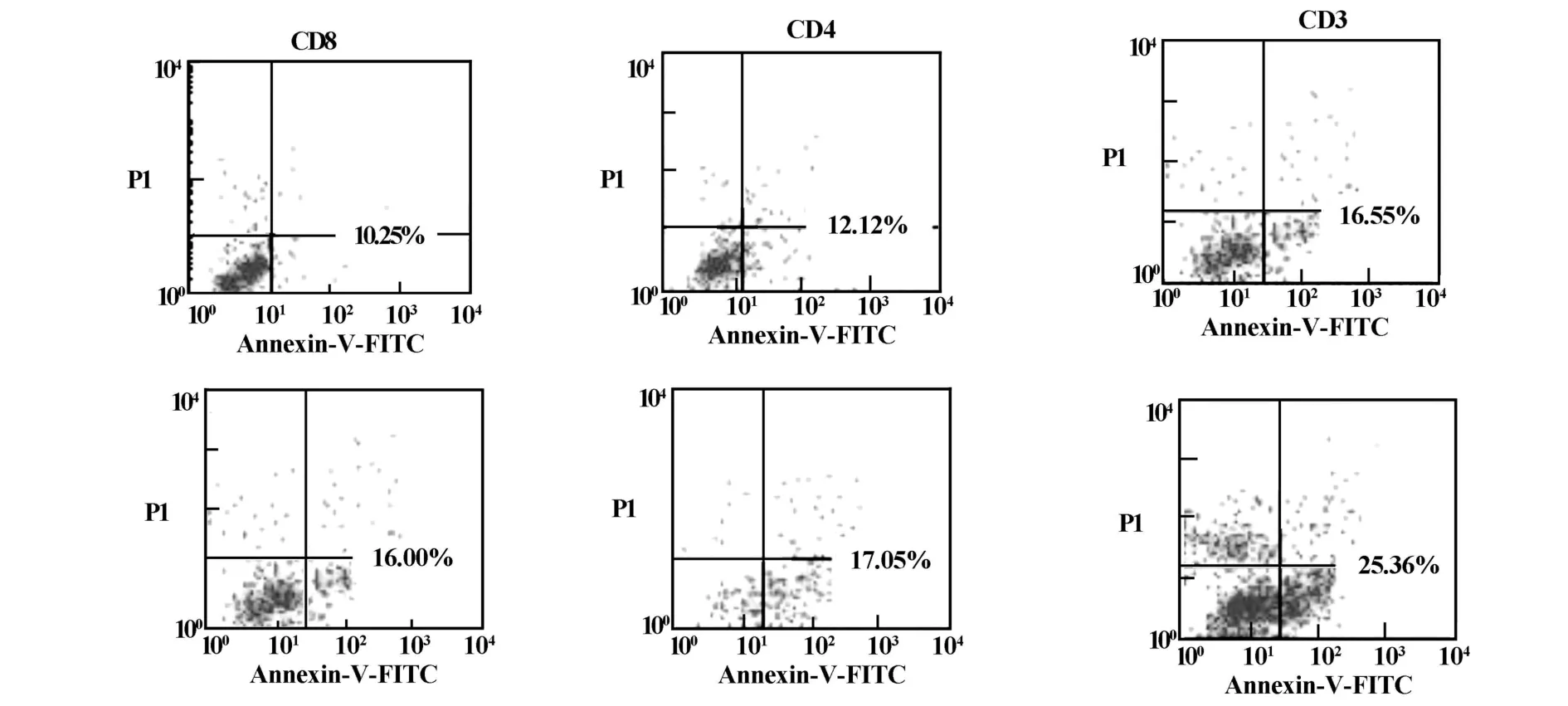
图1 SLE患者T细胞CD4+/CD8+亚群凋亡FACS结果Fig.1 FACS results of the apoptosis of T lymphocyte subsets(CD4+/CD8+)in SLE patients
表3 SLE患者T细胞CD4+和CD8+亚群 Fas/FasL的表达率(±s,%)Tab.3 The positive expression rates of Fas/FasL on T lymphocyte subsets in SLE patients(±s,%)

表3 SLE患者T细胞CD4+和CD8+亚群 Fas/FasL的表达率(±s,%)Tab.3 The positive expression rates of Fas/FasL on T lymphocyte subsets in SLE patients(±s,%)
Note:Compared with nomal controls group,1)P<0.05,2)P<0.01;Compared with low-level active SLE group,3)P<0.05.
Groups n Fas+FasL+CD4+ CD8+CD4+ CD8+Nomal controls 20 11.56±4.78 7.64±3.42 0.27±0.16 0.45±0.39 SLE patients 35 16.11±7.491) 10.95±7.37 1.10±1.042) 0.92±0.642)Hyperactive SLE 25 16.54±8.151) 11.57±7.38 1.26±0.842)3) 0.97±0.672)Low-level active SLE 10 15.65±5.43 10.77±3.86 0.66±0.511) 0.72±0.531)
比较SLE患者血清IL-10水平与6个SLE主要临床检验指标(血沉 、IgG 、C3、C4、WBC 、抗 ds-DNA 抗体)之间的相关性,结果显示:抗ds-DNA抗体与血清IL-10水平间的相关性最显著(r=0.83,P<0.01);高活动组IL-10水平与IgG水平也呈现一定的正相关性(r=0.41,P<0.05)。SLE高活动性组中,血清IL-10水平异常升高与SLEDAI具有一定的相关性(r=0.43,P<0.05);与CD4+T细胞亚群的凋亡增加正相关(r=0.54,P<0.05);与 T细胞亚群CD4+/CD8+比值下降负相关(r=-0.43,P<0.05);与SLE T细胞亚群高表达Fas/FasL密切相关,如表5所示。
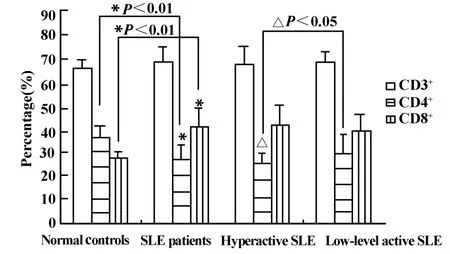
图2 SLE患者外周血T淋巴细胞及其亚群的百分含量Fig.2 The percentages of T lymphocyte subsets in SLE patients
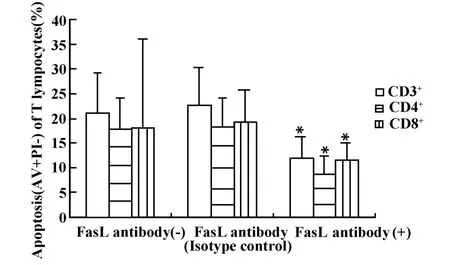
图3 10例高活动期SLE患者PBMCs培养中加入抗FasL抗体T细胞亚群凋亡的改变Fig.3 The apoptosis of T lymphocyte subsets in 10 hyperactive SLE patients in the vitro inhibition experiments
SLE患者PBMCs培养时加入抗IL-10抗体后,T细胞亚群Fas/FasL的表达率减少(P<0.05),CD4+T细胞与CD8+T细胞相比较,虽然前者Fas/FasL表达的平均减少率高于后者,但统计学上两亚群无差异(P>0.05)。加入抗IL-10抗体后,患者T细胞亚群凋亡下降(P<0.05),CD4+T细胞平均凋亡减少率略高于CD8+T细胞,但差异尚无统计学意义(P>0.05);CD4+/CD8+比例倒置得到一定改善(P>0.05)。
2.5 SLE患者经治疗病情好转、稳定时伴有IL-10水平下降、Fas/FasL表达减少和T细胞凋亡减少 5例SLE初诊患者血清IL-10水平随着病情好转逐渐减少(P<0.05);T细胞亚群Fas/FasL的表达率也随着病情好转逐渐下降,其中Fas表达率减少以CD4+T细胞更明显(P<0.05),结果见表6;T细胞亚群细胞凋亡亦显下降趋势,可能由于病例数较少,下降尚无统计学意义(P>0.05)。
表4 SLE患者血清 IL-10水平(±s,pg/ml)Tab.4 The level of serum IL-10 in SLE patients(±s,pg/ml)
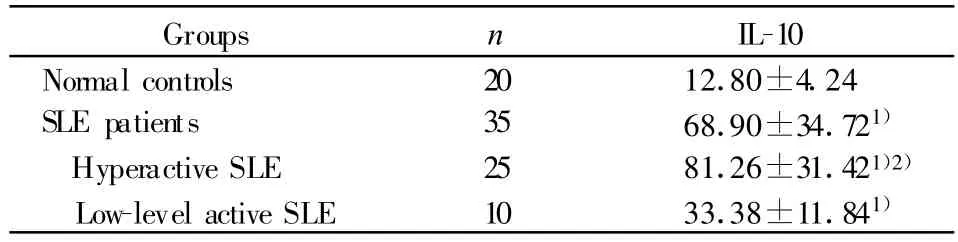
表4 SLE患者血清 IL-10水平(±s,pg/ml)Tab.4 The level of serum IL-10 in SLE patients(±s,pg/ml)
Note:Compared with normal controls group,1)P<0.01;Compared with lowlevel active SLE group,2)P<0.01.
Groups n IL-10 Normal controls 20 12.80±4.24 SLE patients 35 68.90±34.721)Hyperactive SLE 25 81.26±31.421)2)Low-level active SLE 10 33.38±11.841)

表5 35例 SLE患者血清IL-10水平与 T细胞亚群Fas/FasL表达率的相关性Tab.5 The correlations between serum IL-10 level and the positive expression rates of Fas/FasL on T lymphocyte subsets in SLE patients
表6 5例 SLE初诊患者经2个月治疗病情好转时IL-10水平(±s,pg/ml)及T细胞亚群Fas/FasL表达率(±s,%)的变化Tab.6 The level of serum IL-10(±s,pg/ml)and the positive expression rates of Fas/FasL(±s,%)on T lymphocyte subsets in a 2-month tracking experiment of first-visit SLE patients
Note:Compared with First-visit group,1)P<0.05.
Clinical course n IL-10CD3+T cells CD4+T cells CD8+T cells Fas FasL Fas FasL Fas FasL First-visit 5 140.60±49.39 50.21±11.76 3.19±1.10 25.73±3.06 1.61±0.60 23.15±5.23 1.57±0.47 Improving phase 5 87.20±31.041)42.82±6.85 2.47±0.65 21.67±5.161) 1.01±0.34 20.08±5.85 1.39±0.54
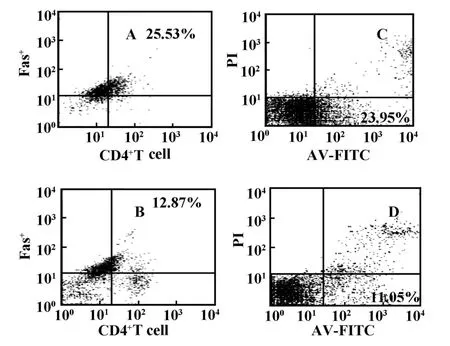
图4 SLE患者病情稳定阶段CD4+T细胞Fas+表达及凋亡的流式图Fig.4 The apoptosis and Fas+expression rate of CD4+T lymphocytes in a stable SLE patient
5例SLE高活动期患者跟踪一年后随着病情稳定血清IL-10水平显著下降(P<0.01);T细胞亚群Fas/FasL表达率呈明显下降趋势(P<0.05),尤其是CD4+T细胞Fas表达明显下降(P<0.01);CD4+T细胞亚群凋亡的减少亦尤为显著(P<0.05),结果如图4所示。
3 讨论
SLE是T细胞介导的B细胞疾病,自身反应性T细胞异常活化、机体的免疫耐受和免疫平衡被打破是SLE的主要发病机制。近年来T细胞凋亡在SLE的病理进程中的作用受到越来越多人的关注。SLE异常活化的T细胞发生细胞凋亡在某种程度上降低了自身免疫应答反应,对病情缓解有一定的积极作用,但另一方面凋亡会产生能促使SLE自身免疫应答的免疫物质,凋亡物质寡聚核苷酸样DNA与抗体形成的一系列免疫复合物沉积在组织中将导致组织损伤[8,9]。深入研究SLE T细胞凋亡机制及其与SLE疾病进程的关系,以及相关调控因子的作用,将有助于深入认识SLE的病程发展机制。
SLE T细胞凋亡的机制非常复杂,主要是通过激活诱导的细胞凋亡(AICD)途径。Fas是介导T细胞发生AICD的主要受体分子,活化的T细胞膜表面Fas表达升高,与其配体FasL结合后,Fas的死亡域(DD)与胞浆内接头蛋白FADD(Fas相关死亡结构域)的DD发生同型作用,FADD又通过其死亡效应域DED募集含DED的caspase 8,caspase 8的激活引起Caspase家族的一系列酶联反应,引起DNA降解和镜下可见的细胞及细胞核的凋亡形态学改变[10]。目前,对于SLE患者T淋巴细胞凋亡的特点,国内外文献报道不尽相同[11-13]。SLE T淋巴细胞的凋亡很可能与SLE病情活动度相关,且不同亚群的凋亡状态很可能不同。
通过实验,我们发现SLE患者外周血T细胞凋亡的3个主要特点:CD4+亚群T细胞的凋亡异常显著,且与SLE疾病活动性正相关;T细胞亚群膜表面表达Fas/FasL异常增高,且与SLE病情活动性相关;FasL是最重要的死亡因子,SLE异常活化的CD4+、CD8+T细胞高表达FasL是SLE T细胞发生AICD的关键。Nakajima等曾应用FasL单抗治疗NZB/WF1小鼠,发现狼疮性肾炎的进展得到明显抑制[14,15]。本实验结果也显示,体外SLE患者PBMCs的培养中加入FasL抗体可显著抑制T细胞亚群凋亡。在机体的免疫应答中,活化的T细胞发生AICD是重要的负反馈调节机制之一:Fas/FasL表达率的增加可能是SLE T淋巴细胞异常活化后的一种结果,而这直接导致T细胞发生AICD。
实验同时发现,SLE患者血清IL-10水平显著升高,高水平的IL-10不仅与抗ds-DNA自身抗体增加密切相关,还与T细胞亚群异常凋亡、CD4+/CD8+T细胞亚群平衡失调密切相关。Llorente等曾应用IL-10中和单抗治疗SLE动物模型,取得了一定的疗效[16,17]。本实验结果显示,体外SLE患者PBMCs的培养中加入IL-10抗体后,CD4+T细胞亚群的Fas/FasL高表达及凋亡异常明显抑制,CD4+/CD8+比例倒置状况得到改善。IL-10作为体内重要的免疫调节抑制因子,参与刺激自身抗体的产生和抑制细胞免疫应答。
IL-10对SLE患者T淋巴细胞凋亡的调节作用具体体现在:SLE患者高水平的IL-10参与诱导T细胞亚群高表达Fas/FasL,尤其是CD4+和CD8+T细胞亚群高表达FasL,使Fas表达显著增高的CD4+T细胞亚群发生AICD,最终导致CD4+T细胞比例下降、CD4+/CD8+比值降低、T细胞免疫功能缺陷,促进了SLE疾病的发展。这在跟踪实验中也得到了进一步证明,SLE患者经治疗病情好转、稳定时伴有IL-10水平下降,同时T细胞亚群表达Fas/FasL明显下降,T细胞凋亡也逐渐减少,这些变化在CD4+T细胞亚群中体现得最为明显。
综上所述,我们可以初步认为:SLE的发生、发展及缓解与T细胞亚群的免疫平衡密切相关。在免疫抑制因子IL-10的调节下,SLE异常活化的T淋巴细胞发生了以Fas/FasL为主要死亡途径的AICD,这有助于SLE患者细胞免疫功能的恢复。诚然,T细胞的凋亡机制非常复杂,涉及Fas/FasL为代表的外源性途径和Bcl-2为代表的线粒体途径,还涉及一系列的调节基因和影响因子。SLE活化的T细胞有无其他途径的凋亡机制,IL-10是否还以其他途径诱导T细胞凋亡,我们将在另文发表。
1 Funauchi M,Suqiyama M,Sukyoo B et al.A possible role of apoptosis for regulating autoreactive response in systemic lupus erythematosus[J].Lupus,2001;10(4):284-288.
2 Green D R,Droin N,Pinkoski M.Activation-induced cell death in T cells[J].Immunol Rev,2003;193:70-81.
3 Wang H,Xu J,Ji X et al.The abnormal apoptosis of T cell subsets and possible involvement of IL-10 in systemic lupus erythematosus[J].Cell Immunol,2005;235(2):117-121.
4 Griffiths B,Mosca M,Gordon C.Assessment of patients with systemic lupus erythematosus and the use of lupus disease activity indices[J].Best Pract Res Clin Rheumatol,2005;19(5):685-708.
5 Bombardier C,Gladman D D,Urowitz M B et al.Derivation of the SLEDAI.A disease activity index for lupus patients.The Committee on Prognosis Studies in SLE[J].Arthritis Rheum,1992;35:630-640.
6 Tyrrell-Price J,Lydyard P M,Isenberg D A.The effect of interleukin-10 and of interleukin-12 on the in vitro production of anti-double-stranded DNA antibodies from patients with systemic lupus erythematosus[J].Clin Exp Immunol,2001;124(1):118-125.
7 Giroux M,Denis F.CD1d-unrestricted human NKT cells release chemokines upon Fas engagement[J].Blood,2005;105(2):703-710.
8 Mukai M,Bohgaki T,Notoya A et al.Liver dysfunction due to apoptosis in a patient with systemic lupus erythematosus[J].Lupus,2000;9(1):74-77.
9 Zhang L,Bertucci A M,Smith K A et al.Hyperexpression of cyclooxygenase 2 in the lupus immune system and effect of cyclooxygenase 2 inhibitor diet therapy in a murine model of systemic lupus erythematosus[J].Arthritis Rheum,2007;56(12):4132-4141.
10 Denecker G,Vercammen D,Declercq W et al.Apoptotic and necrotic cell death induced by death domain receptors[J].Cell Mol Life Sci,2001;58(3):356-370.
11 Funauchi M,Sugiyama M,Sukyoo B et al.A possible role of apoptosis for regulating autoreactive responses in systemic lupus erythematosus[J].Lupus,2001;10(4):284-288.
12 Liphaus B L,Kiss M H,Carrasco S et al.Increased Fas and Bcl-2 expression on peripheral mononuclear cells from patients with active juvenile-onset systemic lupus erythematosus[J].Rheumatol,2007;34(7):1580-1584.
13 Chen Xue,Wang Lan-lan,Cai Bei et al.Abnormal Fas/FasL and caspase-3-mediated apoptotic signaling pathways of T lympho-cyte subset in patients with systemic lupus erythematosus[J].Cell Immunol,2006;239(2):121-128.
14 Nakajima A,Hirai H,Kayagaki N et al.Treatment of lupus in NZB/W F1 mice with monoclonal antibody against Fas Ligand[J].J Autoimmun,2000;14(2):151-157.
15 Habib H M,Taher T E,Isenberq D A et al.Enhanced propensity of T lymphocytes in patients with systemic lupus erythematosus to apoptosis in the presence of tumour necrosis factor alpha[J].Scand J Rheumatol,2009;38(2)112-120.
16 Llorente L,Richaud-Patin Y,Garcia-Padilla C et al.Clinical and biologic effects of anti-interleukin-10 monoclonal antibody administration in systemic lupus erythe-matosus[J].Arthritis Rheum,2000;43(8):1790-1800.
17 Anolik J H,AringerM.New treatments for SLE:cell-depleting and anticytokine therapies[J].Best Pract ResClin Rheumatol,2005;19(5):859-878.