兔抗B16黑素细胞多克隆抗体的制备及对黑素细胞增殖的影响①
2010-06-21陈菊萍罗志娟魏大鹏扬州大学第二临床医学院皮肤性病科扬州225001
陈菊萍 马 樱 罗志娟 魏大鹏 (扬州大学第二临床医学院皮肤性病科,扬州 225001)
色素减退性疾病白癜风是严重影响患者生活质量的一种疾病,其发病机制目前未完全明了,许多研究表明可能和自身免疫有很大关系[1-5],但自身免疫是初始原因还是继发原因,一直未有定论,也有研究表明和遗传、自由基对细胞的损伤等有关。
本实验通过制备兔抗B16黑素细胞多克隆抗体,利用免疫组织化学和 Western blot鉴定多克隆抗体;并通过亲和层析法纯化抗血清,得到IgG,检测其对黑素细胞增殖的影响,为进一步研究此抗体对黑素细胞生长及色素代谢的影响奠定基础,从另一方面探讨免疫因素特别是自身免疫在色素减退性疾病白癜风发病机制中所起的作用,为寻找白癜风的动物模型打下了基础。
1 材料和方法
1.1 材料 健康家兔,雄性,体重2 kg,四川大学华西实验动物中心提供。B16黑素细胞购自中国科学院上海生命科学研究所,辣根过氧化物酶标记山羊抗兔IgG,生物素化山羊抗兔IgG等试剂购自北京中杉金桥生物技术有限公司。
1.2 方法
1.2.1 B16黑素细胞培养、收集、爬片及固定 B16黑素细胞复苏后,使用含10%小牛血清的1640培养基于37℃、5%CO2条件下常规培养。收集对数生长期的黑素细胞,接种入6孔板,每孔加入4%多聚甲醛1 ml,固定后室温保存备用。
1.2.2 B16黑素细胞颗粒性抗原免疫家兔 经75%酒精固定后的B16黑素,Hank's液离心清洗细胞,最后用生理盐水悬匀成5×107ml-1免疫用B16黑素细胞混悬液。经家兔耳缘静脉注射B16免疫用黑素细胞混悬液1.0ml做第一次免疫。第7天同样方法第二次免疫家兔;第14天家兔耳缘静脉采血0.5 ml,凝集实验测血清抗B16黑素细胞抗体效价。第14天同样方法耳缘静脉注射B16黑素细胞悬液0.5 ml第三次免疫家兔;第20天家兔耳缘静脉采血0.5 ml,凝集实验测血清抗B16黑素细胞抗体效价。第20天同样方法耳缘静脉注射B16黑素细胞悬液0.5 ml第四次免疫家兔;以后分别于第23天、25天,第5次、第6次免疫和采血测定抗体效价。
1.2.3 家兔血清抗B16黑素细胞抗体效价测定-试血(试管凝集实验) 免疫三次(14天)后、四次(20天)后、免疫五次(23天)后,免疫六次(25天)后,试管凝集法分别测家兔血清抗体效价。具体方法为:分别取家兔耳缘静脉血、家兔心脏血、颈动脉血经静置,凝固,血清析出,离心,取上层血清稀释后加入U型微量反应板中,不加血清而加等量生理盐水(N.S)者作为N.S对照。将B16黑素细胞悬液加入上述U型微量反应板中,37℃孵育45分钟后观察结果。
1.2.4 B16黑素细胞爬片免疫组织化学(IHC)—SP法 B16黑素细胞爬片经4%多聚甲醛固定后,用SP法进行免疫组织化学,一抗为 1∶200、1∶500、1∶1 000倍稀释的上述所获不同免疫次数后家兔抗B16黑素细胞全血清。二抗工作液,即生物素化二抗工作液(IgG/Bio)(生物素标记山羊抗兔IgG北京中杉金桥生物技术有限公司提供,即用型),三抗为辣根过氧化物酶标记链霉卵白素工作液(S-A/HRP)(北京中杉金桥生物技术有限公司提供,即用型)。DAB显色后镜检。
1.2.5 B16黑素细胞裂解液 Western blot检测 取变性处理后的B16黑素细胞裂解液样品,每泳道加入50 μ l,30 mA恒流SDS-PAGE电泳。电泳结束后转N.C膜,5%脱脂奶粉封闭液封闭,分别加入一抗溶液即上述所获不同免疫次数后家兔抗B16黑素细胞全血清(稀释 1∶10、1∶100、1∶200、1∶500、1∶1 000倍),二抗工作液即生物素化山羊抗兔IgG(H+L)(北京中杉金桥生物技术有限公司提供),三抗工作液:PBS-T 1∶1 000倍稀释的辣根过氧化物酶标记的链霉卵白素工作液。DAB显色。检测结果。
1.2.6 亲和层析法纯化兔抗B16黑素细胞抗血清及蛋白质含量的测定
综上所述,本文研究的结果为康复医学工作者在为患者康复训练时肘关节活动度达到日常生活所需即为适合的活动角度。使康复医学工作者在为肘关节功能障碍的患者康复训练时提供一定的指导。若患者在做某项功能性动作上有困难,则要把评估和治疗这个过程放到康复训练中来;同样的,若患者已经知道肘关节的活动度不足,治疗师和康复医师就要预知患者在做相对的功能性动作时有困难,并且要建议做适当的调试,没有必要一味的去追求肘关节活动度的完全恢复。
1.2.6.1 抗血清的纯化、透析及浓缩 活化载体及偶联蛋白:购买时已经完成。利用琼脂糖珠(Protein G sepharose 4 fast flow)进行亲和层析。经透析、浓缩,收集第一峰非IgG及第二峰IgG。
1.2.6.2 紫外(UV)吸收测定法测定第一峰及第二峰蛋白质含量 应用752型紫外光栅分光光度仪,选用光程为1 cm的石英比色杯,在280 nm波长处分别测定各管(未纯化抗血清,纯化第一峰即非IgG,纯化第二峰即IgG)溶液的A280值。绘制标准曲线,得到回归方程。按照标准曲线及方程,分别求得其蛋白质的浓度。
1.2.7 全血清及非IgG、IgG SDS-PAGE变性/非变性电泳 将样品1:未纯化兔抗B16黑素细胞抗血清;样品2:收集第一峰即非 IgG;样品 3:第二峰(IgG),用于变性电泳;样品4:第二峰(IgG),用于非变性电泳。处理后按1.2.5的方法上样及电泳。于1 mg/ml的考马司亮蓝中染色3小时。脱色:染色结束后,取出分离胶置于脱色液中,室温脱色过夜。观察结果。
1.2.8 MTT比色法检测全血清、非IgG及IgG对B16黑素细胞增殖的影响 在96孔细胞培养板中分别加入全血清、非IgG及IgG,用正常兔IgG和非IgG为对照,再分别加入B16黑素细胞悬液100 μ l,均为3复孔,重复2次。37℃,5%CO2培养箱中培养过夜。在培养 24、48、72小时每孔加入 5 mg/ml的MTT 10 μ l,37℃,5%CO2培养箱中继续培养4小时,每孔加入二甲基亚砜(DMSO)100 μ l,轻轻振摇20分钟,使结晶尽量完全溶解。ZS-3型板式酶标仪测570 nm各孔吸光值。
1.3 统计学分析 使用SPSS 11.5软件,用重复测量方差分析检验,以P<0.05,有显著性差异,数据使用±s。
2 结果
2.1 兔抗B16黑素细胞抗血清效价检测结果 见表1,以B16黑素细胞悬液作为颗粒抗原经家兔耳静脉分别免疫14天后,用试管凝集法测抗血清效价达1∶80;20天和23天后分别测其效价高达1∶1 280,此时抗B16黑素细胞多克隆抗体效价以达到较高水平,提示可以进行抗血清收集。
B16黑素细胞爬片的免疫组化显示在兔抗B16黑素细胞抗血清 1∶200、1∶500、1∶1 000 倍稀释时,均可见细胞浆内有明显的棕黄色颗粒,突触中也可见细小的阳性颗粒;而阴性对照中胞浆仍未浅蓝色,未出现阳性颗粒,说明免疫所得的抗血清效价较高,如图1。
2.3 B16黑素细胞裂解液 Western blot检测结果
选择兔抗B16黑素细胞抗血清即一抗稀释度为1∶500,生物素化二抗稀释度为1∶1 000,做B16黑素细胞裂解物的 Western blot检测。检测结果见图2。图中可见蛋白条带较多,说明所制备的抗血清是抗B16黑素细胞胞浆中多种蛋白成分的多克隆抗体。
2.4 亲和层析法纯化兔抗B16黑素细胞抗血清结果 利用琼脂糖珠(G protein)亲和层析法将兔抗B16黑素细胞多克隆抗体纯化,可见两个明显的吸收峰,第一峰为非IgG杂蛋白吸收峰,第二峰即洗脱峰是纯化所得抗体IgG(图未列出)。
2.5 紫外(UV)吸收测定法测定非IgG及IgG蛋白质含量 结果表明抗血清纯化效果较好,浓度均达到预期值(数据未列出)。
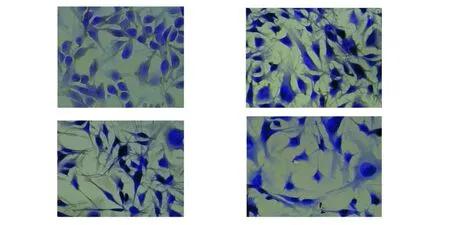
图1 免疫组化分析抗血清效价(20×20)Fig.1 Expression of titer antiserum by IHC(20×20)
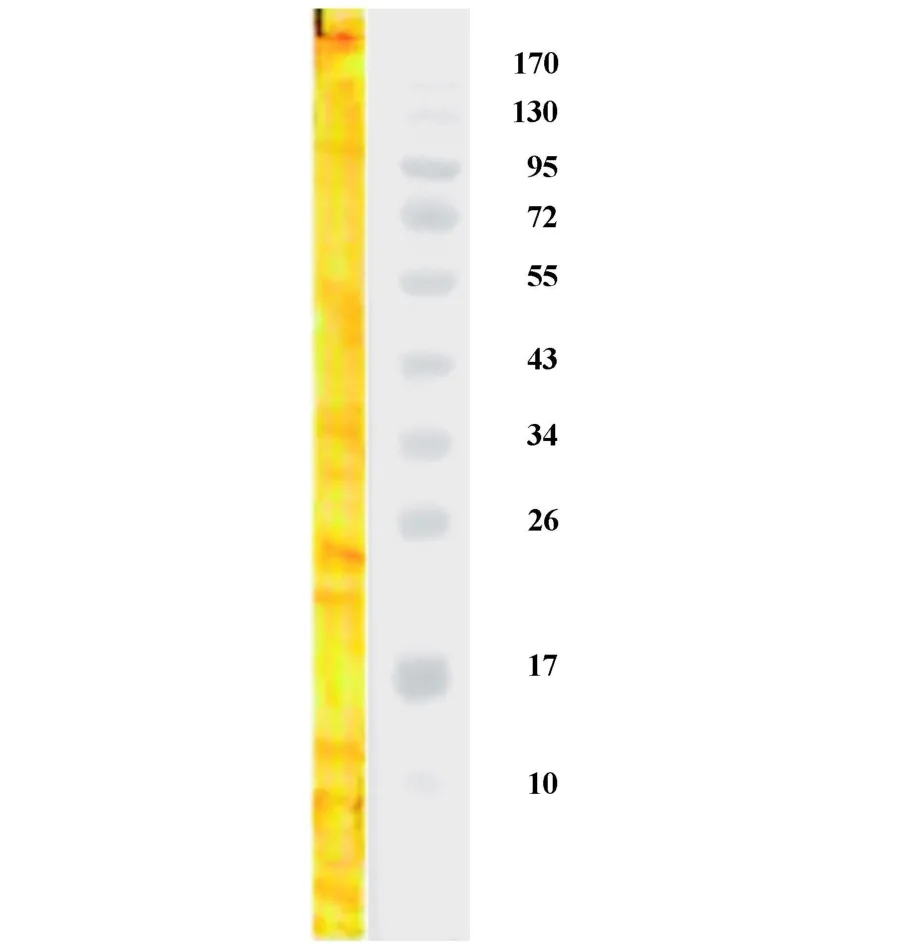
图2 Western blot分析B16黑素细胞胞浆中蛋白的表达Fig.2 Expression of protein in B16 melanocyte plasma by Western blot
2.6 全血清及非IgG、IgG的SDS-PAGE变性/非变性电泳结果 SDS-PAGE结果显示全血清即未纯化抗血清蛋白条带较多,包括分子量 116.0、66.2、45.0、35.0、25.0 kD的蛋白条带;非IgG则主要包括分子量116.0、45.0、35.0 kD的蛋白条带;变性 IgG包括分子量66.2、35.0、25.0 kD的蛋白条带,其中66.2 kD处有两条条带,非变性IgG在66.2 kD处仅一条条带(如图3)。
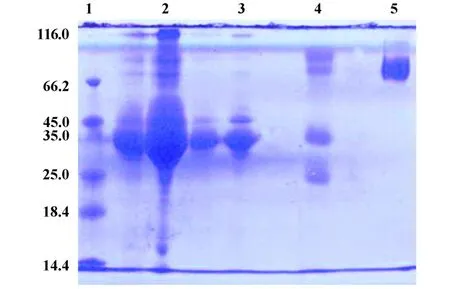
图3 全血清及非IgG、IgG的 SDS-PAGE变性/非变性电泳Fig.3 Expression of protein by SDS-PAGE

图4 MTT法检测各组分对B16黑素细胞增殖的影响Fig.4 The effect of composition of antiserum on B16 melanocyte proliferation by MTT
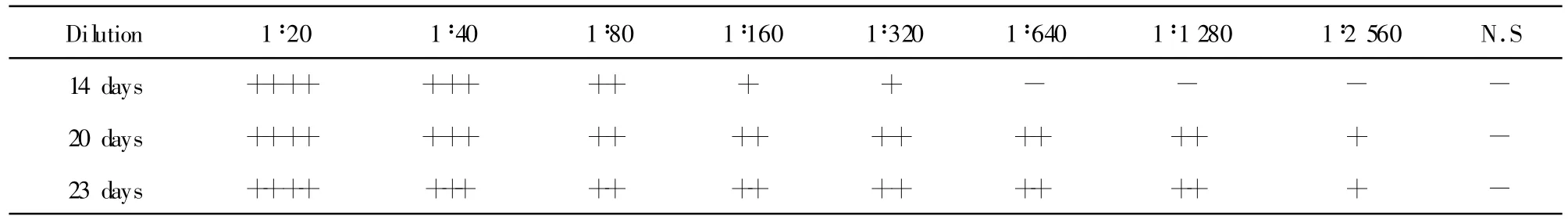
表1 B16黑素细胞免疫家兔后第14天、第20天、第23天检测抗血清效价结果Tab.1 the titer of the antiserum immuned by B16 melanocytes after 14,20,23 days
2.7 MTT比色法检测全血清、非IgG和IgG对B16黑素细胞增殖的影响结果 用重复测量方差分析法,得P=0.012<0.05,IgG组与其余两组相比,对B16黑素细胞增殖的影响差异显著(如图4)。
3 讨论
白癜风是一种常见的色素减退性疾病,表现为皮肤或粘膜因为黑素细胞的缺失而导致的后天性色素减退,其确切的发病机制至今未完全清楚,有学者研究发现[6-8],白癜风患者中自身免疫性疾病的发生率明显高于正常人,白癜风患者易合并甲状腺炎、糖尿病、风湿性关节炎、斑秃及银屑病等等与自身免疫有关的疾病,其血清中存在多种自身抗体和细胞免疫异常现象,如IgC、IgA、IgM 均显著高于正常人,皮损直接免疫荧光检查可见表皮基底膜有IgG和C3沉积,白癜风患者血清中抗黑素细胞抗体阳性率高达50%~93%,从白癜风的皮损中我们也发现有T淋巴细胞的浸润[9,10],这些都证明白癜风与体液免疫和细胞免疫有关,但免疫异常究竟是初始原因还是继发的反应一直未有定论。也有学者进行了流行病学调查,发现白癜风患者的一级亲属中自身免疫性疾病的发病率明显高于正常人群,并发现了一些易感基因[11-13]。近几年也有学者认为,H2O2及其代谢产物介导了一些抗氧化酶特别是过氧化氢酶、硫氧还蛋白还原酶、谷胱甘肽过氧化物酶、谷胱甘肽还原酶、超氧歧化酶等的改变,H2O2介导的氧化使许多蛋白功能丧失,从而引发色素代谢异常,而H2O2的产生可能与一些免疫异常有关,认为免疫异常是初始原因,H2O2的产生是继发的[14-20],但是由于缺乏很好的动物模型,白癜风的发病机制至今未完全清楚。
本实验采用B16黑素细胞悬液作为颗粒抗原,经家兔耳缘静脉注射,使其产生抗B16黑素细胞的多克隆抗体,即抗血清,并经纯化得到IgG,观察IgG对B16黑素细胞生长及色素代谢的影响。在体外实验中,我们利用MTT比色法分别检测全血清、非IgG、IgG对B16黑素细胞增殖的影响。结果表明IgG组与其余两组相比,对B16黑素细胞生长抑制作用差异显著,启发我们在体内实验时,可以将三组分别注射入小鼠皮肤,从肉眼、免疫组化等多方面观察皮肤色素的变化,此实验为进一步研究IgG对黑素细胞色素代谢的影响、IgG对黑素细胞细胞毒试验、诱导黑素细胞凋亡、对黑素细胞酪氨酸酶及相关蛋白表达的影响奠定了基础,进一步证明了自身免疫因素在色素减退性疾病白癜风发病机制中起了一定的作用。
1 Steitz J,Bruck J,Lenz J.Peripheral CD8+T cell tolerance against melanocytic self-antigens in the skin is regulated in two steps by CD4+T cells and local inflammation:implications forthe pathophysiology of vitiligo[J].J Invest Dermatol,2005;124(1):144-150.
2 Wang X,Erf G F.Melanocyte-specific cell mediated immune response in vitiliginous Smyth Line chickens[J].J Autoimmun,2003;21(2):149-160.
3 Spritz R A.The genetics of generalized vitiligo and associated autoimmune diseases[J].J Dermatol Sci,2006;41:3-10.
4 Iacovelli P,Sinagra J L,Vidolin A P.Relevance of thyroiditis and of other autoimmune diseases in children with vitiligo[J].Dermatology,2005;210(1):26-30.
5 Zettinig G,Tanew A,FischerG.Autoimmune diseases in vitiligo:do antinuclear antibodies decrease thyroid volume[J].Clin Exp Immunol,2003;131(2):347-354.
6 王 鹰,刁庆春.白癜风的发病机制研究进展[J].第三军医大学学报,2002;24(11):s61-s62.
7 Onunu A N,Kubeyinje E P.Vitiligo in the Nigerian African:a study of 351 patients in Benin City,Nigeria[J].Int J Dermatol,2003;42:800-802.
8 Rezaei N,Gavalas N G,WeetmanA P et al.Autoimmunity as an aetiological factor in vitiligo[J].Eur Acad Dermatol Venereol,2007;21:865-876.
9 Van den Wijngaard R,Wankowicz-Kalinska A,Le Poole C.Local immune response in skin ofgeneralised vitiligo patients.Destruction of melanocytes is associated with the prominent presence of CLA+T cells at the perilesional site[J].Lab Invest,2000;80:1299-1309.
10 Al Badri A M T,Todd P M,Garioch J J.An immunohistological study of cutaneous lymphocytes in vitiligo[J].J Pathol,1994;170:149-155.
11 Fain P R,Babu S R,Bennett D C et al.HLA class IIhaplotype DRB1*04-DQB1*0301 contributes to risk of familial generalized vitiligo and early disease onset[J].Pigment Cell Res,2005;19:51-57.
12 Zhang Z,Xu S X,Zhang F Y et al.The analysis of genetics and associat-ed autoimmune diseases in Chinese vitiligo patients[J].Arch Dermatol Res,2009;301:167-173.
13 Arcos-BurgosM,Parodi E,Salgar M et al.Vitiligo:complex segregation and linkage disequilibrium analyses with respect to microsatellite loci spanning the HLA[J].Hum Genet,2002;110:334-342.
14 Salem M M,Shalbaf M,Gibbons N C et al.Enhanced DNA binding capacity on up-regulated epidermal wild-type p53 in vitiligo by H2O2-mediated oxidation:a possible repair mechanism for DNA damage[J].FASEB J,2009;23:1-18.
15 Chavab B,Beazley W,Wood J M et al.H2O2increase de novo synthesis of(6R)-L-erythro-5,6,7,8-tetrahydrobiopterin via GTP cyclohydrolase I and its feedback regulatory protein in vitiligo[J].J Inhert Metab Dis,2009;32(1):86-94.
16 Schallreuter K U,Gibbons N C,Zothner C et al.Hydrogen peroxide-mediated oxidative stress disrupts calcium binding on calmodulin:more evidence for oxidative stress in vitiligo[J].Biochem Biophys Res Commun,2007;360(1):70-75.
17 Shalbaf M,Gibbons N C,Wood J M et al.Presence of epidermal allantoin further supports oxidative stress in vitiligo[J].Exp Dermatol,2008;Sep;17(9):761-770.
18 Spencer J D,Gibbons N C,Böhm M et al.The Ca2+-binding capacity of epidermal furin is disrupted by H2O2mediated oxidation in vitiligo[J].Endocrinology,2008;149(4):1638-1645.
19 Slominski A,Tobin D J,Shibahara S et al.Melanin pigmentation in mammalian skin and its hormonal regulation[J].Physiol Rev,2004;84:1155-1228.
20 Wood J M,DeckerH,Hartmann H et al.Senile hair graying:H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair[J].FASEB J,2009;23:2065-2075.