重组人促甲状腺激素β亚基的切胶纯化及多克隆抗体制备①
2010-06-21李敬华柳明波左爱军梁东春
李敬华 柳明波 马 彦 左爱军 孙 蓓 梁东春 郭 刚
(天津医科大学代谢病医院/内分泌研究所,卫生部及天津市激素与发育重点实验室,天津 300070)
目前国内科研及检测所需抗hTSH抗体主要依赖于国外公司生产,严重制约了国内科研及相关工作的开展。本室自行构建了hTSH β链的原核表达系统,表达了重组GST-hTSHβ融合蛋白,进一步纯化后可做为免疫原来制备抗hTSH β链的抗体。由于大分子重组蛋白在大肠杆菌中高水平表达时易于形成包涵体。虽然易于将包涵体与可溶性蛋白分开,但自包涵体中溶解出目的蛋白则需经过洗涤、溶解、复性和透析脱盐等多步,在这个过程中易造成蛋白变性、浓度降低,致使动物免疫时不能保持足够的抗原性和浓度要求。本实验用切胶纯化法纯化了GST-hTSHβ重组蛋白,并运用该蛋白免疫了新西兰大耳朵白家兔,成功制备了相应的高效价抗血清。
1 材料与方法
1.1 材料
1.1.1试剂 含有pGEX-3X/hTSHβ重组质粒的E.coli DH5α菌株由本室构建及保存[1];BCA蛋白浓度测定试剂盒,免疫佐剂氢氧化铝购自美国Pierce公司;雄性新西兰大耳朵白家兔购自北京维通利华实验动物有限公司,人促甲状腺激素(hTSH)购自美国Sigma公司;辣根过氧化物酶(HRP)标记羊抗兔IgG抗体购自武汉博士德生物工程有限公司。蛋白胨、酵母粉均为Sigma分装。
1.1.2 器材 ∑960型全自动酶标测定仪(美国Metertech公司);96孔酶标板(丹麦Nunc公司);电泳仪(PowerPacTMHC,Power Supply BIO-RAD);垂直电泳槽(Mini-PROTEAN 3,Cell BIO-RAD)。
1.2 方法
1.2.1 重组GST-hTSHβ在 E.coli DH5α中的诱导表达 将-80℃保存的含有 pGEX-3X/hTSHβ的 E.coli DH5α菌株复苏后,挑取单菌落接种于含有100 mg/L氨苄青霉素的LB液体培养基中,37℃震荡培养14~16小时,按1∶100接种于相同的培养基中,37℃震荡培养3~5小时,当A600达到0.6左右后,加入IPTG至终浓度为1.0 mmol/L,继续震荡培养4~6小时后离心收获细菌,超声碎菌后,8 500 r/min 4℃离心15分钟分别收集沉淀及上清行SDS-PAGE。
1.2.2 切胶制备GST-hTSH β重组蛋白 配制1.5 mm厚度3.3%的浓缩胶和10%的分离胶,将适量包涵体用1 ml 1×上样缓冲液悬浮,沸水浴5分钟,进行还原型SDS-PAGE。电泳结束后取下凝胶,在预冷的去离子水中漂洗5分钟,预冷的0.25 mol/L KCl溶液浸泡10分钟,蛋白条带呈现乳白色。准确切割下含有GST-hTSHβ蛋白样品的凝胶置于研钵中加入液氮充分研磨成粉末状。加入500 μ l 0.01 mol/L PBS(pH 7.5)充分溶解、混匀后,使用空针式滤器过滤后-20℃保存[2]。BCA法测定所得GST-hTSHβ溶液的蛋白浓度,按照BCA测定试剂盒说明操作。SDS-PAGE,考马斯亮蓝R250染色及 Western blot对纯化后的蛋白进行鉴定。
1.2.3 实验动物的免疫 雄性大耳朵白家兔正常饲养一周,观察无异常后进行首次免疫。取适量GST-hTSHβ蛋白溶液与同体积氢氧化铝免疫佐剂混合,室温持续搅拌30分钟。首次免疫抗原量按100 μ g/kg于家兔背部皮下10~12点注射;分别于首次免疫后7、28、42、56天进行加强免疫,抗原量减半。每次免疫前从兔耳缘静脉采血3 ml,分离血清后-80℃冻存备用。
1.2.4 兔抗hTSHβ抗体效价测定 ELISA检测兔抗hTSHβ抗血清效价。以购买的 hTSH 20 μ g/ml,100 μ l/孔4℃过夜包被96孔酶标板。将免疫后不同时间点采集的兔血清用PBST进行系列稀释(1∶1 000,1∶2 000,1∶4 000,1∶8 000,1∶12 000),以 PBST(0.01 mol/L PBS含0.05%Tween-20 pH7.4)100倍稀释免疫前兔血清作为阴性对照。包被好的酶标板洗板后加入1%BSA 溶液 200 μ l/孔,37℃温育30分钟;洗板后分别加入阴性对照或不同稀释度的免疫后血清各100 μ l,37℃30分钟,洗板后加入HRP标记的羊抗兔IgG 工作液(1∶5 000 稀释)100 μ l,37℃30分钟,洗板后加入TMB底物,室温显色15分钟后加入终止液,使用酶标仪读取450 nm处的吸光度值,并以实验组吸光值≥2倍阴性对照组吸光值时的最大稀释度作为该抗体的效价。
1.2.5 血清收集及饱和硫酸铵逐级沉淀粗提IgG首次免疫42天后麻醉下采集家兔血液,获得抗血清。取血清20 ml,加入等体积0.01 mol/L PBS(pH 7.4)混匀,于4℃缓慢逐滴加入预冷的饱和硫酸铵溶液40 ml,轻轻搅拌混匀后4℃静置过夜;离心(4℃,12 000 r/min)10分钟,弃上清;沉淀用12 ml 0.01 mol/L PBS溶解后,缓慢逐滴加入预冷的饱和硫酸铵溶液8 ml,4℃静置1小时;同上离心后,弃上清;沉淀用13.4 ml 0.01 mol/L PBS溶解,缓慢逐滴加入预冷的饱和硫酸铵溶液6.6 ml,4℃静置1小时;再次离心,弃上清,沉淀用少许0.01 mol/L PBS溶解,装入预处理的透析袋中(透析袋用去离子水煮沸10分钟,换液后重复一次);在4℃冷柜中用20倍体积0.02 mol/L PBS持续透析3天,期间换液数次;透析后溶液经离心(4℃,3 000 r/min,20分钟)后取上清,用BCA测定试剂盒测定蛋白浓度,分装后保存于-80℃。分别用于以下两种方法纯化。
1.2.6 DEAE纤维素柱离子交换层析纯化IgG 称取20 g DEAE-32纤维素干粉,用0.5 mol/L NaOH 200 ml浸泡30分钟,抽滤后用去离子水洗至中性;再用0.5 mol/L HCl 200 ml浸泡30分钟,抽滤后用去离子水洗至中性;再用0.5 mol/L NaOH 200 ml浸泡30分钟,抽滤后用去离子水洗至中性。随后以600ml 0.02 mol/L PBS(pH 7.4)悬浮,常温下静置 4小时后倾去细微颗粒。将平衡好的DEAE-32纤维素搅起后沿管壁倒入含有一半柱高0.02 mol/L PBS的层析柱中。取适量体积上述粗纯的IgG上样,收集流出液测定蛋白含量后分装冻存于-80℃。
1.2.7 Protien A琼脂糖凝胶亲和层析法[3]纯化IgG
称取Protien A SEPHAROSE CL-4B干粉250 mg,加3.5倍体积PBS充分溶胀,室温平衡过夜。将溶胀好的柱料注入层析柱,使自然沉降。沉好后的柱料约1 ml。用大于5倍柱床体积的PBS冲洗柱料,然后将经饱和硫酸铵粗提后蛋白200 μ l上于柱料上层,4℃静置过夜。用PBS充分清洗,去除杂蛋白。然后用0.1 mol/L的甘氨酸-HCl(pH 2.8)洗脱目的蛋白。用0.01 mol/L PBS透析后用BCA测定试剂盒测定蛋白含量,并分装冻存于-80℃。
2 结果
2.1 GST-hTSHβ融合蛋白的切胶纯化 对比重组质粒pGEX-3X/hTSHβ和空质粒pGEX-3X的表达产物可见,重组GST-hTSHβ蛋白在大约42 kD左右有大量表达(图1),主要以包涵体形式存在。目的蛋白占碎菌沉淀样本总蛋白的百分比为26.57%。BCA法测得碎菌沉淀总蛋白的浓度约为65.77mg/L培养基。经估算,GST-hTSHβ融合蛋白的表达量约为17.48 mg/L培养基。切胶回收后的样本于SDSPAGE中仅见GST-hTSHβ融合蛋白单一条带(图2)。经BCA法测定该回收样本的蛋白含量为14.92 mg/ml,切胶回收后目的蛋白的收率为85.33%。切胶纯化后的GST-hTSHβ蛋白经 Western blot鉴定为目的条带(图3)。

图1 GST-hTSH β重组蛋白表达SDS-PAGEFig.1 SDS-PAGE of GST-hTSH β fusion protein
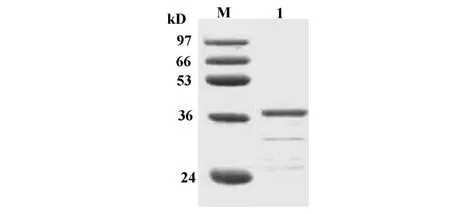
图2 切胶纯化后 GST-hTSH β SDS-PAGEFig.2 SDS-PAGE of Gel purified GST-hTSHβ
2.2 ELISA测定免疫所得兔血清抗体效价 经ELISA测定后判定该兔免疫28、42、56天后的抗hTSH的抗体效价分别达到了1∶4 000、1∶8 000和1∶12 000(图 4)。
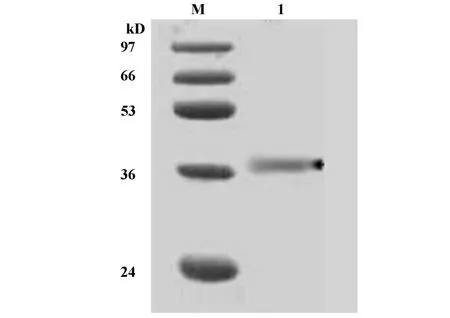
图3 切胶纯化后GST-hTSH β Western blot鉴定Fig.3 The analysis of G el purified GST-hTSH β by Western blot
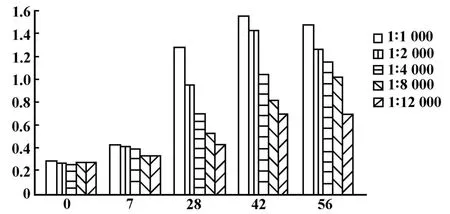
图4 兔血清抗体效价ELISA检测Fig.4 Anti-hTSH β specific antibody titers in sera of immunized rabbit by ELISA

图5 两种方法纯化IgG效果比较Fig.5 Comparision of two methods purified IgG
2.3 两种方法纯化多克隆抗体IgG效果的比较采用BCA法测定蛋白含量,经计算,20 ml血清中经饱和硫酸铵沉淀后血清IgG含量为12.28 mg,平均分成2份,一份用离子交换纯化法后 IgG含量在2.61 mg左右,Protien A琼脂糖凝胶亲和层析法纯化后IgG含量在4.87 mg左右。采用非还原型 SDSPAGE测定IgG纯度,结果如图5,得到了一定纯度的抗体。
3 讨论
小分子蛋白质作为免疫原时很难刺激起较高的免疫学反应,这对于制备高效价抗体来说是很不理想的。为了获得高效价的抗体多将该类分子与大分子蛋白如BSA等相偶联,以期增强实验动物的免疫学反应,这一方法已被广泛应用并获得了良好的效果[4]。但是偶联的过程本身较为复杂,同时会损失部分样品,对于较珍贵的蛋白质来说其代价昂贵。本研究中的重组hTSHβ蛋白也存在该问题,故实验设计之初就考虑为其加上GST标签,一方面增加了重组蛋白的免疫原性,另一方面为纯化该蛋白打下了基础。本实验采用市售的hTSH标准品,而非免疫所用的GST-hTSHβ重组蛋白来监测兔血清中抗TSHβ抗体的效价,既避免了抗GST抗体对效价的影响,也证实了该抗体对正常的hTSH有很好的识别。
免疫所产生抗体的特异性很大方面取决于所使用的免疫原的纯度。因此,如欲获得高特异性的抗体,必须先予纯化抗原。不同的重组蛋白需要采用不同的纯化方式,通常要用到凝胶过滤,离子交换和亲和层析等纯化方法[5]。这些方法的应用对实验室条件和仪器设备要求较高,而且在获得蛋白质高纯度的同时也带来了低收率的弊病。对于一般的实验室来说是很难承受蛋白纯化过程中的花费和繁琐的。本室构建的GST-hTSHβ融合蛋白在实验设计之初拟采用GST亲和层析纯化,但是在实验过程中我们发现所纯化的融合蛋白并未能达到预期的纯度且纯化步骤烦琐费时,往往一次所能纯化的蛋白量很有限,为获得所需蛋白用量需多次反复进行。切胶免疫的应用则为我们提供了便利,所分离的蛋白不仅纯度高而且凝胶在研磨后可以起到类似于免疫佐剂样的作用[6,7]。陈鸿军[8,9]等的系列研究也证实切胶免疫尚能满足单克隆抗体的制备。本实验用该法获得的抗原成功制备出了hTSHβ的多克隆抗体,其阳性血清效价达1∶12 000。因此,切胶免疫的方法完全可满足动物抗体制备的需求。与其他蛋白纯化方法相比具有以下优点:①简单易行:可以省去多次洗脱柱子处理柱子的繁琐工作,无需复杂的仪器设备。②价格低廉:实验中所用的试剂均为普通试剂,容易得到且便宜,不需要昂贵的蛋白纯化柱。③应用范围广,可用于绝大多数蛋白的纯化。本实验的结果也证明了这种方法是便捷、高效、经济的。
对于经饱和硫酸铵粗体后的多克隆抗体IgG,我们应用两种方法进行纯化,并比较纯化效果。结果我们认为两种方法纯化后IgG的纯度保持一致,但是经Protien A琼脂糖凝胶亲和层析法纯化后的IgG浓度较高。认为Protien A琼脂糖凝胶亲和层析法是一种高纯度、有实用价值的纯化方法[10,11]。
1 马香书,马 彦,孙 蓓 et al.大肠杆菌偏嗜性人促甲状腺激素β亚基编码DNA序列的克隆及表达[J].天津医药,2009;37(5):340-342.
2 景 巍,王转花.一种快速纯化蛋白的电洗脱方法[J].生物技术,2004;14(2):30-32.
3 McCue J T,Kemp G,Low D et al.Evaluation of protein-A chromatography media[J].J Chromatogr A,2003;989(1):139-153.
4 左爱军,梁东春,郭 刚.重组人ω-干扰素的制备及活性分析中国免疫学杂志[J].2006;22(10):940-943.
5 Roque A C A,Christopher R L,Taipa M A.Antibodies and genetically engineered related molecules:production and purification[J].Biotechnol Prog,2004;20(3):639-654.
6 姜 静,孙其飞,陈 勇.切胶免疫制备腮腺液高丰度蛋白多克隆抗体[J].北京口腔医学,2007;15(5):254-256.
7 于在江,马学恩,周建华.切胶纯化表达蛋白包涵体的可行性分析[J].生物技术,2007;17(3):46-48.
8 陈鸿军,宋翠萍,秦爱建 et al.MDV-1 VP22羧基端在大肠杆菌中高效可溶性表达[J].中国病毒学,2006;21(2):169-172.
9 宋翠萍,陈鸿军,秦爱建 et al.抗MDV1VP22羧基端单克隆抗体的制备与免疫学特性鉴定[J].细胞与分子免疫学杂志,2007;23(2):183-186.
10 Swinnen K,Krul A,Van Goidsenhoven et al.Performance comparison of protein A affinity resins for the purification of monoclonal antibodies[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007;848(1):97-107.
11 Hahn R,Shimahara K,Steindl F et al.Comparison of protein A affinity sorbents(Ⅲ):Life time study[J].J Chromatogr A,2006;1102(1-2):224-231.