COX-2和MMP-7在大肠癌组织中的表达及意义
2010-06-21李霞朱清静蔡艳萍周星朱尤庆罗峻
李霞 朱清静 蔡艳萍 周星 朱尤庆 罗峻
(1.武汉市医疗救治中心; 2.武汉大学中南医院消化内科;3.武汉大学中南医院病理科 湖北武汉 430023)
大肠癌(colorectal carcinoma,CC)是一种常见的消化道恶性肿瘤,近20年来,其发病率逐年增加。环氧合酶-2(cyclooxygenase-2,Cox-2)作为花生四烯酸转化为前列腺素(prostaglandin,PG)途经中的限速酶,已被证明在多种肿瘤组织中均有表达,参与肿瘤的发生、发展;基质金属蛋白酶(matrix metalloproteinases,MMPs)能降解细胞外基质及血管基底膜,可能促进肿瘤细胞的浸润和血管的形成。本研究应用免疫组化技术,对40例大肠癌及相应癌旁组织COX-2蛋白及MMP-7蛋白表达情况进行了检测,旨在探讨COX-2及MMP-7在大肠癌发生发展中的作用,为大肠癌的靶向治疗提供理论依据。
1 材料与方法
1.1 材料
40例标本取自武汉大学中南医院2004~2008年间外科手术切除经病理确诊且资料完整的原发性大肠癌病例,所有患者术前未经放疗和化疗。男性患者30例,女性患者10例,年龄36~84岁。其中结肠癌为18例,直肠癌为22例。大体形态:隆起型31例,溃疡型9例。癌组织直径:<5cm30例;≥5cm10例。Dukes分期:A期7例,B期5例,C期5例,D期23例。组织学分类:高、中分化癌31例,低、未分化癌9例。癌转移情况:有淋巴结转移20例,无淋巴结转移20例;有血道转移23例,无血道转移17例。浸润深度:浸润至肌层11例,浸润至浆膜(包括穿透浆膜)29例。
1.2 方法
每例取原发癌组织、切缘正常组织及淋巴结组织,组织经10%福尔马林固定,石蜡包埋,4μm连续切片,分别进行HE染色和免疫组化SP染色(操作按试剂盒说明书进行)。兔抗人Ang-2多克隆抗体为武汉博士德生物工程公司产品。SP试剂盒购自福建迈新公司。以PBS代替一抗作阴性对照。
1.3 结果判定
COX-2及MMP-7阳性染色为细胞浆棕黄色颗粒沉着,根据胞浆染色程度和染色细胞百分比进行评分。染色程度:基本不着色者为0分;着色淡者为1分;着色适中者为2分;着色深者为3分。染色细胞百分比:着色细胞占计数细胞<10%为0分;11%~30%为1分;31%~50%为2分;51%~100%为3分,将每张切片着色程度和着色细胞百分比得分相乘最后得分0~2分者为阴性,≥3分者为阳性[1]。
1.4 数据处理
采用SPSS 11.5统计软件对数据进行Fisher exact probability test检验,检验水准α=0.05。
2 结果
2.1 大肠癌组织及癌旁正常组织中COX-2及MMP-7蛋白的表达。大肠癌组织COX-2蛋白表达阳性率87.5%(35/40),癌旁正常组织COX-2蛋白表达阳性率25%(10/40)。结果表明,COX-2蛋白在大肠癌组织中表达较正常组织高,两者差异显著(P<0.01)(图1)。大肠癌组织MMP-7蛋白表达阳性率85%(34/40),癌旁正常组织MMP-7蛋白表达阳性率35%(14/40)。结果表明,MMP-7蛋白在大肠癌组织中表达较癌旁正常组织高,两者差异显著(P<0.01)(图2)。
2.2 COX-2蛋白及MMP-7蛋白表达与大肠癌临床特征的关系
COX-2蛋白及MMP-7蛋白表达水平与患者性别、年龄及癌的部位、体积、组织分化程度、淋巴结转移五官,与癌的大体形态、肠壁浸润深度、血道转移及临床分期均未见统计学差异(P>0.05)。
2.3 COX-2与MMP-7蛋白表达间的相关性
COX-2阳性表达组中MMP-7阳性率为91.4%(32/35),COX-2阴性表达组中MMP-7阳性率为40%(2/5),二者差异具有统计学意义(P<0.05)。MMP-7阳性表达可能与COX-2有关。
3 讨论
环氧合酶(cyclooxygenase,COX)是一种完整的膜结合蛋白,是分解花生四烯酸(AA)生成各种内源性前列腺素(PGs)过程中的重要的限速酶。目前认为,COX有2种亚型,两者在正常和病理组织中发挥着不同的作用。其中的COX-2是一种可诱导型酶,在正常生理状态下,多数组织检测不到,当细胞接受相应刺激后,便开始合成表达。近年来大量研究表明,80%~90%的大肠癌中存在COX-2的高表达[2~4],主要反映在COX-2的蛋白水平及mRNA水平,提示COX-2可能参与大肠癌的发生和发展。本研究结果显示大肠癌组织中COX-2的阳性表达率为87.5%,显著高于正常大肠组织的25%(P<0.01),结果支持COX-2的异常表达与大肠癌发生密切相关的论点。Hong et al[5]发现随着结直肠癌的进展,COX-2的表达也随之升高,且COX-2的表达水平与肿瘤的增殖活性、肿瘤生长部位、Dukes分期以及分化程度也有关。Sheehan et al[6]的研究显示,在76例结直肠癌患者的研究中,COX-2的高表达与肿瘤的分期、肿瘤大小和淋巴结转移有关。但也有研究发现,COX-2的高表达只与腺癌的组织类型有关,与腺癌患者的性别、淋巴结转移与否及腺癌生长部位等病理指标无关[7]。我们的研究发现,在40大肠癌患者中有35例表达COX-2蛋白,但COX-2的高表达与大肠癌各临床病理指标之间没有统计学相关性,COX-2的表达只是大肠癌中的一个普遍事件。我们的结果与Zhan et al[8]人的结果一致。他们在研究COX-2与进展期结直肠癌病人临床病理指标的关系中,发现COX-2的表达与年龄、性别、肿瘤大小和生长部位、分化程度及Dukes分期均无明显相关性。国内其他相关研究也基本支持这个结果。陈志康等人用免疫组化的方法发现,COX-2在大部分癌组织和全部转移淋巴结中明显升高,但与肿瘤细胞的分化、分期、部位和患者的性别及年龄的相关性无统计学意义[9]。因此我们认为COX-2的高表达只是大肠癌中的一个普遍事件,与各临床指标无关。
基质金属蛋白酶(MMPs)是一组依赖Zn2+的细胞外基质、基底膜的重要降解蛋白酶,到目前已有20余种MMP分子被人工克隆成功,MMP-7是MMP家族中最小的独立分子,也是唯一的由上皮肿瘤特异性表达的酶,可降解Ⅵ型胶原、弹力素、层连蛋白等构成基底膜和ECM的成分。本实验结果显示 MMP-7只在癌细胞内表达,基质细胞基本不表达。癌组织MMP-7阳性表达率为85%,显著高于癌旁正常组织的25%(P<0.01),提示MMP-7在大肠癌的发生或发展中起着重要作用。进一步分析未显示MMP7与大肠癌各临床病理指标之间具有统计学相关性,但有文献报道MMP-7与肿瘤浸润转移密切相关,Adachi et al[10]报告MMP-7在大肠癌浸润先端癌细胞中的高表达和淋巴结转移、肿瘤分期、预后不良呈正相关。此差异考虑是由于本实验病例总数太少,尤其是MMP-7阴性表达病例太少之故。
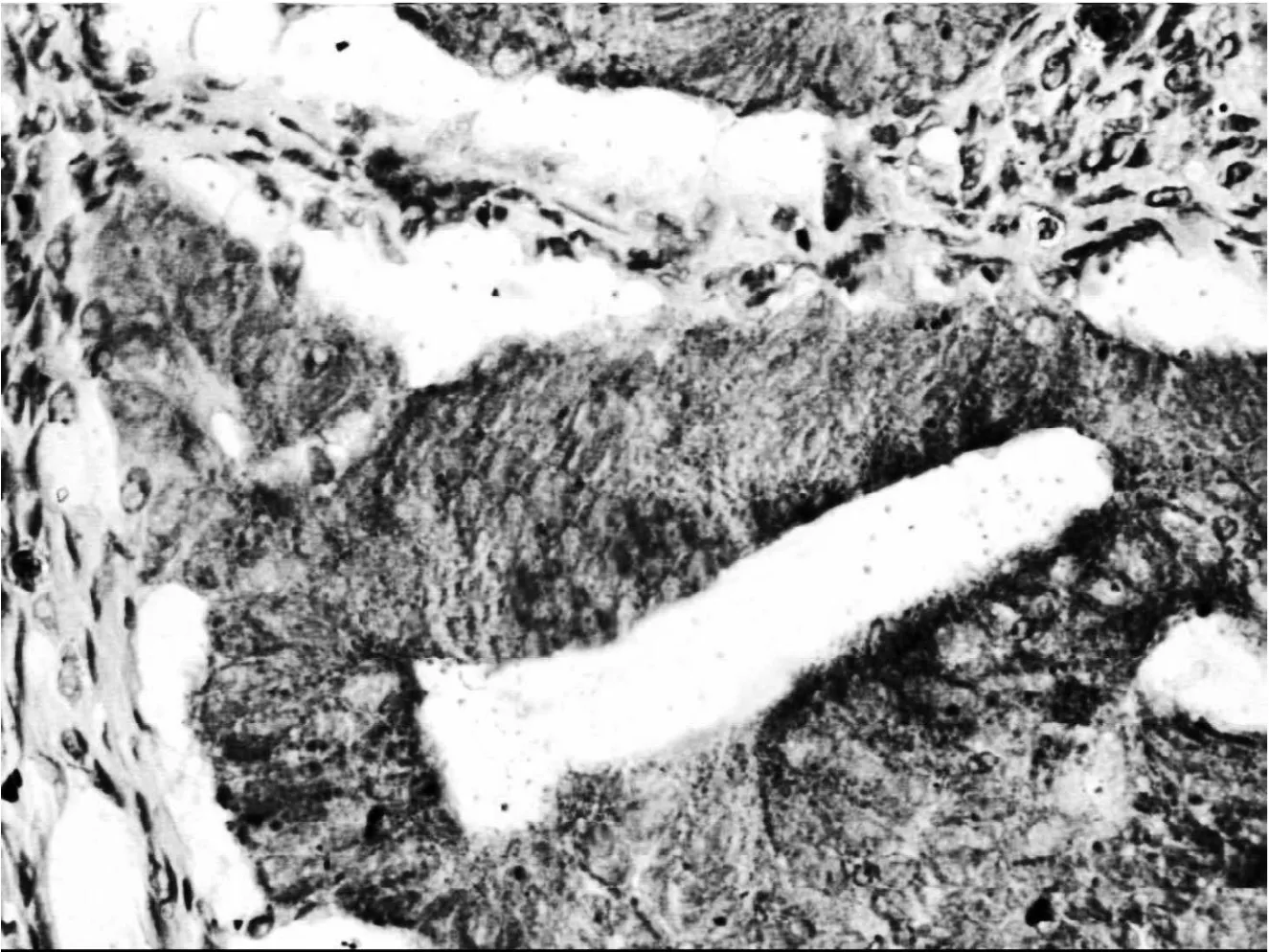
图1 大肠癌组织中COX-2阳性染色SP法×400Figure 1 Immunohistochemical staining for COX-2 in colorectal carcinoma by streptacidin-peroxidase coiugated method×400
临床研究资料[11]表明COX-2诱导酶及其花生四烯酸产物PGD2,PGE2的释放,在MMP-1,MMP-9的产生中起重要作用。与不表达COX-2的结肠癌细胞系Coco-2比较,Tsujii et al[12]发现表达COX-2的Coco细胞存在MMP-2的激活和膜金属蛋白酶mRNA水平增加,侵袭性增强。为进一步研究COX-2与基质金属蛋白酶的关系,我们将COX-2和MMP-7联系起来分析。我们的研究结果显示COX-2阳性组的MMP-7阳性率高于COX-2阴性组(P<0.05),提示COX-2在MMP-7的产生中可能发挥着重要作用。Nosho et al[13]的研究结果也支持这一结论。总之,COX-2高表达可能促进了MMP-7表达并共同促进大肠癌的生长和转移;COX-2,MMP-7的联合检测对大肠癌的预后判断和指导临床治疗具有重要意义。
[1]Ochiumi T,Tanaka S,Oka S,et al.Clinical significance of angiopoietin-2 expression at the deepest invasive tumor site of advanced colorectal carcinoma[J].International Journal of oncology,2004,24(3):539~547.
[2]Yamauchi T,Watanabe M,Kubota T,et al.Cyclooxygenase-2 Expression as a New Marker for Patients with Colorectal Cancer[J].DisColonRectum,2002,45:98~103.
[3]Shao J,Sheng H,Inoue H,et al.Regulation of Constitutive Cyclooxygenase-2 Expression in Colon Carcinoma Cells[J].J Biol Chem,2000,275:33951~33956.
[4]Wu Aiwen, Gu Jin,Ji Jiafu,et al.Role of COX-2 in Carcinogenesis of Colorectal Cancer and Its Relationship with Tumor Biological Characteristics and Patients Prognosis[J].World J Gastroenterol,2003,9(9):1990~1994.
[5]Hong Z,Sun XF.Overexpression of cyclooxygenase-2 correlates with advanced stages of colorectal cancer[J].Am J Gastroenterology,2002,97(4):1037~1041.
[6]Sheehan KM, Sheahan K,O'Donoghue DP,et al.The relationship between cyclooxygenase-2 expression and colorectal cancer[J].Jama,1999,282(13):1254~1257.
[7]Yamauchi T,Watanabe M,Kubota T,et al.Cyclooxygenase-2 expression as a new marker for patients with colorectal cancer[J].Dis Colon Rectum,2002,45(1):98~103.
[8]Zhan J,Liu JP,Zhu ZH,et al.Relationship between COX-2 expression and clinicopathological features of colorectal cancers[J].Clin Med J(Engl),2004,117(8):1151~1154.
[9]陈志康,欧阳康庭.癌胚抗原和环氧化酶2的表达与结直肠癌的关系[J].癌症,2003,22(2):164~167.
[10]Adachi Y,Yamamoto H, Itoh F,et al.Contribution of matrilysin (MMP-7)to the metastatic pathway of human colorectal cancers[J].Gut,1999,45(2):252~258.
[11]Sheng H,Shao J,Morroco JD,et al.Prostaglandin E2 increases growth and motility of colorectal carcinoma cells[J].J Biol Chem,2001,276(21):18075~18081.
[12]Tsujii M,Kawano S,Dubios RN.Cyclooxygenase-2 expression in human colon cancer cells increases metastatic potentia[J].Proc Natl Acad Sci USA,1997,94(7):3336~3340.
[13]Nosho K,Yamamoto H,Taniguchi H,et al. Interplay of insulin-like growth factor-II, insulin-like growth factor-I, insulin-like growth factor-I receptor,COX-2,and matrix metalloproteinase-7,play key roles in the early stage of colorectal carcinogenesis[J].Clinical cancer research,2004,10(23):7950~7957.

图2 大肠癌组织中mmp-7阳性染色SP法×400Figure 2 Immunohistochemical staining for MMP-7 in colorectal carcinoma by streptacidin-peroxidase coiugated method×400
