碘对比剂剂量对犬血浆ET-1和CGRP的影响及意义
2010-06-19吴宗霞王志铭
钱 颖,吴宗霞,雷 振,王志铭
(辽宁医学院附属第一医院放射科,辽宁 锦州 121001)
近年来随着CT设备和诊疗技术的不断发展,越来越多的患者接受造影检查,碘对比剂的使用逐年增加,据统计2003年全世界碘对比剂用量约为800万升[1]。随着对比剂的广泛使用对比剂的毒副反应逐渐引起人们重视,目前,对比剂肾病(CIN)引起的肾毒性与剂量成正比,对比剂使用的剂量越大发生对比剂肾损害几率越高[2]。内皮素-1(ET-1)、降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)是一对具有拮抗作用的血管活性肽,分别是目前已知最强的缩血管和扩血管物质,它们在调节血管内皮功能和血流动力学方面起到重要作用,为此笔者探讨静脉注射不同剂量碘对比剂与家犬血浆中ET-1和CGRP的变化关系。
1 材料和方法
1.1 材料
1.1.1 实验动物及分组
健康家犬12只(辽宁医学院动物实验中心提供),雌雄不限,月龄15~20月,体重16~18kg,雌性未孕。将犬随机分为高(2.93ml/kg)、中(2.20ml/kg)、低(1.47ml/kg)剂量组和等剂量生理盐水对照4组。根据药理试验中动物间和动物与人体间的等效剂量换算得出相对应人的高、中、低剂量分别为2.0ml/kg,1.5ml/kg,1.0ml/kg。
1.1.2 实验设备及试剂
GC-911γ放射免疫计数器(科大创新股份有限公司中佳分公司),KDC-2044低速冷冻离心机 (科大创新股份有限公司中佳分公司),HH.W21.600S数显电热恒温水箱(上海跃进医疗器械厂),高压注射器(深圳安特高科实业有限公司)。
碘海醇(欧乃派克350mgI/ml,通用电气药业上海有限公司),ET-1试剂盒 (北京市福瑞生物工程公司),CGRP试剂盒(北京市福瑞生物工程公司)。
1.2 方法
1.2.1 实验动物处理
实验前禁食6h,采用速眠新0.1ml/kg犬后肢外侧肌肉注射麻醉,当犬出现呼吸浅慢,角膜反射迟钝,舌外伸时,将其置于仰卧位,双后肢使用8%Na2S溶液脱毛,消毒后犬后腿内侧埋置留置针。
1.2.2 标本取材
高、中、低剂量组和生理盐水组大隐静脉高压(1.2ml/s)注射碘对比剂后分别在 5min,15min,30min,45min,60min,90min,6个时间点抽静脉血2ml,注入含有30μl EDTA-2Na和 40μl抑肽酶试管中,混匀 4°C 离心(3000r/min)10min,取上清液-20°C冰箱冷冻保存待用。在注射对比剂2周后血清肌酐完全恢复正常,再次注射,重复6次(即每组每个时间点取得18次血液标本)。
1.3 ET-1和CGRP测定
采用非平衡方法进行测定。参照北京福瑞生物工程公司ET-1放射免疫分析药盒和CGRP放射免疫分析药盒说明书进行。
1.4 统计学处理
实验数据以x±s表示,用SPSS 16.0统计软件进行处理。放射免疫数据采用单因素重复测量方差分析,组间比较采用Student法,ET-1和CGRP采用直线相关分析。
2 结果
各组血浆ET-1、CGRP水平变化情况见表1。各组血浆中ET-1与CGRP相关分析见表2。各组ET-1与CGRP不同时间血浆含量变化见图1,2。
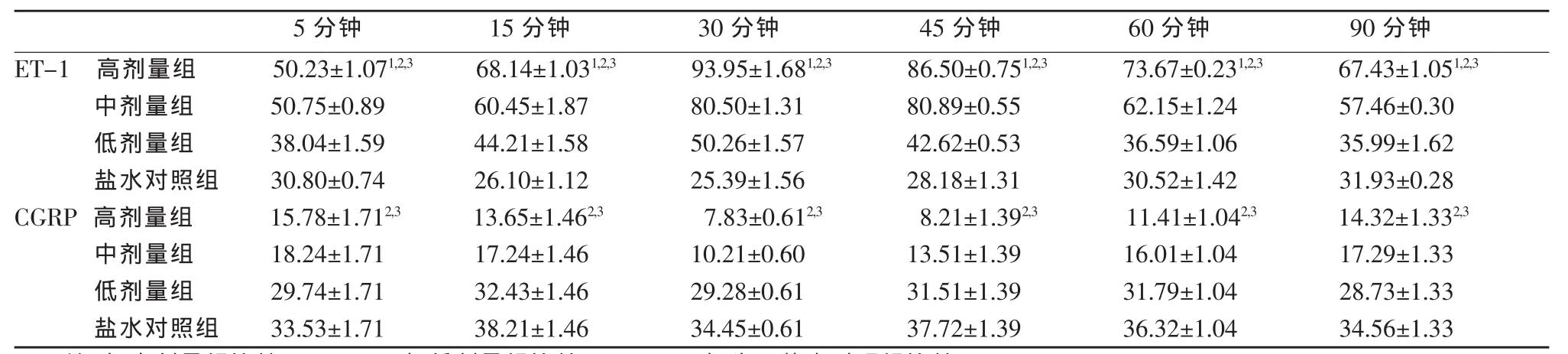
表1 各组碘海醇对血浆中ET-1和CGRP的影响(x±s,n=18)单位:pg/ml
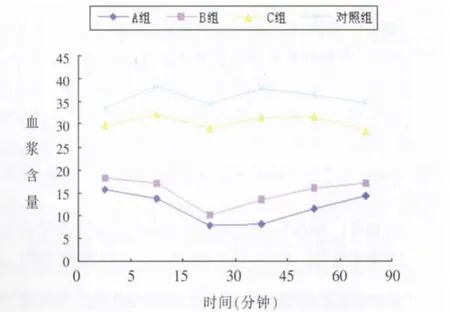
图2 CGRP线形图。Figure 2. Content of CGRP in blood plasma at different time in all groups.
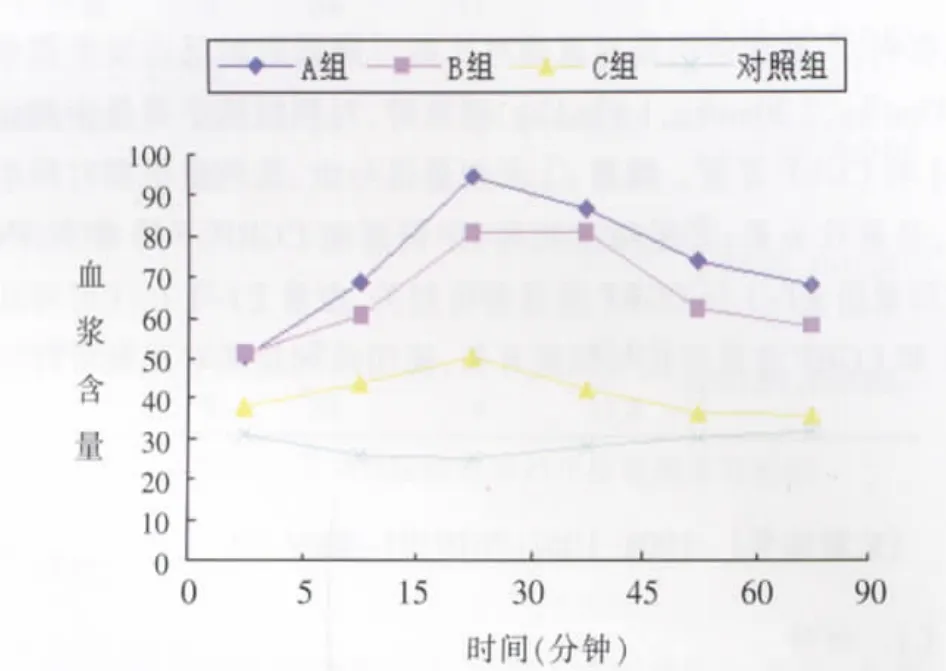
图1 ET-1线形图。Figure 1. Content of ET-1 in blood plasma at different time in all groups.
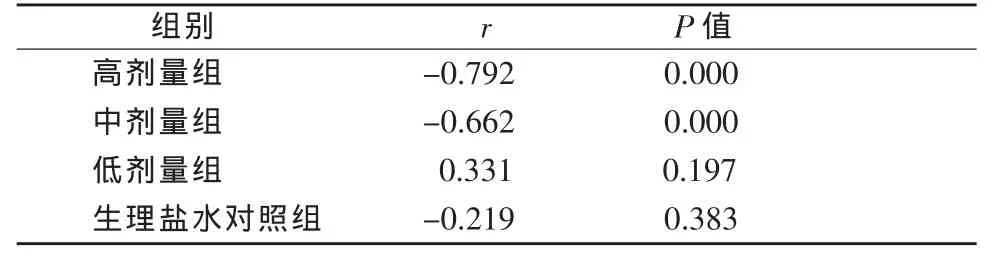
表2 各组血浆中ET-1 与CGRP 相关分析(x±s,n=18)
3 讨论
3.1 低剂量碘对比剂应用的临床意义
理想的碘对比剂应是完全无活性且对生物体无副作用,能够快速完全的排泄。然而,对比剂不是完全无活性的,自1996年以后,欧洲泌尿协会(ESUR)造影剂安全委员会(CMSC)发布了19个与放射照相有关的安全措施指导方针[3],目前临床上对比剂注射剂量多采用1.0~2.0ml/kg,近几年的研究显示CIN发生率在普通人群中为0.6%~2.3%;行经皮冠状动脉介入CIN发生率约为1.5%~13.0%;高危人群中可达40%~50%[4]。在已知的危险因素中最重要的有原有的肾功能不全、糖尿病和对比剂剂量的使用,另外还受年龄、心血管疾病和肾毒性药物应用等因素的影响。一项冠状动脉造影患者的研究发现对比剂剂量每增加100ml,对比剂肾毒性的危险增加12%[5]。
对比剂的毒副反应可分两类:一类是特异质反应,另一类是物理-化学反应。特异质反应如荨麻疹、血管性水肿、呼吸困难等是非剂量相关性的,而物理-化学反应则明确与剂量有关,主要是药物的渗透性、电荷性、黏稠性及化学性引起血液系统反应、内皮系统损害及内脏毒性反应等。当前非离子型对比剂已经广泛应用于组织器官CT增强扫描和血管造影,虽然非离子型对比剂较早期使用的离子型对比剂更安全,但是非离子型碘对比剂对血管内皮及内脏的毒性反应仍然不容忽视。碘对比剂可引起血流动力学改变[6],其中血管内皮活性物质的释放及其调节起着非常重要的角色。国外大量动物实验证实,内皮素是引发对比剂肾毒性反应的重要因素[7]。故在不影响临床诊断基础上使用低剂量对比剂降低血浆ET-1含量,减少对比剂毒性反应发生率将有重要意义。本实验研究发现:高、中、低剂量组和生理盐水对照组组间血浆ET-1含量在统计学上有显著性差异,高剂量组CGRP除与中剂量组间比较无统计学差异外与其余组间比较均有显著性差异。可见,非离子碘对比剂对血管内皮的影响是存在的,并呈量效关系。对CGRP的影响在高中剂量和低剂量组间也是不同的。
3.2 碘对比剂对血浆ET-1和CGRP的影响
现已证明,血管内皮细胞是一个十分活跃的代谢及内分泌库,通过合成与释放活性物质调节血管张力、血液流动性和黏附性。Aspelin等[8]报道所有的对比剂对内皮组织和血液细胞及其成分均有一定影响。Zhang等[9]研究发现,对比剂还可以影响内皮细胞存活率,并促进其凋亡。ET-1是最强的血管收缩剂是由内皮细胞、血管平滑肌细胞和炎症细胞产生的一种多肽[10],具有强烈持久的收缩血管作用。人的ET有3种基因表达,其中以ET-1活性最强,它通过与特异性受体结合而使血管收缩或痉挛。Oldroyd研究证明ET-1是碘对比剂刺激生成的最主要的血管收缩因子[11],本实验证实对比剂使用剂量越大犬血浆中ET-1含量越高,ET-1与碘对比剂的剂量呈量效关系,并且在注射对比剂30min时ET-1含量达高峰。碘对比剂引起的ET-1增高使血管持续收缩,引起组织缺血缺氧,氧化应激在对比剂的毒性反应机制中具有重要作用。赵景宏等[6]研究表明在体外离子型碘对比剂可短时间内使ET-1分泌增加,呈剂量依赖性,并可以引起细胞凋亡,本实验在体研究发现ET-1增高,与上述的结论一致。CGRP是Rosenfeld等在1983年应用分子生物技术发现的一种生物活性多肽。CGRP广泛分布于中枢及周围神经系统,对机体细胞具有保护作用,包括消化系统、呼吸系统、内分泌系统及中枢神经系统,但最主要还是作用于心血管系统,对外周血管特别是末梢小血管有明显舒张作用[12],它也是一种重要的内源性血管内皮保护物质,免疫电镜发现CGRP主要在内皮细胞的粗面内质网合成。血浆中ET-1增高时CGRP受到抑制含量降低,在正常生理情况下,ET-1与CGRP保持相对平衡,在对比剂注射后一段时间CGRP与ET-1这两种体液因素间的平衡紊乱可能参与对比剂毒副反应发生。
3.3 血浆中ET-1和CGRP的相关性
ET-1、CGRP是一对具有拮抗作用的血管活性肽,选择研究不同剂量非离子型单体碘对比剂对犬血浆ET-1和CGRP的影响,旨在探讨碘对比剂毒副损害的发生机制并为临床预防毒副反应的发生提供研究基础。本研究发现使用对比剂后犬血浆中ET-1与CGRP含量在高、中剂量组呈显著负相关(r=-0.792,r=-0.662),说明注射高剂量对比剂后引起血管内皮活性物质分泌失衡,ET-1、CGRP的拮抗作用失调。在碘对比剂作用下,ET-1释放增加,这时CGRP不仅不能保护性的释放以拮抗ET-1的作用,反而可能被缩血管因素所抑制,导致CGRP下降,内皮细胞受损;内皮细胞损伤又可能使ET-1大量释放,机体对其反应性增加,最终导致对比剂副反应的发生,造成组织器官功能的损害。这也说明ET-1/CGRP比例失调可能参与了对比剂副反应的病理生理过程。而低剂量组和对照组间两者无相关性,可能是使用较低剂量碘对比剂对血管内皮的影响是轻微的,ET-1/CGRP比例在机体调节能力范围内。有研究表明[13]CGRP可通过激活ERK1/2通路和增加Max表达发挥抑制细胞凋亡作用,CGRP浓度为10-8mol/L时细胞凋亡率明显下降[14],由此我们可以推测通过注射对比剂前给予内皮素拮抗剂CGRP可以在一定程度上减少副反应的发生。
综上所述,碘对比剂剂量可影响血浆ET-1及CGRP的表达,低剂量碘对比剂可降低对血浆ET-1及CGRP的影响,从而可能降低对比剂的不良反应,为低剂量碘对比剂临床应用提供实验依据。
[1]Katzberg RW,Haller C.Contrast-induced nephrotoxicity:clinical landscape[J].J Kidney Int Suppl,2006,100(4):S3-S7.
[2]MarenziG,LauriG,AssanelliE,etal.Contrast-induced nephropathy in patients undergoing primary angioplasty for acute myocardial infarction[J].J Am Coll Cardiol,2004,44(9):1780-1785.
[3]Henrik S,Thomsen HS.European Society of Urogenital Radiology guidelines on contrast media application[J].J Curr Opin Urol,2007,17(1):70-76.
[4]Toprak O,CiritM.Risk factors and therapy strategies for contrast-induced nephropathy[J].J Ren Fail,2006,28(5):365-381.
[5]Rihal CS,Textor SC,Grill DE,et al.Incidence and prognostic importanceofacuterenalfailureafterpercutaneouscoronary intervention[J].J Circulation,2002,105(19):2259-2264.
[6]赵景宏,黄岚,王军平,等.高渗和低渗造影剂对大鼠肾动脉内皮功能的影响及意义 [J].第三军医大学学报,2006,28(16):1713-1715.
[7]Oldroyd SD,Haylor JL,Morcos SK.Bosentan,an orally active endothelin antagonist:effect on renal response to contrast media[J].Radiology,1995,196(3):661-665.
[8]Aspelin P,Stacul F,Thomsen HS,et al.Effects of iodinated contrast media on blood and endothelium[J].J Eur Radiol,2006,16(5):1041-1049.
[9]Zhang H,Holt CM,Malik N,etal.Effectsofradiographic contrast media on proliferation and apoptosis of human vascular endothelial cells[J].Br J Radiol,2000,73(874):1034-1041.
[10]Kalani M.The importance of endothelin-1 for microvascular dysfunction in diabetes[J].J Vasc Health Risk Manage,2008,4(5):1061-1068.
[11]Oldroyd SD,Morcos SK.Endothelin:what does the radiologist need to know?[J].Br J Radiol,2000,73(876):1246-1251.
[12]Brain SD,Grant AD.Vascular actions of calcitonin generelated peptide and adrenomedullin[J].Physiol Rev,2004,84(3):903.
[13]Boucher MJ,Morisset J,Vachon PH,et al.MEK/ERK signaling path-way regulates the expression of Bcl-2,Bcl-X(L),and Mcl-1 and promotes survival of human pancreatic cancer cells[J].J Cell Biochem,2000,79(3):355-369.
[14]林平,赵守琪,刘洋,等.CGRP对葡萄糖诱导血管内皮细胞凋亡保护作用的研究 [J].哈尔滨医科大学学报,2005,39(2):118-120.
