经胃肠道给予氯化血红素对压力负荷性心衰大鼠氧化应激状态的影响
2010-06-19司晓云程友琴李小鹰韩丽娜谭国娟吴伦宽
司晓云,程友琴,李小鹰,韩丽娜,谭国娟,吴伦宽
高血压是引起心力衰竭的常见病因之一。近年研究揭示在心力衰竭的形成过程中,体内氧化/抗氧化失衡是一重要机制。体内血红素氧合酶-1/一氧化碳-胆红素(HO-1/CO-胆红素)系统是近年新发现的重要的内源性抗氧化体系[1,2]。笔者假设外源性给予HO-1的作用底物氯化血红素(hemin,Hm),通过诱导体内HO-1/CO-胆红素系统,有可能改变体内的氧化应激状态,减缓心力衰竭的发展进程,为临床心力衰竭的预防和治疗提供新的治疗靶点和手段。
1 材料与方法
1.1 药品试剂及主要仪器 Hm购于和田龙生物科技有限公司、大鼠HO-1试剂盒(武汉中美)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒购于南京建成生物有限公司,氧化低密度脂蛋白(ox-LDL)试剂盒购于尚柏生物医学技术(北京)有限公司。主要仪器有 RM6240C多道生理信号采集处理系统、尾动脉压测量仪(成都仪器厂)、ALOKA SSD-5500SV彩色超声诊断仪(日本Aloka公司)。
1.2 实验分组及心衰模型建立 健康雄性5周龄SD大鼠63只,体重(250±30)g〔北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2007-0001〕随机分为对照组、心衰组、氯化血红素组,每组各21只,心衰组和血红素组参照文献方法加以改进制备压力负荷性心衰模型[3]。3周后氯化血红素组开始以Hm 60 mg/(kg·d)灌胃,连续给药 12周;对照组、心衰组分别同时予以同等体积生理盐水灌胃。各组分别在给药后4、8、12周时取7只进行血液及血流动力学检测并处死。
1.3 超声心动图检测 大鼠用10%水合氯醛腹腔麻醉,仰卧固定于固定架上,左胸前部剃毛,使大鼠成左倾30度体位,采用日本ALOKA SSD-5500SV型超声诊断仪,S12探头,频率7.5MHz,由二维超声图像引导M形曲线进行测量,心动周期重复3次,取平均值,记录或计算舒张末室间隔(interventricular septum,IVS)厚度、舒张末左室后壁厚度(left ventricular posterior wall thickness,LVPWT)、左室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左室收缩末期内径(left ventricular end-systolic dimension,LVESD)、左室质量〔LVM=1.04×(LVED+LVPWT+IVS)3-LVEDD3〕、左室射血分数〔LVEF(%)=(LVEDD3-LVESD3)/LVEDD3×100%〕、左室短轴缩短率〔LVFS(%)=(LVEDD-LVESD)/LVEDD×100%〕。
1.4 血标本采集 经颈动脉插管取血9ml,迅速注入放在冰水浴中冷却的抗凝管中摇匀,在试管内静止5 min,经高速冷冻离心机分离血清,以3000 r/min,离心10min,分离上清,于-20℃保存,待测生化指标。
1.5 血液 HO-1及碳氧血红蛋白(carboxyhemoglobin,COHb)测定 HO-1测定采用双抗体夹心酶标免疫分析法,按武汉中美科技有限公司试剂盒说明书进行。采用双波长法测定血液COHb:新鲜血加入Na2S2O4,使样品中多组分的血红蛋白转化为Hb和COHb两个组分,在752型分光光度计上,用420 nm和432 nm两个波长测定吸光度,依比尔定律建立综合方程式,求出全血 COHb的含量百分比。
1.6 血清MDA、SOD ox-LDL测定 SOD活性测定采用黄嘌呤氧化酶法,MDA含量测定采用硫代巴比妥酸比色法,均严格按照南京建成生物工程研究所提供的试剂盒说明书进行,ox-LDL采用双抗体夹心酶标免疫分析法,按尚柏生物医学技术(北京)有限公司试剂盒说明书进行。
2 结 果
2.1 术后3周超声心动图参数 心衰组、氯化血红素组大鼠术后3周时(尚未给予氯化血红素)超声心动图证实心脏结构已有改变,但心脏功能尚未受到明显影响(表1)。
表1 术后3周超声心动图参数(±s,n=21)

表1 术后3周超声心动图参数(±s,n=21)
注:Hm:氯化血红素;IVS:舒张末室间隔厚度;LVPWT:舒张末左室后壁厚度;LVM:左室质量;LVEF:左室射血分数;LVFS:左室短轴缩短率。与对照组比较,*P<0.01
组别 IVS(mm)LVPWT(mm)LVM(mg)LVEF(%)LVFS(%)对照组 1.44±0.11 1.41±0.15 487±137 77±11 41±11心衰组 1.96±0.14*1.89±0.19*836±135*74±10 38±9 Hm 组 1.96±0.18*1.9±0.31*769±126*74±11 38±8
2.2 血清中 HO-1含量及COHb比值 心衰组HO-1含量与对照组相比在8周、12周时明显增高,分别为(4.50±0.29)μ g/L vs(1.60±0.64)μ g/L;(6.07±0.71)μ g/L vs(1.92±0.56)μ g/L(均P <0.01)。氯化血红素组与心衰组相比HO-1含量4、8、12周时均明显升高,分别为(6.80±0.92)μ g/L vs(2.50±0.22)μ g/L;(10.70±0.69)μ g/L vs(4.50±0.28)μ g/L;(13.30±0.99)μ g/l vs(6.07±0.71)μ g/L(均 P <0.01;图 1)。

图1 各组大鼠不同时期血清中HO-1含量
心衰组与对照组相比COHb比值在8、12周时明显升高,分别为(2.46±0.20)%vs(1.57±0.12)%;(3.01±0.42)%vs(1.40±0.18)%(P <0.01)。氯化血红素组与心衰组相比4、8、12周时COHb比值明显升高,分别为(4.34±0.31)%vs(1.68±0.11)%;(6.32±0.44)%vs 2.46±0.2)%;(7.80±0.39)%vs(3.01±0.42)%(P<0.01;图2)。

图2 各组大鼠不同时期血清中COHb含量
2.3 血清中MDA含量 心衰组MDA含量与对照组相比在 4、8、12周时分别升高133%、224%、122%(均P<0.01)。氯化血红素组MDA含量与心衰组相比在4、8、12周时分别降低41%(P<0.05)、52%(P<0.01)、55%(P <0.01;表2)。
表2 各组大鼠不同时期血清中MDA含量(μ mol/L,n=7,±s)

表2 各组大鼠不同时期血清中MDA含量(μ mol/L,n=7,±s)
注:与对照组比较,*P<0.01;与心衰组比较,△P<0.05,#P<0.01
组别 4周 8周 12周对照组 6.1±0.7 6.2±0.8 6.5±1.2心衰组 14.2±2.3* 20.2±3.2* 26.1±3.7*Hm 组 8.3±1.3△ 9.6±0.5# 11.8±1.1#▲
2.4 血清中SOD活性 心衰组SOD活性与对照组相比 4、8、12 周时分别降低40%、56%、75%(均P<0.01)。氯化血红素组SOD活性与心衰组相比4、8、12 周时分别升高 31%、62%、81%(均 P <0.01;表 3)。
表3 各组大鼠不同时期血清中SOD活性(kU/L,n=7±s)
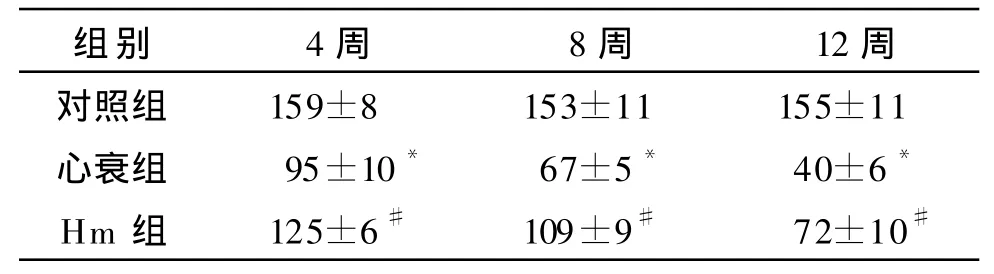
表3 各组大鼠不同时期血清中SOD活性(kU/L,n=7±s)
注:SOD:超氧化物歧化酶,其他缩写见表1注。与对照组比较,*P<0.01;与心衰组比较,#P<0.01
组别 4周 8周 12周对照组 159±8 153±11 155±11心衰组 95±10* 67±5* 40±6*Hm 组 125±6# 109±9# 72±10#
2.5 各组大鼠血清中ox-LDL含量 心衰组ox-LDL含量与对照组相比 4、8、12周时分别升高112%、207%、382%(均 P<0.01)。氯化血红素组ox-LDL含量与心衰组相比4、8、12周时分别降低37%、40%、42%(均 P <0.01;表 4)。
表4 各组大鼠不同时期血清中ox-LDL含量(μ mol/L,n=7,±s)

表4 各组大鼠不同时期血清中ox-LDL含量(μ mol/L,n=7,±s)
注:与对照组比较,*P<0.01;与心衰组比较,#P<0.01
组别 4周 8周 12周对照组 0.85±0.16 0.76±0.16 0.65±0.14心衰组 1.80±0.22* 2.34±0.25* 3.17±0.31*Hm组 1.14±0.16# 1.38±0.14# 1.83±0.16#
3 讨 论
经胃肠道给予Hm能对体内HO/CO-胆红素系统起到诱导作用。本实验观察到在压力负荷性心力衰竭的形成过程中体内HO/CO-胆红素系统活性较正常情况下增强,经胃肠道给予血红素后,血液中HO-1、COHb含量在 4周、8周、12周时均明显增高,说明胃肠道可以成为对HO/CO-胆红素系统进行外源性干预的有效途径。Hm作为HO的底物和诱导剂,在许多离体和在体的动物实验中已广泛应用,但以往的在体实验均经腹腔注射,本实验选用的Hm是从牛血中提取的,在胃肠道吸收率高,目前临床上用于防治缺铁性贫血,被认为是效果好的生物铁源,无铁腥味,不刺激胃,本实验采用灌胃方法,未观察到不良反应,并对体内的HO/CO-胆红素系统起到了持续有效的诱导作用,这种诱导作用至少可以持续12周,为临床上长期应用Hm诱导HO-1/CO-胆红素系统的临床需要提供了实验依据。
大量研究资料表明,心衰发生发展过程中机体内产生严重的氧化应激[4,5]。MDA是脂质过氧化的一种终末物,可以反映机体自由基水平。SOD是体内酶类自由基清除剂,其血清活性高低可以反映机体自由基清除能力。ox-LDL是 LDL中不饱和脂肪酸双键在氧自由基作用下形成的过氧化物,也可以反映体内的氧化应激状态。HO/CO-胆红素系统代谢过程中,胆红素、胆绿素、铁离子均是体内重要的抗氧化物质,其中尤以胆红素抗氧化能力最强,其抗氧化能力甚至比谷胱甘肽强一万倍,作为保护细胞免遭氧化胁迫的一条极佳途径,胆红素可能是进化的重要产物[1]。胆红素分子具有特殊卷曲结构和不对称性,在血浆中与白蛋白结合后,促使胆红素C-10上的氢转化为活性氢原子,极易与超氧阴离子等自由基反应,从而具有清除自由基的功能,体外实验证实胆红素能阻止LDL被2,2,-偶氮(2-丙基脒)的双盐酸盐在37℃产生的氧自由基氧化修饰,从而抑制ox-LDL的形成;在体内也证实胆红素由于含有延伸的共轭双键系统和活性氢原子,从而能够阻止氧化作用,抵抗LDL被氧化,从而抑制ox-LDL的形成。此外有研究结果提示,ox-LDL的氧化修饰并不完全取决于LDL胆固醇的含量,而是主要取决于内源性抗氧化剂胆红素的含量[6]。本实验中心衰组血浆MDA含量随术后时间的延长不断增高,SOD活性则不断下降,证实了在心衰形成过程中,机体氧化与抗氧化处于失衡状态,自由基清除不足,体内产生了持续的氧化应激,这与Nain等[6]的研究结果一致。与此同时,ox-LDL含量进行性上升,可在一定程度上反映机体内氧化应激状态。给予Hm后,血清SOD不同程度升高,MDA、ox-LDL不同程度地降低,提示HO/CO-胆红素系统诱导成功,对机体起到了抗氧化的保护作用,在一定程度上改变了体内的氧化应激状态。T urkseven等[7]在实验性糖尿病大鼠探讨HO-1的抗氧化机制中发现,HO-1被诱导后内皮细胞SOD水平增加,认为HO-1抗氧化应激的血管内皮细胞保护作用需要内皮细胞SOD的参加。但SOD增高的机制尚需进一步探讨。
本实验证实,经胃肠道给予Hm可以对体内的HO-1产生诱导作用;Hm-HO-1/CO-胆红素系统的诱导可改善压力负荷心衰大鼠的体内氧化/抗氧化失衡状态。
[1]Baranano DE,Mahil R,Ferris CD,et al.Biliverdin reductase:a majorphysiologic cytoprotectant[J].Proc NatlAcad SciUSA, 2002,99(25):16093-16098.
[2]Tomaro M L,Batlle AM.Bilirubin:its role in cytoprotection against oxidative stress[J].Int J Biochem Cell Biol,2002,34(3):216-220.
[3]倪 量,王硕仁.腹主动脉部分缩窄大鼠模型体外心脏的电生理特点[J].中国组织工程研究与临床康复,2007,11(8):1469-1476.
[4]Nojiri H,Shimizu T,Funakoshi M,et al.Oxidative stress causes heart failure with impaired mitochondrial respiration[J].JBiol Chem,2006,281(44):33789-33801.
[5]Tsutsui H,Ide T,Kinugawa S,et al.Mitochondrial oxidative stress,DNA damage,and heart failure[J].Antioxid Redox Signal,2006,8(9-10):1737-1744.
[6]Nain S,Ling B,Bandy B,et al.The role of oxidative stress in the development of congestive heart failure in a chicken genotype selected for rapid growth[J].Avian Pathol,2008,37(4):367-373.
[7]Turkseven S,Kruger A,Mingone CJ,et al.Antioxidant mechanism of heme oxygenase-1 involves an increase in superoxide dismutase and catalase in experimental diabetes[J].Am J Physiol Heart Circ Physiol,2005,289(2):H701-H707.
