银屑病皮损中PKB、NF-κBp65、Bcl-xL的表达及相关性研究
2010-06-09黄振明张三泉刘玉梅朱慧兰文海泉
杨 艳 黄振明 张三泉 刘玉梅 朱慧兰 文海泉
1 广东省广州市皮肤病防治所(510095)
2 湖南省长沙市中南大学湘雅二院皮肤科(410011)
银屑病(psoriasis)是一种病因复杂的慢性炎症性皮肤病,发病机制未明,主要与感染、遗传、免疫功能紊乱等因素有关。其重要病理特征是角质形成细胞(kiratinocyte,KC)增生,角化过度伴角化不全,真皮有T淋巴细胞浸润。近来研究表明,细胞凋亡尤其KC的凋亡异常在银屑病发病机制中起到了重要作用。为了对其做进一步的了解,我们采用免疫组织化学法研究PKB、NF-κBp65、Bcl-xL在银屑病表皮中的表达,现将结果报道如下。
1 材料与方法
1.1 标本来源
30例银屑病标本来源于广州市皮肤病防治所2004至2005年门诊和住院患者,已经组织病理确诊,取材前1个月未系统或外用过糖皮质激素。其中男20 例,女10例,男女比例2∶1。年龄12~76岁,平均(39.40±14.71)岁。病程1个月~23年,平均(6.23±5.65)年。10例正常对照,为无器质性疾患、因外伤等原因手术的患者正常皮肤,男6例,女4例,男女比例3∶2。年龄18~48岁,平均(31.90±9.48)岁。经统计学处理,与银屑病患者组差异无显著性。对符合上述入选标准者详细记录病史资料,进行PASI评分,银屑病患者组PASI评分1.58~26.59,平均(14.15±7.94)。取躯干或四肢典型皮损,经3.33mol/L(10%)福尔马林固定24h,常规石蜡包埋,连续切片4μm厚。
1.2 试剂
浓缩型兔抗人PKB1(工作滴度1∶100)、Bcl-xL多克隆抗体(工作滴度1∶120)购自武汉博士德生物工程公司。浓缩型鼠抗人NF-κBp65单克隆抗体(工作滴度1∶150)、SP-9000免疫组织化学染色试剂盒、浓缩型DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 方法
采用免疫组织化学SP法检测银屑病组皮损及正常对照组皮肤中PKB、NF-κBp65、Bcl-xL的表达,阳性对照为相关试剂公司提供的PKB、NF-κBp65、Bcl-xL的阳性照片,阴性对照为不加一抗。
1.4 结果判断
采用银屑病皮损面积和严重程度评分法(Psoriasis Area and Severity Index,PASI)对银屑病患者予以病情严重程度评分。免疫组织化学结果阳性信号为棕褐色或棕黄色、淡黄色颗粒,定位于细胞质及细胞膜。将排除了切片或涂片本底因素后的纯免疫组织化学显色反应程度按灰度图像分析为0(白)至255(黑)个等级,每个等级定义为1个阳性单位(positive unit,PU)。阳性单位测定:用于反映免疫组织化学的显色强度,从而定量表达免疫组织化学的阳性和阴性反应结果。每例标本随机取5个200倍视野,以平均值作为该标本PU值进行比较。患者和对照组间PKB、NF-κBp65、Bcl-xL表达的比较采用t检验。各组间线性相关性分析采用Pearson's积差法,并进行偏相关分析以了解三者与PASI评分的内在线性联系,P<0.05表示差异有统计学意义。
1.5 统计学分析
本组资料均采用SPSS13.0统计软件进行统计学分析。
2 结 果
2.1 PKB、NF-κBp65、Bcl-xL在正常人及银屑病患者皮损中的表达
在正常皮肤组织角质形成细胞中PKB、NF-κBp65、Bcl-xL均呈现弱阳性或阴性表达,平均PU值分别为(1.28±0.70)、(1.66±0.70)、(1.64±0.76)。银屑病患者皮损组织角质形成细胞中表皮全层出现不同程度的PKB、NF-κBp65、Bcl-xL表达,均呈棕黄色或棕褐色颗粒状:其中PKB定位于细胞核核膜或近核膜胞质,平均PU值为(8.40±3.07);NF-κBp65在静止细胞中定位于胞质,活化时向胞核移位,平均PU值为(7.45±3.03);Bcl-xL定位于近核膜胞质,平均PU值为(9.27±3.72)。三者在银屑病患者组的表达均明显高于正常对照组,差异有统计学意义(P<0.05),见表1。
表1 PKB、NF-κBp65、Bcl-xL在正常人皮肤及银屑病皮损中的表达(阳性单位,±s)
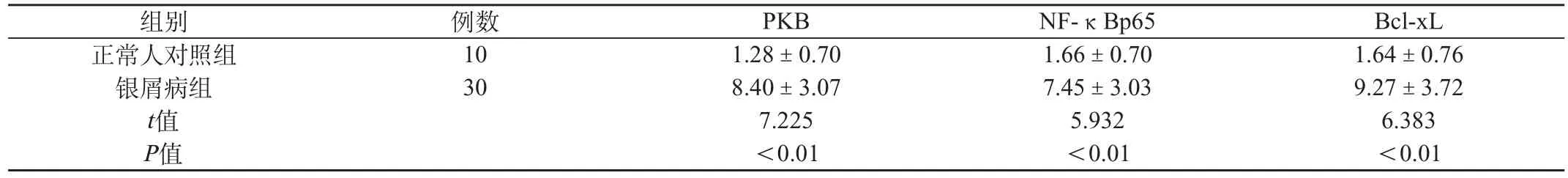
表1 PKB、NF-κBp65、Bcl-xL在正常人皮肤及银屑病皮损中的表达(阳性单位,±s)
组别 例数 PKB NF-κBp65 Bcl-xL正常人对照组 10 1.28±0.70 1.66±0.70 1.64±0.76银屑病组 30 8.40±3.07 7.45±3.03 9.27±3.72 t值 7.225 5.932 6.383 P值 <0.01 <0.01 <0.01
2.2 银屑病患者皮损PKB、NF-κBp65、Bcl-xL表达水平和PSAI相关性比较
三者表达水平与患者PSAI评分间均存在正相关,r值分别为0.890、0.866、0.988,P均<0.01,有统计学意义。
2.3 银屑病患者皮损PKB、NF-κBp65、Bcl-xL表达水平相关性比较
银屑病患者皮损PKB和NF-κBp65表达水平间r=0.908,NF-κBp65和Bcl-xL间r=0.921,PKB和Bcl-xL间r=0.915,P均<0.01。
3 讨 论
PKB是1991年发现的相对分子量约为60×103的具有丝/苏氨酸蛋白激酶活性的蛋白质,在PI3K等介导的信号转导途径中起着关键作用[1]。在多种细胞中,PKB充当抗凋亡信号激酶的作用。PKB广泛产生于各组织。既往研究发现,致癌基因可能通过磷酸化的PKB来阻断生理性的细胞凋亡,使细胞失去正常的增殖与分化能力从而导致癌变。有研究提示,在子宫内膜细胞中存在有PKB参与的信号转导途径来调控细胞的生存与死亡[2]。也有研究提示,PI3K/ PKB抗凋亡信号途径在调节心肌细胞生长、心肌肥大和心力衰竭[3],而在银屑病的发病机制中尚无类似报道。我们的研究发现,正常人角质形成细胞中有PKB的弱阳性表达,而在银屑病皮损中的角质形成细胞中PKB的表达明显增强,以表皮中、下层表达更为显著,差异有统计学意义,而且随着PASI增高,其表达进一步加强。这表明PKB的过度表达可能与银屑病的皮损形成存在某种相关性。
NF-κB是一种具有多向性调节作用的转录因子。经典的NF-κB是p50/p65亚单位组成的异二聚体。正常情况下,NF-κB结合抑制蛋白IκB以灭活形式存在于胞质中。IκB激酶IKK复合物可磷酸化IκB使其经蛋白酶体通路降解进而引起NF-κB激活并转位入核,结合于抗凋亡基因的启动子区激活基因转录。NF-κB与细胞凋亡有密切关系。大量研究表明,NF-κB激活能够阻断细胞凋亡通路,为保护细胞免于遭受TNF和其它凋亡刺激因子诱导的凋亡级联合反应所必需[4,5]。我们的研究结果表明,正常皮肤角质形成细胞中NF-κB呈阴性或弱阳性表达,与正常皮肤相比,银屑病皮损角质形成细胞中的NF-κBp65表达明显上调,差异有统计学意义,且随着PASI分值增高,表达强度有增加趋势。表明NF-κB作为核转录调节因子,有可能通过调控各种抗凋亡基因的表达,而参与银屑病的发病机制。
细胞凋亡抑制基因Bcl-xL是近年来发现的Bcl-2基因家族的新成员,作用与Bcl-2相似。目前对Bcl-2基因家族调节细胞增生和凋亡的机制已有所了解,尤其是与肿瘤的关系日益受到重视,并发现其很可能是促成某些良性增生性疾病如银屑病等的重要因素。有人认为BclxL可能与维持角质形成细胞存活,直至终末分化并到达体表才凋亡有关。Nakagawa、 Krajewski、Takahashi等相继发现银屑病皮损中的角质形成细胞有很高的Bcl-xL表达[6]。这与我们的研究结果相一致。表明Bcl-xL可能作为一种抗细胞凋亡基因参与银屑病的发病机制。
我们的研究证实PKB、NF-κBp65、Bcl-xL在银屑病皮损中表达均增高。从理论上讲,PKB直接磷酸化IKKα,使IKK激活,从而调节NF-κB 活性;Meng等[7]发现在NIH3T3细胞和内皮细胞中,NF-κB亚基p65的表达可通过增加PI3K PDK1的活性促进PKB活化,并在转录水平上增加PKB的表达。Mori等[8]运用瞬时转染分析发现,TaX(一种病毒蛋白,能抑制凋亡)能激活人类Bcl-xL启动子活性从而诱导转活,而敲除人类Bcl-xL启动子序列的NF-κB结合位点则能显著减少TaX诱导的转活。这也证实了NF-κB与Bcl-xL在发挥抗凋亡作用方面存在某种相关性。活化的PKB直接磷酸化BAD S136残基后,14-3-3 蛋白阻止BAD 与Bcl-2或Bcl-xL在线粒体结合,同时也阻止Bad和Bcl-2,Bcl-xL在线粒体膜上相互作用[9],从而使游离的Bcl-xL的表达增加。三者的表达有一定的联系,在本研究中初步证实了这一点。我们发现,PKB与NF-κBp65、PKB与Bcl-xL、Bcl-xL与NF-κBp65的表达均存在相关性,有统计学意义。说明了PKB可能作为抗凋亡信号激酶,激活NF-κB,并引发其后的一系列抗凋亡效应,银屑病的发生可能与三者的共同参与有关。这为进一步明确银屑病的发病机制,寻找新的防治靶点提供了新的思路和途径。
[1]Jones PF,Jakubowicz T,Pitossi FJ,et al.Molecular cloning and identification of a serine/ threonine protein kinase of the secondmessenger subfamily[J].Proc Natl Acad Sci USA,1991,88(10):4171- 4175.
[2]Munir I,Fukunaga K,Kanasaki H,et al.Expression of cyclooxygenase 2 by prostaglandin E (2) in human endometrial adenocarcinoma cell line HEC21B[J].Biol Reprod,2000,63(3):933-941.
[3]Prasad SVN,Perrino C,Rockman HA.Role of phosphoinositide 3 - kinase in cardiac function and heart failure[J].Trends Cardiovasc Med,2003,13(5): 206-212.
[4]Sovak M,Bellas RE,Kim DW,et al.Aberrant NF kappaB/Rel expression and pathogenesis of breast cancer[J].J Clin Invest,1997,100(12):2952-2960.
[5]Mayo MW,Wang CY,Cogswell PC,et al.Requirement of NF kappaB activition to suppress p53- independent apoptosis induced by oncogenic[J]Ras Sci,1997,278(5344):1812-1815.
[6]Takahashi H,Manabe A,Ishida-Yamamoto A,et al.Aberrant expression of apoptosis-related molecules in psoriatic epidermis[J].J Dermatol Sci,2002,28(3):187-197.
[7]Meng FD,Mello SR.NF - kappaB stimulates Akt phosphorylation andgene expression by distinct signaling mechanisms[J].Biochim Biophys Acta,2003,1630(1):35-40.
[8]Mori N,Fujii M,Cheng G,et al.Human T-cell leukemia virus type I tax protein induces the expression of anti-apoptotic gene BclxL in human T-cells through nuclear factor-kappaB and c-AMP responsive element binding protein pathways[J].Virus Genes,2001,22(3):279-287.
[9]Del Peso L,Gonzalez Garcia M,Page C,et al.Interleukin 3 induced phosphorylation of BAD through the protein kinaseAkt[J].Science,1997,278(5338): 687-689.
