Aβ1-42合并IBO诱导阿尔茨海默病大鼠模型的建立和评价1)
2010-06-08陈欢雪
陈 民,王 晶,陈欢雪
阿尔茨海默病(Alzheimer's disease,AD)是一种以进行性记忆障碍和智能衰退为主要临床特征的中枢神经系统退行性疾病,得名于1907年德国神经病学专家Alois Alzheimer的报道。由于AD的衰老性、多病因性,很难用一种干扰因素造出AD的动物模型,许多研究表明[1-3]多因素造模方法具有对动物产生协同损伤的作用。本实验采用复合AD模型方法[4]加以改良,即将Aβ1-42和IBO混合液共同注入大鼠海马,破坏与学习记忆有关的胆碱能系统,同时通过凝聚态Aβ1-42使神经元发生退行性变,以期更好地模拟AD行为学和病理学表现。
1 材料与方法
1.1 动物 选择SD雄性大鼠75只,鼠龄 18周~22周,体重(280±20)g,由辽宁中医药大学实验动物室提供。大鼠随机分笼饲养,自由摄食与饮水,室温 20℃~22℃,相对湿度 50%~70%,维持每日光照12 h。
1.2 主要试剂和设备 Aβ1-42(北京博奥森生物技术有限公司),IBO(Sigma公司,美国),水合氯醛(天津市大茂化学试剂),MT-200M orris水迷宫视频跟踪分析系统(成都泰盟科技有限公司),江湾Ⅰ型C脑立体定位仪(上海江湾医疗器械厂),307-6型牙科钻(上海医用分析仪器厂),微量注射器 1 μ L(宁波市镇海三爱机器厂)。
1.3 实验方法
1.3.1 动物分组 大鼠经M orris水迷宫实验判定其空间辨别性学习记忆能力,淘汰反应过于迟钝或特别敏感的大鼠,将选出来的大鼠随机分为正常对照组、假手术组、模型组,每组15只。
1.3.2 AD模型构建 凝聚态 Aβ1-42的制备:将 Aβ1-42肽段 1 mg溶于 100 μ L 无菌生理盐水配制成 10 μ g/μ L,封口膜封好后,37℃孵育1周使其聚集、老化成为凝聚态。取IBO 1 mg溶于其中,配制成 Aβ1-42和IBO混合液,现用现配。
模型组:大鼠经10%水合氯醛(0.3 mL/kg)腹腔注射麻醉后,固定于脑立体定位仪上,备头部皮肤,常规消毒手术区皮肤。无菌下操作,沿颅顶中线做2.0 cm纵向切口,止血,钝性分离骨膜,暴露至颅骨,根据大鼠颅脑立体定位图谱[5],对单侧海马区立体定位(位置:前囟后3.5 mm,中线左侧旁开3 mm,深度5.5 mm),用牙科钻钻开颅骨一小孔(直径1 mm),垂直插入微量注射器,使针尖自颅骨表面进针5.5 mm至海马区。5 min内缓慢注入 Aβ1-42和IBO混合液1 μ L,留针 10 min。注射完毕缓慢拔针,于创面处施加消炎粉后缝合皮肤。假手术组:在相同定位下给予大鼠同侧海马区一次性注射1 μL无菌生理盐水。待大鼠清醒后放回笼中常规饲养。术后给予青霉素钠盐5×104U肌注,每日1次,连续3 d,首次倍量。正常组:不做任何处理。
1.3.3 行为学检测 Morris水迷宫实验[6]改良。术后2周后对每组实验大鼠分别进行水迷宫学习记忆行为学检测,每日1次,连续测试7 d(6 d定位航行,1 d空间探索),通过检测平均逃避潜伏期,评价其学习记忆成绩。水迷宫为一不锈钢圆形水池,直径150 cm,高60 cm,内置一与池壁同色的平台,平台高40 cm,底面为 6 cm×10 cm。在水池壁按东南、西南、西北、东北四个象限分别标明入水点。将平台放在东北象限正中距池壁22 cm处,迷宫中含牛奶液面高于安全平台1 cm,水温(22±1)℃,加适量奶粉使水呈乳白色,训练期间环境安静,迷宫外参照物不变,光线不变。实验:Morris水迷宫实验前6 d为定位航行试验,每只大鼠颈部套红色绸布。按东南、西南、西北、东北四个象限依次将大鼠面向池壁放入水中,使其自由游泳,自动摄像系统记录大鼠寻找平台的时间(即逃避潜伏期),设定120 s为最长逃避潜伏期,120 s后自动停止记录,此项检测动物的学习能力。空间探索实验:实验第7天为空间探索试验,定位航行试验结束后撤掉平台,将动物分别从东南入水点开始面向池壁将大鼠放入水池,记录120s内大鼠为搜索平台而穿过原平台放置区域的时间与总游泳时间的比例,以及穿过平台区的次数,此项检测动物的记忆能力。数据采集和处理由M orris水迷宫图像自动监视处理系统完成。
1.4 统计学处理 采用SPSS 13.0软件进行分析,计量资料用均数±标准差(±s)表示,采用单因素方差分析进行多组间均数比较。P<0.05为差异有统计学意义。
2 结 果
2.1 定位航行试验(见表1)各组大鼠均随着训练次数增加,潜伏期越来越短,表明各组大鼠在历次学习训练中均已逐渐学会寻找平台,但学习记忆能力明显不同。正常组和假手术组大鼠在3 d内就学会寻找平台,在前3 d潜伏期迅速下降,从第3天起渐趋平稳,约在30 s内能找到平台;而模型组虽有下降趋势,但较正常组和假手术组明显延长,约需95 s才能找到平台,差异有统计学意义(P<0.01),说明造模成功。
表1 3组水迷宫实验平均逃避潜伏期比较(±s)s

表1 3组水迷宫实验平均逃避潜伏期比较(±s)s
组别 n 第1天 第2天 第3天 第4天 第5天 第6天正常组 15 40.9±2.4 39.3±1.7 35.5±1.4 35.7±2.6 30.9±2.7 26.6±1.6假手术组 14 41.4±2.5 41.0±3.0 39.0±1.01) 36.8±2.7 32.7±1.3 30.9±3.51)模型组 12 65.3±2.82) 73.2±5.42) 75.9±3.42) 77.0±1.52) 93.3±2.72) 97.3±4.02)与正常组比较,1)P<0.05,2)P<0.01
2.2 空间探索试验(见表2)各组大鼠在撤除平台后2 min的空间探索试验结果:大鼠在原平台象限游泳的时间越长和跨越平台象限的次数增多,时间比和次数越大,反映大鼠对原平台象限的记忆越好。模型组与正常组和假手术组相比,时间比和次数均显著减小(P<0.01),说明模型组对原平台象限的选择性较低,即造模成功。
表2 各组大鼠空间探索试验结果(±s)
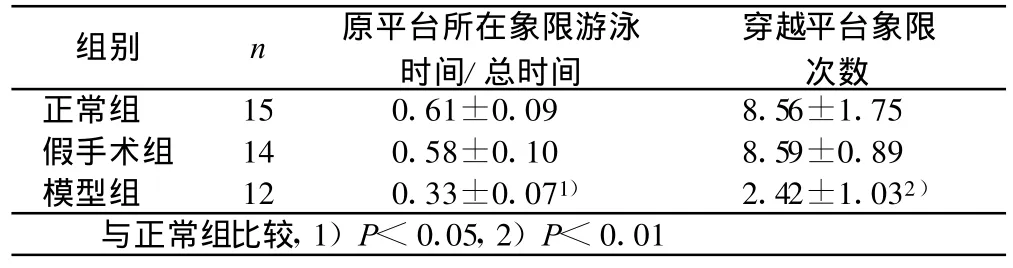
表2 各组大鼠空间探索试验结果(±s)
组别 n 原平台所在象限游泳时间/总时间穿越平台象限次数正常组 15 0.61±0.09 8.56±1.75假手术组 14 0.58±0.10 8.59±0.89模型组 12 0.33±0.071) 2.42±1.032)与正常组比较,1)P<0.05,2)P<0.01
3 讨 论
AD动物模型大致可分为自然衰老模型、转基因动物模型和损害模型三大类。每一种模型都部分模拟了AD的症状和病理改变。老龄动物的学习记忆存在明显减退的特点,但AD是在衰老的基础上发生的病理性神经功能退行性病变,它不同于正常的生理性衰老;大部分的转基因动物模型都能复制出AD患者的部分神经病理特征但因其制作过程复杂,传代缺乏稳定性,价格昂贵,难以批量生产等原因,短期内仍难以推广使用[7,8];Aβ注射模型在病理方面表现出神经纤维缠结(NFT)和神经元缺失,但由于体内存在Aβ自身清除机制而不能得到满意的效果。IBO损毁Meynert基底核建立的AD模型大鼠能导致动物学习记忆障碍但这种损害是可逆的,并不出现AD患者的典型的组织病理学改变,如 NFT、老年斑(SP)等,具有一定局限性。
Aβ是AD主要病征SP的主要组成成分。Aβ持续损伤大脑神经细胞导致患者进行性智力衰退,进而产生老年斑是AD神经病理过程形成和发展的关键[9]。海马是内侧颞叶系统中与学习记忆最密切相关的结构,因此内侧颞叶记忆系统又称“海马记忆系统”。M RI的资料显示,AD主要表现为大脑皮质弥漫性萎缩,尤其是两侧海马的萎缩表现较为突出[10]。故从结构和功能上分析,海马是AD研究较理想的靶区。
而本实验将Aβ1-42和IBO混合液共同注入大鼠海马,破坏与学习记忆有关的胆碱能系统,同时通过凝聚态Aβ1-42使神经元发生退行性变,表现出明显的学习、记忆获得、巩固和再现障碍,且未出现死亡率的升高,相比单因素模型,更接近模拟AD的临床表现和基本病理特征,是一种可靠的动物模型。
另外,AD患者的临床表现为智力减退,近期记忆缺失,因此对学习记忆进行评价是观察老年性痴呆模型及药物治疗效果的重要指标之一[11]。Morris水迷宫一种让实验动物学习寻找不透明水中的隐藏平台的操作过程,是国内外被广泛采用检测大鼠空间学习记忆的常用装置,它是英国心理学家 Richard CM.Morris于1981年首次设计使用的。已经成为一种研究空间学习和记忆的标准模式,广泛应用于研究海马和外海马损伤的效果和药物的应用[12]。
本实验水迷宫在此基础上对过程及细节加以改良:自动寻找设定时间为 120 s比以往60 s更有意义;水温(22±1)℃,与当时室温相近,过高温度大鼠不爱游动,过低温度大鼠四处游窜;灯管、声音等会对大鼠游动记忆产生干扰,需要一个稳定的安静环境。而且结果表明,随着训练次数的增加,各组大鼠的逃避潜伏期均在逐渐缩短,但模型组动物逃避潜伏期在第2天~第6天明显长于正常组和假手术组,并且在空间探索试验中,模型组大鼠的穿越原平台次数明显少于正常组和假手术组,说明模型组大鼠在水迷宫中学习寻找平台的能力、对平台在水迷宫的空间位置记忆能力均显著下降,表明模型大鼠存在学习记忆障碍,从行为学上评价,该模型是相当成功的。
[1]秦海强,李亚,田苏平,等.β淀粉样蛋白和D-半乳糖对大鼠学习记忆和胆碱酶活性的影响[J].南京医科大学学报,2000,5(20):195-197.
[2]李亚.β淀粉样蛋白对衰老模型大鼠学习记忆及大脑皮层内脂褐素含量的影响[J].中国药理学和毒理学杂志,2001,15(4):311-313.
[3]李亚,王建军,陈启盛.β淀粉样蛋白对衰老模型大鼠脑海马神经元的毒害作用[J].基础医学与临床,2002,22(6):546-549.
[4]孔明望,王平,田代志,石和元,Aβ-(25~35)合并鹅膏蕈氨酸诱导老年痴呆大鼠模型的建立及评价[J].中国老年学杂志,2008,(10):945-947.
[5]包新民,舒斯云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:1-5.
[6]M orris R.Development of a water maze procedure for studying spatial learning in the rat[J].Neurosci Methods,1984,11(1):47-60.
[7]Dallan B.T heseneseence-accelerated prone mouse(SAM PS):A model of age-related cognitive decline with relevance to alterations of the gene ex pression and protein abnormalities in Alzheimer's disease[J].Experimental Gerontology,2005,40:774-783.
[8]Lauren MB,Salvatore O,Kim NG,et al.Intraneuronal AI3 canses the onset of early Alzheime's disease related cognitive defieits in transgenic mice[J].Neuron,2005,45:675-688.
[9]Townsend W,Obreg on D,Quadros A,et al.Proinflammato ry and vasoactive effects of Abeta in the cerebrovas culature[J].Ann N Y Acad Sci,2002,977:65-76.
[10]陈霞,张振馨,黄觉斌,等.经影像学支持的阿尔茨海默病与血管性痴呆的临床比较研究[J].中华神经科杂志,2004,37:109-113.
[11]Joanna L,Jankow sky,T atiana M,et al.Environmental enrichment mitigates cognitive deficits in a mouse model of Alzheimer's disease[J].J Neuro,2005,25(21):5217-5224.
[12]Zheng Huihu,Xiao Chuanwang,Li Yunli,et al.Correlation of behavior changes and bold signal in Alzheimer-like rat model[J].Acta Biochimicaet Biophysica Sinica,2004,36(12):803-810.
