L-Arg在心肺联合移植中对心肺保护作用的实验研究
2010-06-08梁智星杨志刚郭建军王志斌李志英
梁智星,杨志刚,郭建军,张 勇,王志斌,李志英
近20年来,心 肺 联 合 移 植(combined heart-lung transplantation,CHLT)已被证实是治疗终末期心肺衰竭的一种有效治疗方法。供体在获取、保存和移植过程中发生的心肺缺血-再灌注损伤(ischemia-reperfusion injury,IRI)是导致移植后早期肺功能障碍甚至移植失败的主要原因,如何做好供体心肺的获取和保存,减轻IRI,是当前肺移植和心肺联合移植研究的热点之一。本文就L-Arg在防治心肺缺血再灌注损伤的作用及其机制进行了初步的研究,期望为L-Arg的临床新用途提供实验和理论依据。
1 材料与方法
1.1 实验动物 健康成年犬 20只,体重(16.2±1.5)kg,雌雄不拘,由山西医科大学动物实验中心提供。
1.2 实验仪器和试剂 体外循环机:STOKERT-SHILEY循环机,呼吸机:Newport Wave E200 ventilator,血气分析仪:美国I-STAT,电镜:JEM-100CX电镜,恒温干燥箱:上海跃进仪器厂,L-Arg:上海生物化学工程技术研究所,NO、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒:南京建成生物工程研究所,LPD液、St.thomas液:山西医科大学第一医院心脏外科。
1.3 实验方法
1.3.1 实验动物分组 随机分为实验组和对照组,每组各10只,每次实验使用供体犬和受体犬各1只。每组受体犬体重大于供体犬体重的18%~20%[1]。心肺灌注与保存分别使用4℃的LPD液和St.thomas液。对照组仅用4℃的St.thomas液及LPD液灌注心肺并保存,实验组于St.thomas液及LPD液中分别加入 L-Arg 500 mg/kg及300 mg/500 mL,所有动物实验前需要禁食12 h。
1.3.2 异体原位CHLT模型的建立 供体犬:肌注氯胺酮(20 mg/kg)和安定(0.5 mg/kg)麻醉后,固定于手术台上,气管插管,呼吸机机控制呼吸,全身肝素(3 mg/kg)化。正中开胸,打开心包,缝主动脉与肺动脉荷包线,置入灌注导管并固定,阻断升主动脉,经主动脉根部灌注4℃St.thomas液或实验组含加入 L-Arg的 St.thomas液(20 mL/kg,压力 100 mmHg),同时经主肺动脉灌注4℃LPD液或实验组含加入 L-Arg的 LPD液(60 mL/kg~80 mL/kg,压力 15 cmH2O~20 cmH2O,5 min内灌注完),灌注的同时切开左心耳使灌注液流出,直至灌洗液无色透明,肺呈现白色。中度膨肺(70%~80%),钳夹气管,切断升主动脉、上下腔静脉、气管、食管和肺韧带,整块切除心肺并修剪。供心肺放入 4℃的 LPD液保存 1.5 h~2 h。
受体犬:麻醉同前,经上下腔静脉及升主动脉建立体外循环(CPB),切除心肺,移植入供心、肺。开始吻合前,供心灌注4∶1冷血(10℃)高钾停搏液(20 mL/kg),(实验组加入 L-Arg 24 mmol/L),分别行气管、主动脉、右心房吻合,气管吻合完毕后,灌注4:1冷血(10℃)低钾停搏液一次(20 mL/kg),(实验组加入L-Arg 24 mmol/L),开始主动脉吻合时,复温。复温完毕后行右心房吻合,右心房后壁吻合结束,开放循环。继续并行CPB复温,同时吻合右心房前壁,心脏复跳有力,待循环稳定,鼻咽温升至 36℃~37℃,停 CPB。
1.4 检测指标 在CHLT过程中,分别测受体麻醉后、主动脉开放5 min和30 min 3个时间点的静脉血气分析。取心肺匀浆组织 4℃离心(3 000 r/min)10 min后,取上清液,应用 NO检测试剂盒,采用硝酸还原酶法,检测心肺匀浆组织中的NO的含量,应用MDA检测试剂盒,采用硫代巴比妥酸法,测定心肺匀浆组织中MDA的含量,按照 SOD检测试剂盒说明,采用黄嘌呤氧化酶法,测定心肺匀浆组织中SOD的活性。
1.5 肺含水量测定 肺组织用生理盐水冲洗后,立即称湿重量,然后在70℃的干燥箱下烘 72 h,称其干重量,计算肺组织的湿/干重比(W/D)。
1.6 肺组织超微结构的观察 切取供肺上叶组织(1 mm×1 mm×1 mm)用2.5%戊二醛固定,4℃保存,通过JEM-100CX透射电镜观察肺组织超微结构的变化。
1.7 统计学处理 实验数据采用SPSS12.0统计软件进行分析,数据以均数±标准差(±s)表示,采用 t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 不同时间PaO2、PaCO2检测结果(见表 1)
表1 两组不同时间PaO2、PaCO2检测结果(±s)mmHg
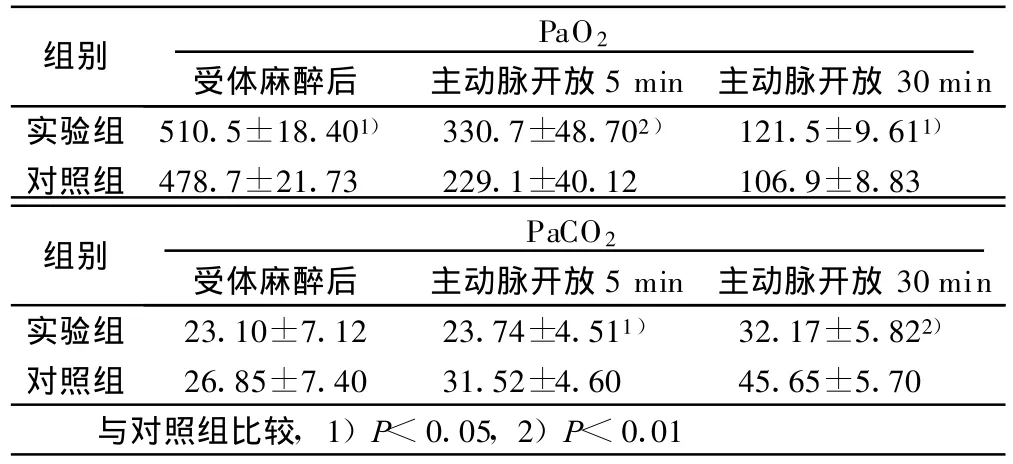
表1 两组不同时间PaO2、PaCO2检测结果(±s)mmHg
组别 PaO2受体麻醉后 主动脉开放5 min 主动脉开放 30 min实验组 510.5±18.401) 330.7±48.702) 121.5±9.611)对照组 478.7±21.73 229.1±40.12 106.9±8.83组别 PaCO2受体麻醉后 主动脉开放5 min 主动脉开放 30 min实验组 23.10±7.12 23.74±4.511) 32.17±5.822)对照组 26.85±7.40 31.52±4.60 45.65±5.70与对照组比较,1)P<0.05,2)P<0.01
2.2 移植心肌组织、肺组织 NO、SOD、MDA的含量(见表2、表3)
表2 两组移植肺组织NO、SOD、M DA的含量比较(±s)
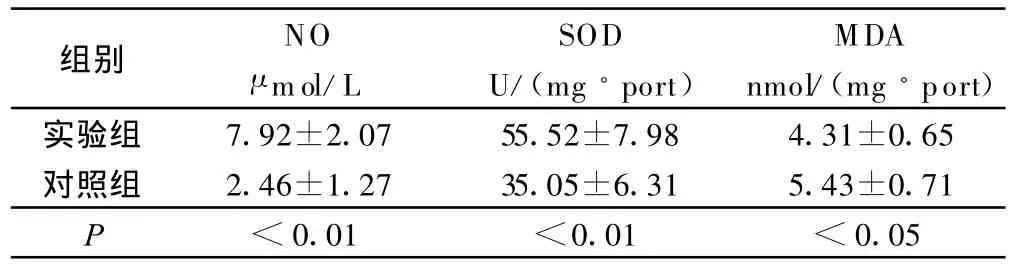
表2 两组移植肺组织NO、SOD、M DA的含量比较(±s)
组别 NO μ mol/L SOD U/(mg◦port)MDA nmol/(mg◦port)实验组 7.92±2.07 55.52±7.98 4.31±0.65对照组 2.46±1.27 35.05±6.31 5.43±0.71 P<0.01 <0.01 <0.05
表3 两组移植心肌组织NO、SOD、M DA的含量比较(±s)
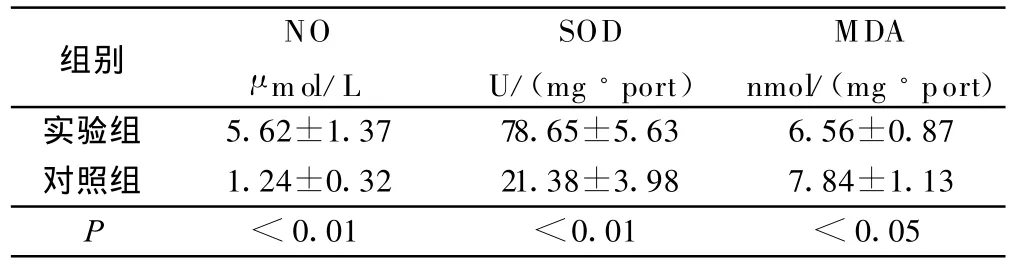
表3 两组移植心肌组织NO、SOD、M DA的含量比较(±s)
组别 NO μ mol/L SOD U/(mg◦port)MDA nmol/(mg◦port)实验组 5.62±1.37 78.65±5.63 6.56±0.87对照组 1.24±0.32 21.38±3.98 7.84±1.13 P<0.01 <0.01 <0.05
2.3 肺组织的湿/干重比 实验组为(5.32±0.14),对照组为(6.07±0.32),两组比较差异有统计学意义(P<0.05)。
2.4 肺组织电镜超微结构观察 对照组肺泡Ⅱ型细胞胞浆大小不等、空泡化,板层小体结构融合、线粒体嵴不清晰、血管内皮细胞壁不完整,肺泡上皮细胞少见。而实验组肺泡Ⅱ型细胞的板层小体结构清晰,线粒体嵴可见,较多完整血管内皮细胞、肺泡上皮细胞。
3 讨 论
随着各种治疗手段的进展,心肺联合移植已成为一种治疗晚期心肺疾病的有效方法。尽管已有许多改进措施,心肺移植术后缺血再灌注损伤仍是导致手术失败的主要原因之一,也是移植后发生慢性排斥反应的重要危险因素[2]。因此,如何改进心肺保存方法,提高心肺保存质量,延长保存时间,减轻心肺缺血再灌注损伤成为心肺联合移植基础和临床研究的热点。
L-Arg是NO的生理性前体,其生物学活性大部分是经过一氧化氮合成酶(NOS)作用生成 NO而起作用的[3,4]。NO具有进入血管平滑肌激活鸟苷酸环化酶,使细胞内Ca2+浓度降低,血管平滑肌松弛,抑制纤维蛋白原与血小板结合,减少毛细血管通透性、保持血管内皮的完整性等作用。目前多数学者认为血管内皮细胞是体内合成NO的最主要细胞,移植肺在缺血再灌注这一病理生理过程中受到损伤,病理状态下肺动脉内皮细胞NOS减少,其产物NO也随之减少[5]。肺毛细血管内皮细胞的损伤导致的通透性增高是缺血再灌注损伤后的基本病理改变,这种损伤主要表现为肺毛细血管通透性增加,进而导致肺水肿,影响肺组织中的气体交换。肺组织的湿/干重比在一定程度上可以反映肺功能受损的严重程度[6]。肺气体交换功能障碍被认为是评价肺缺血再灌注损伤程度及其保护效果最敏感的指标。本实验中实验组测定移植心肺NO的含量比对照组高,W/D较对照组减轻,实验组PaO2比对照组高,而PaCO2比对照组低。其病理学研究亦发现实验组肺泡出血及间质水肿较对照组减轻,表明L-Arg在肺灌注保存液中能减轻肺毛细血管的内皮损伤,减少 CPB中的体液积聚,可减轻移植肺间质水肿[7],减轻肺缺血再灌注损伤。
目前研究表明氧自由基生成过多或清除障碍时会对机体造成损伤。它可引起细胞内毒性反应,如细胞器破坏、细胞膜脂质过氧化、细胞内酶失活,核酸破坏等导致细胞死亡[8]。SOD是机体内重要的抗氧化酶,其活性的高低反映了机体清除氧自由基的能力,而MDA作为判定氧自由基造成细胞膜脂质过氧化损伤的指标之一,反映了机体细胞受自由基攻击的破坏程度[9]。L-Arg可通过促进NO的产生,减少过氧亚硝酸阴离子(ONOO-)生成,同时增加细胞内抗氧化物谷胱苷肽的水平,还可直接中和氧自由基,消除氧自由基对心肌及肺组织的损害。本研究实验组心肺组织SOD含量明显高于对照组,MDA含量较对照组显著降低,提示 L-Arg可抑制缺血再灌注自由基产生和脂质过氧化,增强内源性清除氧自由基的能力,从而减轻心肺缺血再灌注损伤。
[1]黄克力,吴若彬,肖学钧.15例犬心肺联合移植实验研究[J].国际医药卫生导报,2003,9(7):6-7.
[2]Reynaud GM.Pathophysiology of obliterative bronchiolitis in lung transplants[J].Rev Mal Respir,2003,20(2 Pt1):224-232.
[3]Liaudet L,Soriano FG,Szabo C.Biology of nitric oxide signaling[J].Crit Care Med,2000,28(4 suppl):37-52.
[4]Aitchison JD,Orr HE,Flecknell PA,et al.Nitric oxide during perfusion improves post transplantation function of non-heart-beating donor lungs[J].Transplantation,2003,75(12):1960-1964.
[5]Aguilo R,Serra E,Togores B,et al.Long-term(72hours)preservation of rat lung s[J].T horac Cardiovasc Surg,2003,125(4):907-912.
[6]Kutschka I,Sommer SP,Hohlfeld JM,et al.Insitu topical cooling of lung grafts:Early graft function and surfactant analy sis in a porcine single lung transplant model[J].Eur J Cardiothorac Surg,2003,24(3):411-419.
[7]Schutte H,Witzeurath M,Mayer K,et al.T he PDE inhibitor zaprinast enhances NO mediated protection against vascular leakage in reperfused lungs[J].J Physiology Lung Cellular Molecular Phy siology,2000,279(3):496-502.
[8]Liu CJ,Ueda M,Kosaka S,et al.A newly developed solution enhances thirty-hour preservation in a canine lung transplantation model[J].J T horac Cardiovascu Surg,1996,112(3):569-576.
[9]Paik HC,Hoffmann SC,Egan TM.Pulmonary preservation studies:Effects on endothelial function and pulmonary adenine nucleotides[J].Transplantation,2003,75(4):439-444.
