p21和p27基因多态性与女性肺癌的关联研究
2010-06-07李作生李保庆王国臣
李作生 李保庆 王国臣
p21和p27基因是调控细胞周期的相关基因。在细胞周期的G1/S期的调控中,通过与cyclin-cdk复合物结合抑制Rb蛋白磷酸化,从而诱导细胞周期阻滞,因而被认为是抑癌基因。p21基因外显子 3的 3’非翻译区(3’untranslated region,3’UTR)第20碱基对存在单核苷酸多态性(single nucleotide polymorphisms,SNPs),核苷酸出现 C→T 突变(3’UTR 多态性),p27基因第109密码子存在V109G多态性,核苷酸出现T→G突变。研究表明p21和p27基因多态性与口腔鳞癌、乳腺癌、前列腺癌等多种肿瘤的发病风险有关[1-3]。本研究检测了华北煤炭医学院附属医院胸外科和河北医科大学第四医院2003年1月至2006年1月女性人群中非小细胞肺癌(non-small cell lung carcinoma,NSCLC)遗传易感性及淋巴结转移与p21和p27基因单核苷酸多态性SNPs的关系。
1 资料与方法
1.1 一般资料 病例组选取110例NSCLC病例,经手术或支气管镜检查证实。年龄27~76岁,平均年龄57.1岁。对照组124例,年龄29~70岁,平均年龄54.9岁,无肿瘤及遗传病史。
1.2 外周血白细胞DNA提取 研究对象均抽取外周静脉血5 ml,经枸橼酸钠抗凝,于4℃冰箱保存,并于采血后1周内提取外周血白细胞DNA。DNA提取采用蛋白酶K消化-饱和氯化钠盐析法。
1.3 p21、p27 SNPs基因分型 p21、p27基因型检测应用聚合酶链反应-限制性片段长度多态性分析(polymerase chain reaction-restriction fragment length polymorphism,PCR-RFLP)方法进行。p21 SNP 扩增引物为 5’-GAATTTGCCGTTGGGTCAAG-3’(上游引物)和 5’-AGGAGAACACGGGATGAGGAG-3’(下游引物)[3]。p27 SNP 扩增引物为5’-TGCAGACCCGGGAGAAAG-3’(上游引物)和 5’-CCGCTAACCCCGTCTGG-3’(下游引物)[3]。PCR反应体系均为25 μl,其中模板 DNA 100 ng,10× PCR缓冲液 2.5 μl,Taq-DNA 聚合酶2.5 U,MgCl22.0mm ol/L,dNTPs 0.2mmol/L,上、下游引物各0.2 μmol/L。PCR反应条件为:94℃预变性 10 min,94℃ 45 s,58℃ 45 s(p21)或 60℃ 45 s(p27),72℃ 60 s,35 个循环后,72℃ 延伸 7 min。取 8 μl PCR产物进行限制性内切酶消化,经3%琼脂糖凝胶电泳分析基因型。p21基因的PCR产物经限制性内切酶PstⅠ37℃酶切后,C/C基因型产物为133、256和479 bp 3个DNA片段,T/T基因型表现为133 bp和735 bp 2个片段,C/T杂合型表现为133、256、479、735 bp 4个片段(图1)。p27基因的PCR产物经限制性内切酶BglⅠ37℃酶切后,T/T基因型表现为76 bp和378 bp 2 个片段,G/G 型为76、113、265 bp 3 个片段,T/G 型为76、113、265、378 bp 4个片段(图2)。以蒸馏水替代模板DNA作为阴性对照。随机抽取10%的DNA标本进行重复实验。
1.4 统计学分析 应用SPSS 10.0统计软件,比较基因型频率的观察值与预期值应用χ2检验进行Hardy-Weinberg平衡检验。2组的基因型分布、等位基因型频率的比较均采用四格表χ2检验。以非条件Logistic回归法计算表示相对风险度的比值比(odds ratio,OR)及其 95%可信区间(confidence interval,CI),并经年龄校正,P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般特征 2组的年龄构成比、吸烟状况间差异无统计学意义(P>0.05)。见表1。
2.2 p21基因SNPs分布 所有DNA标本均经PCR-RFLP方法成功进行了基因分型,所有重复分型结果均与原结果相符。
2.2.1 p21基因型分布在2组均符合 Hardy-Weinberg平衡。p21基因C和T等位基因在2组的分布间差异有统计学意义(P<0.01),p21基因突变型(C/T+T/T)频率在病例组(76.4%)显著高于对照组(56.5%)(χ2=10.27,P <0.01)。携带T等位基因(C/T和T/T基因型)能显著增加这一人群NSCLC发病风险[经年龄校正的 OR=2.60,95%CI(1.46,4.61)]。见表1、2。
2.2.2 根据个体吸烟状况的分层分析表明,在不吸烟个体中,p21基因突变型频率在病例组(86.0%)显著高于对照组(56.4%)(χ2=19.02,P <0.01)。与C/C基因型相比,C/T和T/T基因型可显著增高不吸烟女性的NSCLC发病风险[经年龄校正的 OR=4.95,95%CI(2.36,10.40)]。见表 2。
2.2.3 在对年龄进行的分层分析显示,在≥50岁年龄组,p21基因突变型频率在病例组(76.6%)明显高于健康对照组(56.7%)(χ2=8.48,P <0.01)。携带 C/T、T/T基因型较 C/C基因型能显著增加50岁以上女性人群NSCLC发病风险[经年龄校正的 OR=2.68,95%CI(1.41,5.08)]。见表 2。
2.3 p27基因SNP分布 p27基因型分布在2组均符合Hardy-Weinberg平衡。p27等位基因频率和基因型总体分布在病例组和对照组之间差异无统计学意义(P>0.05)。携带G等位基因不增加这一人群NSCLC发病风险。根据吸烟状况和年龄进行的分层分析也未发现这一多态性与NSCLC发病风险有关。见表 1、3。
2.4 p21、p27基因SNPs与NSCLC淋巴结转移的关系 对有淋巴结转移的73例NSCLC患者进行了分层分析。结果显示,p21和p27基因多态性与NSCLC患者的淋巴结转移无关。

图1 PCR-PstⅠ酶切的p21SNP基因分型
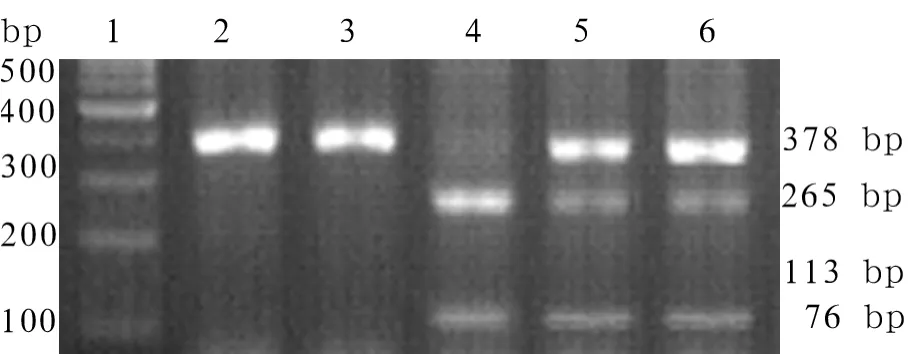
图2 PCR-BglⅠ酶切的p27SNP基因分型
3 讨论
p21基因定位于人第6号染色体短臂的2带1区(6p21.2)为单拷贝基因[4]。p21有几种多态性,报道较多的是以下两种多态性:一是在外显子2第31密码子(p21c31多态性),核苷酸出现C→A改变,导致氨基酸出现丝氨酸-精氨酸(ser-arg)改变,并且有研究认为A等位基因的出现使p21转录明显下降从而使其蛋白表达减低[5];另一种是3’UTR多态性。每一种多态性都被认为能够改变p21的功能[6]。p21多态性中的高风险基因型被认为与包括口腔鳞癌、乳腺癌及前列腺癌在内的多种恶性肿瘤有关[1-3]。本研究结果与以上研究结果一致,表明携带C/T、T/T基因型较之C/C型能显著增加这一人群NSCLC发病风险。

表1 2组一般情况及等位基因型频率 例(%)

表2 p21基因多态性分层分析 例(%)

表3 p27基因多态性分层分析 例(%)

表4 p21和p27基因型与淋巴结转移的关系 例(%)
吸烟是公认的肺癌发病危险因素,且有研究认为某些基因多态性在肺癌发病风险方面与吸烟有协同作用[7],但本研究显示,p21突变型只增加不吸烟女性NSCLC发病风险,并未发现吸烟与携带T等位基因对增加NSCLC发病风险有相互作用。因此,对p21 SNP仅影响不吸烟者肺癌发病风险的确切机理还有待进一步探讨。
本研究以年龄50岁为界进行了分层分析,结果显示在≥50岁年龄组中,p21基因突变型能显著增加50以上人群NSCLC发病风险。这一结果也提示在NSCLC的发病中,在遗传易感性的基础上,外界环境因素持续或间断作用于机体,经过数年引起的代谢改变,最终导致NSCLC的发生。
p27基因定位于人第12号染色体短臂1区2带和1区3带第一亚带之间(12p12-12p13.1)[8]。目前报道的p27 SNP位于第109密码子,核苷酸出现T→G突变(GTC→GGC),导致氨基酸出现缬氨酸(Val)→甘氨酸(Gly)替代,即V109G多态性。在本研究中,没有显示出p27突变基因型与NSCLC易感性有关,经吸烟状况、年龄进行的分层分析也均未显示出有统计学意义。而Kibel等[3]的研究则认为VV基因型(T/T基因型)是危险基因型,该基因型增加了晚期前列腺癌的发病风险。Thomas等[1]的研究则认为携带突变型(T/G、G/G)的早期乳腺癌患者预后差。Li等[2]也认为在口腔鳞癌中,突变的G/G型是危险因素。上述研究结果说明对于p27V109G多态性的研究结果存在较大分歧。另外,p27基因在肿瘤细胞中很少有突变和甲基化,且其功能的改变是转录后调节,因此对于其基因多态性与肿瘤易感性的相关性研究的价值可能会降低[8,9]。
肿瘤是否发生侵袭和转移是决定个体治疗方案和预测患者预后的关键指标。虽然有研究显示p21低表达使肿瘤淋巴结转移增加[9],携带p27V109G突变型能增加乳腺癌患者淋巴结转移数目[1],但我们的研究结果显示,p21和p27基因多态性不增加NSCLC患者淋巴结转移风险。
1 Thomas S,Lewin E,Uwe-Jochen G,et al.The V109G polymorphism of the p27 gene CDKN1B indicates a worse outcome in node-negative breast cancer patients.Tumor Biology,2004,25:306-312.
2 Li G,Sturgis EM,Wang LE,et al.Association between the V109G polymorphism of the p27 gene and the risk and progression of oral squamous cell carcinoma.Clin Cancer Res,2004,10:3996-4002.
3 Kibel AS,Suarez BK,Belani J,et al.CDKN1A and CDKN1B Polymorphisms and Risk of Advanced Prostate Carcinoma.Cancer Res,2003,63:2033-2036.
4 Smith CAD,Smith G,Wolf CR.Genetic polymorphisms in xenobiotic metabolism.Eur J Cancer 1994,30:1921-1935.
5 Su L,Sai Y,Fan R,et al.P53(codon 72)and P21(codon 31)polymor-phisms alter in vivo mRNA expression of p21.Lung Cancer,2003,40:259-266.
6 Mousses S,Ozcelik H,Lee PD,et al.Two variants of the CIP1/WAF1 gene occur together and are associated with human cancer.Hum Mol Genet,1995,4:1089-1092.
7 Yu CY,Pan KF,Xing DY,et al.Correlation between a single nucleotide polymorphism in the matrix metalloproteinase-2 promoter and risk of lung cancer.Cancer Res,2002,62:6430-6433.
8 Ponce-Castaneda V,Lee MH,Latres E,et al.p27kip1:chromosomal mapping to 12p12-12p13.1 and absence of mutations in human tumors.Cancer Res,1995,55:1211-1214.
9 管晓翔,陈龙邦.肿瘤细胞蛋白错位分布和低表达的分子机制.中华肿瘤防治杂志,2006,13:786-789.
