补肾安胎方及其拆方对控制性超排卵小鼠胚胎着床干预的比较*
2010-06-06孟艳岑张明敏
贾 研 孟艳岑 张明敏
华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 430030
控制性超排卵(COH)是目前常规体外受精-胚胎移植(IVF-ET)过程的重要步骤,旨在用大量的促性腺激素促进卵巢功能,以获得多个可供选择的卵泡,但目前各种控制性超排卵方案均极影响子宫内膜环境,使得胚泡着床率低下,而以中医理论为基础的复方在改善子宫内膜容受性上具有其独特的优势。由菟丝子、桑寄生、川续断、丹参、黄芪、当归组成的补肾安胎方多次运用于临床IVF-ET技术失败的患者,有提高孕育成功率的作用。前期的研究[1-2]表明,该方可以通过多种分子机制,如提高雌二醇(E2)、孕酮(P)、雌激素受体(ER)、孕激素受体(PR)、白血病抑制因子(LIF)等的表达,改善内膜功能,促进控制性超排卵小鼠的胚胎着床,但其各组分的具体作用尚需进一步明确。基于此,我们对补肾安胎方及其补肾、活血组分进行比较,观察全方及其拆方对子宫内膜容受性的标志性因子围着床期类肝素结合表皮生长因子(HBEGF)和表皮生长因子受体(EGFR)的影响,探讨各组分间是否具有选择和协同作用,为中医补肾方、活血方改善胚泡着床机制提供理论依据。
1 材料与方法
1.1 实验对象
选用健康清洁级昆明小鼠,雌性未交配过,雄性证明有生育能力,鼠龄10~12周,体重28~32 g(湖北省卫生防疫站提供),置于室温18~22℃,10 h光照,14 h暗室,相对湿度70%~85%的动物房内,雌雄分笼饲养,自由摄食,饮水。
1.2 药物及试剂
补肾方由菟丝子、桑寄生、川续断组成;活血方由黄芪、当归、丹参组成;补肾安胎方则为上述两方相加,3种方剂按一定比例制成含生药量1.45 g/ml的无菌煎剂,密封,4℃保存。注射用孕马血清(PMSG)选自杭州动物药品厂;注射用绒毛膜促性腺激素(HCG)选自上海丽珠制药;伊文思蓝染色试剂选自南京奥多福尼生物科技有限公司;免疫组织化学试剂:HB-EGF多克隆抗体(Santa cruze,USA)、兔抗羊二抗SP试剂盒和DAB显色试剂盒(北京中山生物技术有限公司);RT-PCR试剂:T rizol RNA抽提试剂(Gibcobr,USA)、Taq DNA聚合酶及反应缓冲液、MMLV反转录酶及其反应缓冲液、Oligo(Dt)18、dNTP、RNasin 酶抑 制剂(Promega,USA)、PCR Marker(Ferment,USA)。
1.3 实验方法
1.3.1 分组及处理 将小鼠随机分为正常组(N)、模型组(M)、补肾安胎组(BH)、补肾组(BS)和活血组(HX),连续观察两个动情周期正常。模型组和中药各组于05∶00 PM腹腔注射PMSG 10 IU,48 h后腹腔注射 HCG 10 IU,于注射HCG当晚按雌雄比例1~2∶1合笼;正常组不经控制性超排卵而合笼。模型组和正常组于注射PMSG当日起,每日08∶00 AM灌服双蒸水0.3 ml;中药各组均灌服中药0.3 ml。合笼后次日07∶00~08∶00 AM 检查雌鼠阴道,发现阴栓者计为妊娠第1天。
1.3.2 标本收集 于妊娠第5天、第6天的07∶00 PM向小鼠尾静脉注射0.1 ml 0.5%伊文思蓝,15 min后颈椎脱臼处死小鼠,剖腹取子宫。被伊文思蓝染为深蓝色部位为小鼠胚胎着床位点。剪取一半子宫置于-80℃冰箱用于RT-PCR,另一半置于4%的多聚甲醛中固定12 h后,送同济医院病理科石蜡包埋切片。
1.3.3 小鼠阴栓率、妊娠率、着床位点数检测 小鼠合笼后次日清晨查阴栓,有阴栓者即为阳性并记数;妊娠第6天,剖腹取子宫后,记录各组妊娠鼠数和孕鼠着床位点数。
1.3.4 妊娠第6天小鼠胚泡实物图观察 于妊娠第6天取子宫标本后,将妊娠子宫对称平铺于清洁玻璃培养皿中,拍照。
1.3.5 HB-EGF mRNA表达测定 采用Trizol试剂提取细胞及组织总 RNA,取模板RNA 1 μ g加入Oligo(Dt)18,70℃变性5 min后迅速置冰上冷却2 min,加入MMLV反转录酶及反应缓冲液、RNasin酶抑制剂、dNTP,42℃60 min后,70℃10 min进行cDNA第一链的合成。然后以cDNA为模板进行PCR。根据Primer 6.0软件设计引物序列:HB-EGF上游引物:5′-GCAGCGGACAGTGCCT TAG-3′,下游引物 :5′-CCCGTGGATGCAGTAGTG-3′,扩增产物长度为478 bp。以β-actin作为内参照,上游引物:5′-TGCCCATCTATGAGGGTTAC-3′, 下 游 引 物 为:5′-GGAAGGTGGACAGTGAGGC-3′,扩增产物长度为570 bp。反应条件为94℃预变性5 min,94℃变性50 s,50℃退火50 s,72℃延伸90 s,进行29个循环,最后1个循环后,72℃延伸10 min。分别取HB-EGF和β-actin PCR 产物 5 μ l加 6×上样缓冲液 1 μ l,1.7%琼脂糖凝胶电泳(100 V,30 min),然后用凝胶成像系统(上海培清)成像,再用Quantity One软件,分析各条带灰度值,得LIF/β-actin的灰度比值,即为LIF mRNA的相对表达值。
1.3.6 EGFR蛋白表达测定 按照SP试剂盒说明步骤行SP染色,以一抗来源的血清代替一抗作阴性对照。光镜下结果判定:细胞胞质染成淡黄至棕黄为阳性细胞标志,每张切片在光镜下随机选取5个不同视野,以切片染色的背景作对照,采用HPIAS 1000病理图文分析系统(同济医学院千屏影像公司)分析。
1.4 统计学处理
2 结果
2.1 5组小鼠阴栓率、妊娠率和胚胎着床位点数比较
与正常组比较,模型组阴栓率、妊娠率显著降低(P<0.01),着床位点显著增多(P<0.01);各中药组着床位点数较模型组降低,但阴栓率、妊娠率显著升高,补肾安胎组均较活血组和补肾组显著(P<0.05,P<0.01);阴栓率活血组优于补肾组(P<0.05),着床位点数活血组低于补肾组(P<0.01),但活血组和补肾组妊娠率无明显差异(P>0.05)。见表1。
表1 各组小鼠阴栓率、妊娠率和胚胎着床位点数比较(±s)

表1 各组小鼠阴栓率、妊娠率和胚胎着床位点数比较(±s)
与正常组比较**P<0.01;与模型组比较##P<0.01;与补肾安胎组比较△P<0.05,△△P<0.01;与补肾组比较□P<0.05,□□P<0.01
组别 n 阴栓阳性数(只,%) 妊娠数(只,%) 着床位点数(个/只)正常组 36 29(80.56) 29(100.00) 14.55±1.74模型组 36 19(52.78)** 15(78.95)** 23.76±5.36**补肾安胎组 35 26(74.29)## 24(92.31)## 16.64±2.71##补肾组 37 23(62.16)##△ 20(86.96)##△△ 20.17±2.79##△△活血组 36 25(69.44)##△□ 23(88.46)##△ 18.95±4.44##△△□□
2.2 妊娠第6天小鼠胚泡实物图观察
实物大体观察显示:正常组小鼠胚泡呈串珠状,均匀分布于两侧子宫,伊文思蓝着色均匀,胚泡大小均一,发育良好。模型组小鼠胚泡数多,大小不等,分布不均,伊文思蓝着色深浅不一,有大量相互融合的胚泡。各中药组小鼠胚泡数较模型组少,大小及分布较模型组均匀,但不及正常组胚泡。其中补肾安胎组胚泡呈串珠状,大小及分布均较补肾组、活血组均匀,伊文思蓝着色较接近正常组;补肾组和活血组之间比较,活血组胚泡分布及着色均较补肾组颗大、均匀;补肾组胚泡亦有融合现象。见图1。
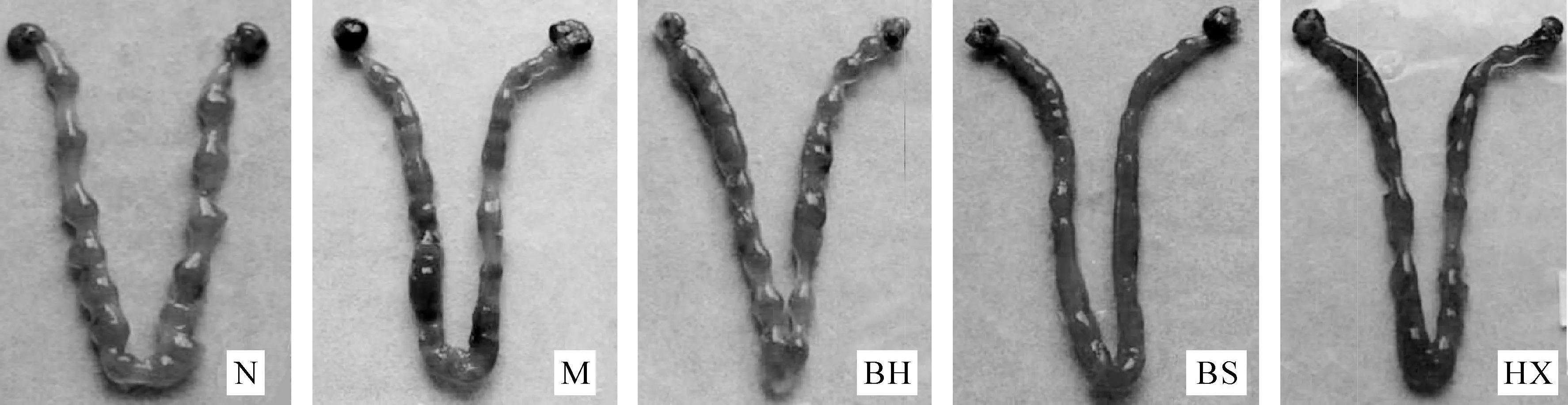
图1 各组小鼠妊娠第6天着床位点实物图(伊文思蓝染色)
2.3 各组小鼠妊娠第5天、第6天子宫内膜HB-EGF mRNA的表达
模型组子宫内膜HB-EGF mRNA的表达显著低于正常组(P<0.01),中药各组治疗后HB-EGF mRNA表达均显著升高(P<0.01)。补肾活血组HBEGF mRNA的表达明显高于活血组和补肾组(P<0.05),活血组高于补肾组(P<0.05)。各组于妊娠第5天表达量均较妊娠第6天强。见表2-3、图2。
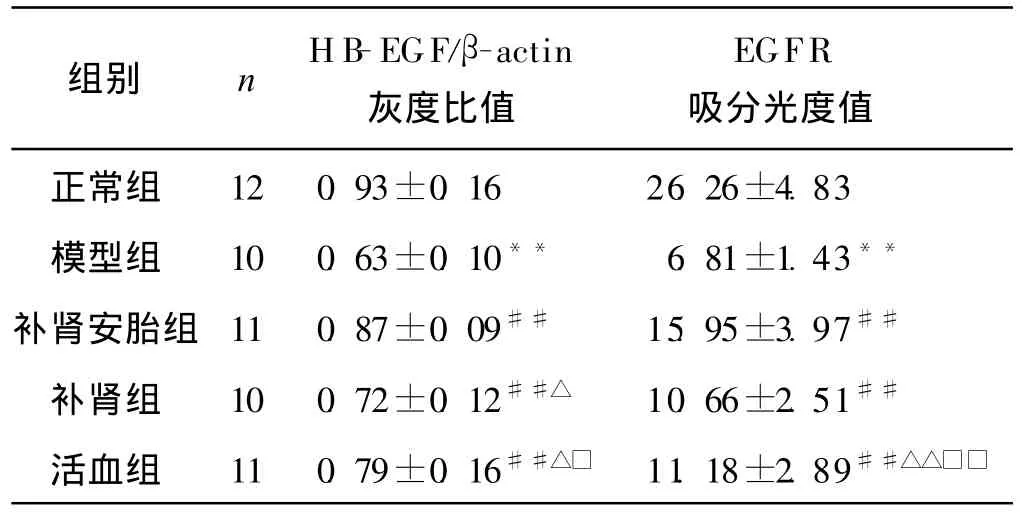
表2 各组小鼠妊娠第5天着床部位子宫内膜HB-EGF mRNA及EGFR蛋白表达的比较
2.4 各组小鼠妊娠第5天、第6天子宫内膜EGFR蛋白表达
正常组腺体致密,腺上皮细胞核中EGFR表达丰富,子宫内膜细胞质中也有大量表达;模型组腺体稀疏,腺上皮细胞核中EGFR表达较少,部分缺失,内膜间质细胞中几乎无表达,模型组EGFR表达较之正常组均显著减少(P<0.01);中药各组腺体和间质中EGFR表达量均高于模型组(P<0.01);其中补肾活血组高于活血组(P<0.05,P<0.01),活血组高于补肾组(P<0.05,P<0.01)。见表2-3、图3。
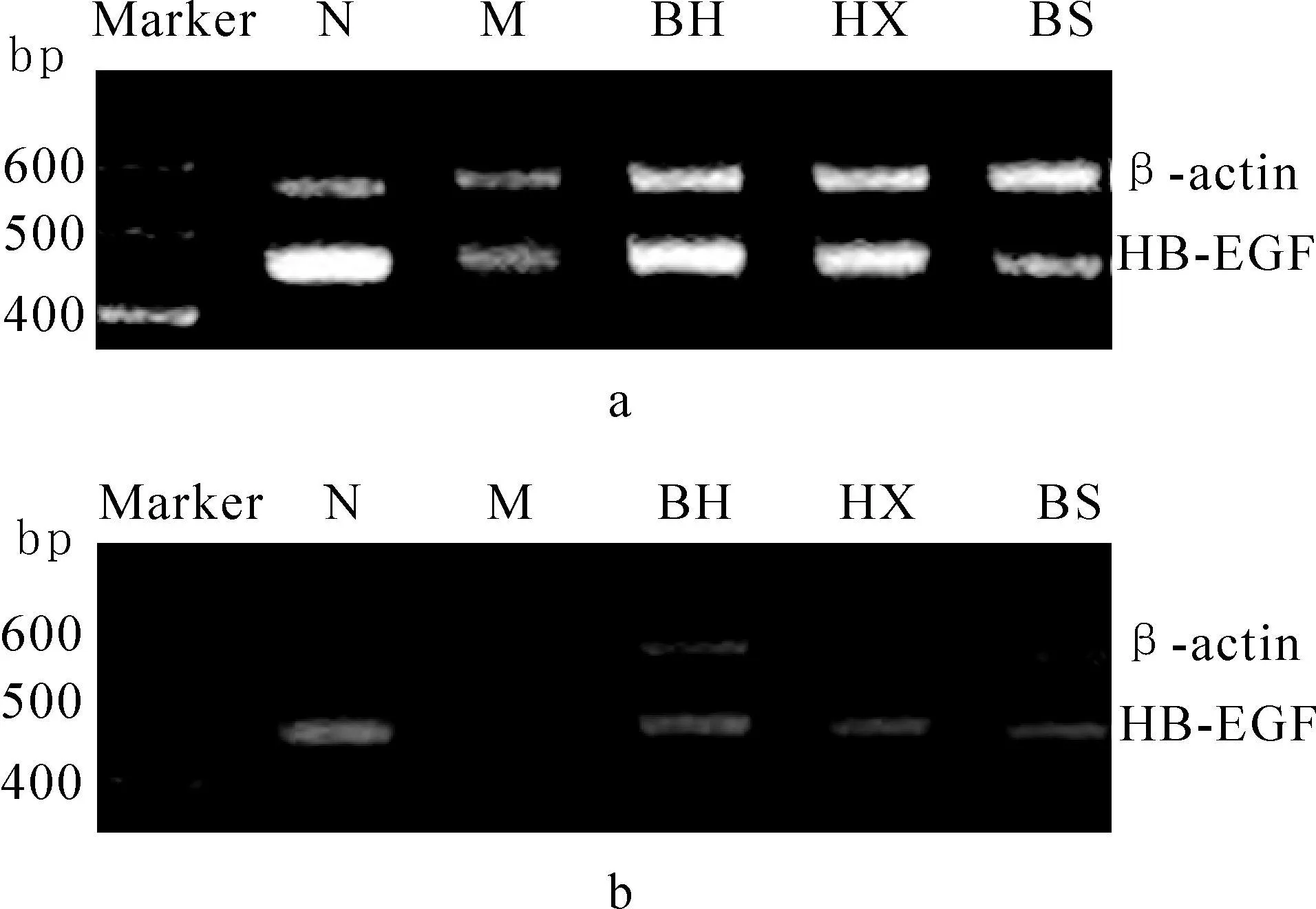
图2 各组妊娠小鼠子宫内膜HB-EGF mRNA的PCR电泳图
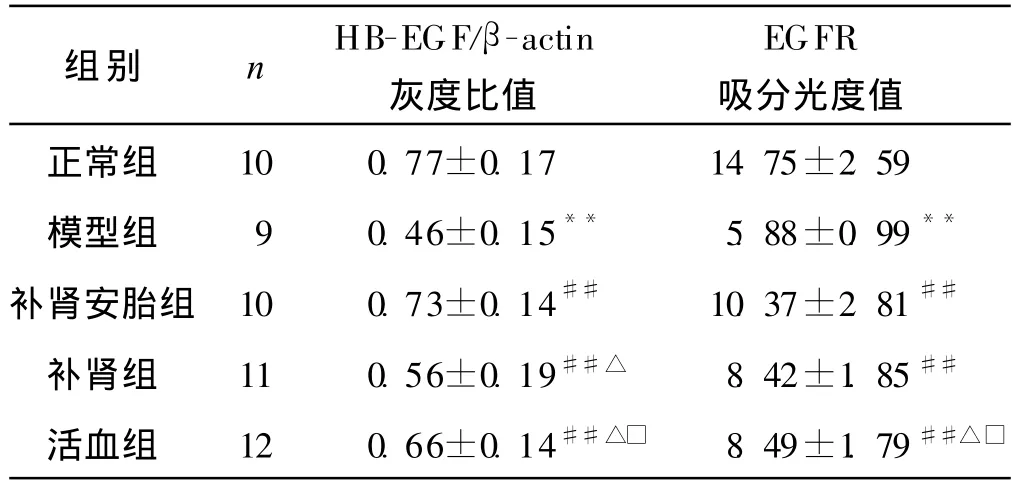
表3 各组小鼠妊娠第6天着床部位子宫内膜HB-EGF mRNA及EGFR蛋白表达的比较
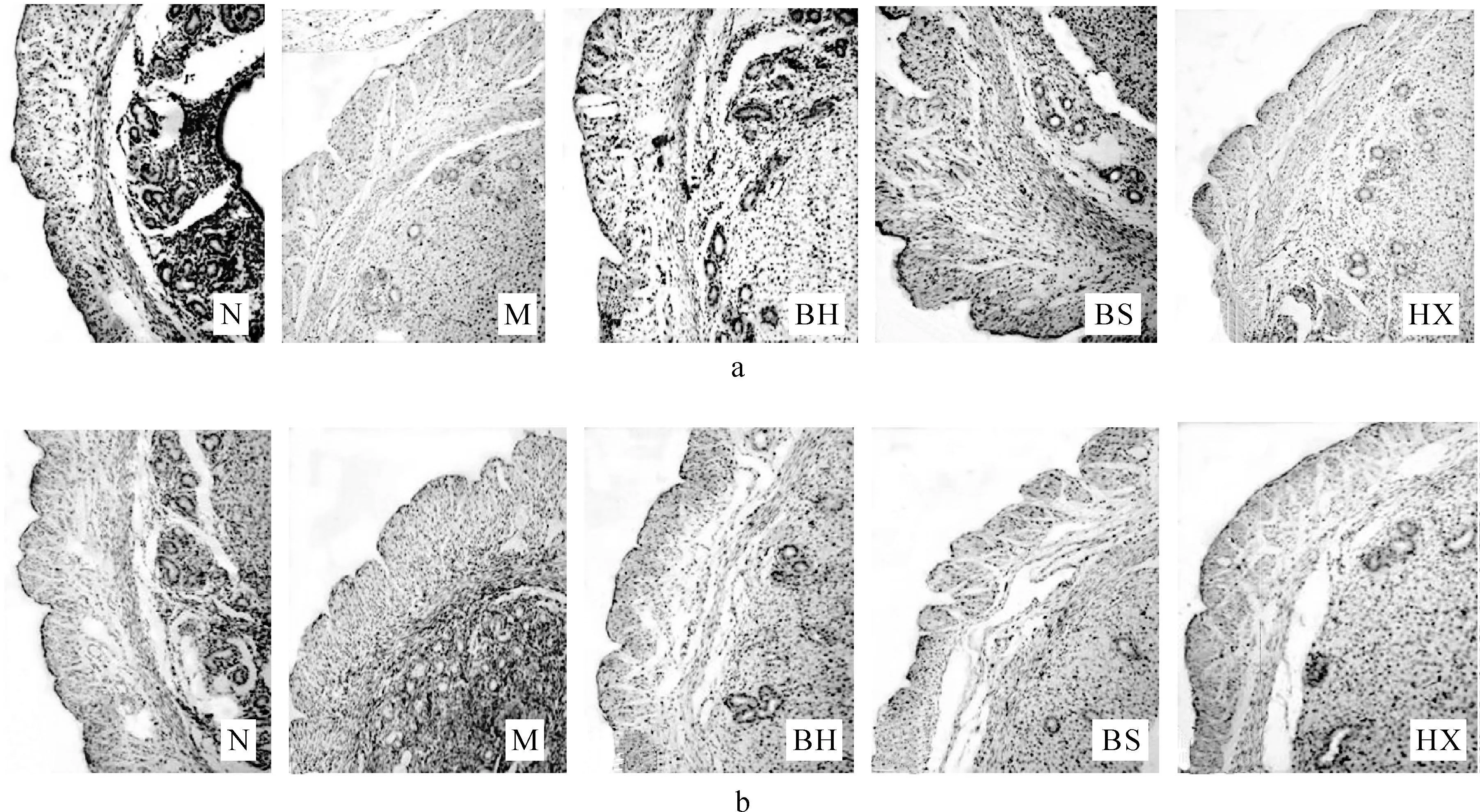
图3 各组小鼠子宫内膜EGFR蛋白表达(SP染色,×200)
3 讨论
IVF控制性超排卵阶段,必须使用大量的外源性促性腺激素促发卵巢功能,以提高获卵率,但大量激素的应用使得子宫内膜容受性降低,胚胎的发育与子宫内膜的发育不同步,且目前尚无理想的药物改善子宫内膜环境,胚泡着床率不高[3],这是生殖医学亟待解决的问题,以中医理论为基础的复方则成为目前的治疗选择之一。补肾安胎方应用于接受辅助生殖技术的患者,有提高临床妊娠率的作用。补肾方由菟丝子、桑寄生、川续断组成。补肾中药有类促性腺激素样作用,能够增强下丘脑-垂体-性腺轴的功能[4]。其中菟丝子可使果蝇交配率明显增加[5];桑寄生作为细胞分裂的免疫刺激剂,能够明显加快细胞增殖分化和组织更新[6];川续断生物碱具有抗流产作用[7]。活血方由黄芪、当归、丹参组成,其中黄芪具有类雌激素样作用,可延长小鼠的动情期,对小鼠的发育有良好的影响[7];当归挥发油成分有抑制血小板聚集的作用,可以提高血管通透性及降低血管阻力[8];丹参有效成分可抑制血小板的聚集,防止其活性物质释放,避免血管收缩和血栓形成;两者均可增加器官的血流量,改善子宫血管灌注[9-10]。
HB-EGF是表皮生长因子家族中的多效因子之一,它与其受体相结合,调节胚胎着床的全过程和原始胚胎的分化,HB-EGF诱导胚胎滋养层表面ErbB的二聚体作用和自身磷酸化,激活丝裂原活化蛋白激酶路径完成胚泡与内膜的融合[11]。在围着床期,HBEGF表达量逐渐增加,妊娠第5天~第6天达最高峰[12],故HB-EGF的表达与胚泡着床同步。用间接免疫荧光法观察到HB-EGF在卵裂后2细胞期至10细胞期的胚胎细胞表面均有大量表达[13],发挥着有丝分裂原的作用,促进着胚泡发育和分化。故HB-EGF是衡量胚胎着床和发育状态的关键因子。
在本实验中,我们运用PMSG联合HCG建立控制性超排卵小鼠模型,旨在研究控制性超排卵后子宫内膜HB-EGF及其受体EGFR表达的变化,并观察补肾安胎方及其不同组分对表达的影响。研究结果显示,正常组子宫内膜HB-EGF基因表达高峰在妊娠第5天,而妊娠第6天即开始下降;经外源性促性腺素刺激,模型组小鼠妊娠第5天、第6天的HB-EGF mRNA表达较正常组降低,中药各组HB-EGF mRNA表达均较模型组明显改善。免疫组织化学检测结果显示:EGFR蛋白表达趋势与HB-EGF的表达变化无明显差异,促性腺素刺激对子宫内膜HB-EGF蛋白空间分布无影响。本实验表明,控制性超排卵导致小鼠围着床期子宫内膜HB-EGF及受体EGFR蛋白表达降低,中药补肾安胎方能够使子宫内膜HB-EGF及其受体EGFR表达水平上调,从而提高小鼠围着床期子宫内膜容受性。而在拆方组中,活血组HB-EGF及其受体EGFR表达较补肾组升高明显,全方组较之拆方组的作用明显提高。以上结果表明,活血中药在提高子宫内膜容受性和促进胚泡发育方面有积极作用,与补肾组联合应用效果更加明显。
本研究通过比较补肾安胎方及其拆方对控制性超排卵小鼠着床干预的临床疗效及相关分子水平变化,进一步证实了补肾、活血中药均可以提高子宫内膜容受性,促进胚泡生长发育。补肾、活血中药具有选择及协同效应,两者联合应用疗效更为明显,对HB-EGF基因及其受体表达的调控可能是两者的共同作用结果。
[1] 张明敏,何新芳,张锦金.超排卵对小鼠着床期白血病抑制因子的影响及中药的调节作用[J].中西医结合研究,2009,1(1):9-12.
[2] 张明敏,张锦金,何新芳.超排卵对小鼠着床期雌,孕激素及其受体的影响及中药调节[J].中国妇幼保健,2009,15(3):50-53.
[3] ERTZIED G,STORENG R.The impact of ovarian stimulation on implantation and fetal development in mice[J].Hum Reprod,2001,16(2):221-225.
[4] 夏天.补肾方药对下丘脑-垂体-卵巢轴作用的研究概述[J].北京中医,2004,23(6):376-377.
[5] 吴春艳,刘峰,张雪玲.菟丝子的现代研究[J].中国实用医药,2009,4(14):243-244.
[6] 陈乐生.桑寄生药理研究[J].陕西中医,2000,21(11):520-521.
[7] 钟美英,申玉华.川续断的研究现状[J].中医药导报,2008,14(6):137-139.
[8] 王海彬,王军舰,黄辉,等.黄芪注射液对雌激素受体的激活作用研究[J].时珍国医国药,2006,17(6):2113-2115.
[9] 王焱林,王成夭,曾锐,等.当归对大鼠心肌缺血/再灌注损伤蛋白激酶C的影响[J].中华麻醉学杂志,2000,20(8):490-492.
[10] 许继文,付春梅.丹参的药理作用研究进展[J].医学综述,2006,12(23):1467-1469.
[11] 邓春霞,叶春生.当归对血液与循环系统作用的药理研究概况[J].湖北中医杂志,2000,22(5):54-55.
[12] WANG J,MAYERNIK L,SCHULTZ JF,et al.Acceleration oftrophoblast differentiation by heparin-binding EGF-like growth factor is dependent on the stage-specific activation of calcium influx by ErbB receptors in developing mouse blastocysts[J].Development,2000,127(1):33-44.
[13] UM ATA T.Mechanism for activation of heparin-binding EGF like growth factor induced by stimuli[J].J UOEH,2004,26(1):85-97.
