产脱卤酶菌株的筛选及其应用
2010-06-05曹京雯,郑国钧
脱卤酶是能催化卤族离子从卤代有机化合物上释放出来的酶。通过对邻位卤代醇的催化作用,可以使邻位卤代醇脱去卤族离子,形成相应的环氧化合物。具有单一光学构象的环氧化合物在药物合成中有很重要的作用,卤代醇被认为是合成环氧化合物的重要中间体[1]。近年来,环氧化合物通常经由化学法合成[2~4],而脱卤酶生物催化合成环氧化合物的研究较少。据文献报道,研究比较广泛的脱卤酶主要是α-氯丙酸(α-CPA)脱卤酶[5,6]以及卤烷脱卤酶[7]。目前尚没有关于筛选产卤代醇脱卤酶菌种的相关文献报道。
卤代醇脱卤酶是一种细菌酶,可以催化邻位卤代醇转化为相对应的环氧化合物。酶促卤代醇脱卤反应的一般反应机理[8]是基于有效序列与脱卤酶/水解酶短链的相似性,已通过对剩余催化剂残基进行定点诱变所证实。这一机理从根本上区别于水解作用的脱卤酶机理是其不包括酶-底物的共价中间体。另外,卤代醇脱卤酶可通过对映体选择性开环催化动力学拆分外消旋的环氧化物,这为制备具有光学活性的化合物提供了一种新的策略。
作者以氯乙酸作为唯一碳源,从土壤样本中筛选得到能通过酶促反应将β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯(图1)的高产脱卤酶菌株,并优化了发酵培养基和转化条件。
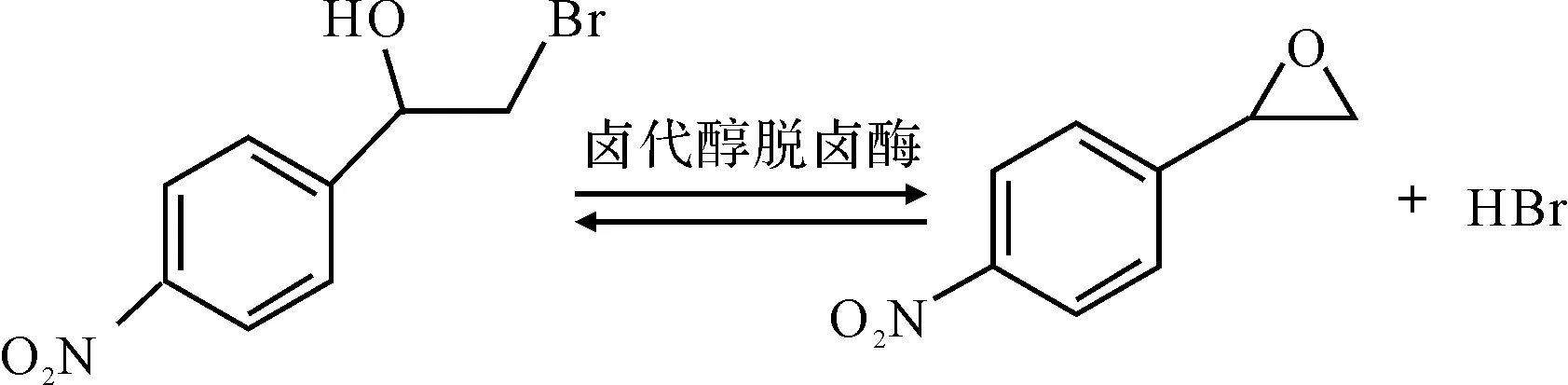
图1 酶催化β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯的反应式
由于底物β-溴对硝基苯乙醇以及诱导物氯乙酸均有毒性,可能会抑制细胞大量生长,这也成为本课题的难点。
1 实验
1.1 培养基、试剂和仪器
筛选培养基(g·L-1):Na2HPO43.2, KH2PO41.5,酵母5,氯乙酸2, MgSO498 mg,CaCl210 mg, FeSO41 mg,ZnSO40.1 mg。250 mL三角瓶装入30 mL培养基,121℃灭菌20 min。
平板培养基(g·L-1):蛋白胨10,酵母5,NaCl 10,琼脂20,氯乙酸2,pH值7.0。121℃灭菌20 min,每个平板倒入10 mL培养基。
发酵培养基(g·L-1):Na2HPO43.2,KH2PO41.5,酵母5,蛋白胨2.5,氯乙酸2,MgSO498 mg,CaCl210 mg,FeSO41 mg,ZnSO40.1 mg。每支试管装入5 mL培养基,121℃灭菌20 min。
转化液:将β-溴对硝基苯乙醇溶解在去离子水中,配成5 g·L-1的水溶液,即为转化液。每支试管装入5 mL转化液,121℃灭菌20 min。
酵母、蛋白胨,生化试剂,Oxoid;乙腈、甲醇,色谱纯,Dikma。
LC-20AT型高效液相色谱仪,日本岛津;Diamonsil C18柱,250 mm×4.6 mm×5 μm。
色谱条件:流动相为0.05 mol·L-1的醋酸钠∶乙腈(80∶20,体积比),流速1 mL·min-1,检测波长310 nm。
1.2 初筛
称取土壤样本各0.1 g,加入无菌水10 mL,摇匀后制成土壤样本菌悬液,取上清液5 mL,添加到以氯乙酸为唯一碳源的筛选培养基中,在30℃、220 r·min-1条件下振荡培养48 h。挑取培养液,在平板上划线分离,30℃温箱培养。将平板上生长的不同菌落挑取一环后接种到发酵培养基,在30℃、220 r·min-1条件下振荡培养48 h。将5 mL培养液离心分离得到菌体,加入转化液中,在30℃、220 r·min-1条件下振荡转化48 h。用硝酸银沉淀法初步检测是否有转化反应(出现浅黄色沉淀即表示可以转化β-溴对硝基苯乙醇)。
1.3 复筛
将菌种保存斜面上的初筛菌株挑取一环接种到装有5 mL发酵培养基的试管中,30℃、220 r·min-1培养48 h,转接到装有30 mL发酵培养基的三角瓶中,30℃、220 r·min-1培养48 h。将30 mL发酵液离心得到菌体,加入5 mL转化液转化12 h。用HPLC测定转化率。
1.4 菌株17#的液体培养与预处理
将菌种保存斜面上的菌株17#挑取一环接种到装有5 mL发酵培养基的大试管中,30℃、220 r·min-1培养48 h,转接到装有30 mL发酵培养基的三角瓶中,30℃、220 r·min-1培养48 h。将30 mL发酵液以12 000 r·min-1离心3 min,弃去上清液,用5 mL pH值7.0磷酸缓冲溶液清洗菌体,振荡,离心后弃去上清液,得到菌体。
1.5 完整细胞转化β-溴对硝基苯乙醇
将菌体加入到转化液中,振荡均匀,空白对照不加菌体。30℃、220 r·min-1转化12 h后,12 000 r·min-1离心3 min,取转化液用HPLC测定转化率。
1.6 分析测试
卤代醇脱卤酶催化β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯,会生成等摩尔的溴化氢,可以通过酚红分光光度法测定转化液中溴离子的浓度,从而确定酶活力。
酶活力单位定义为30℃、220 r·min-1的转化条件下,1 h内转化1 μgβ-溴对硝基苯乙醇所需的菌体干重为一个酶活力单位。
2 结果与讨论
2.1 菌种的筛选
以氯乙酸作为唯一碳源,从采集的土壤样本中筛选出73株可将β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯的菌株。利用硝酸银沉淀反应定性检测,得到具有不同转化能力的菌株共52株,利用HPLC测定转化率,从中挑选出转化率最高的菌株17#,进行后续实验。
2.2 培养条件的研究
2.2.1 碳源对酶活力及生物量的影响
选择浓度为2.5 g·L-1的蔗糖、可溶性淀粉、乳糖、葡萄糖、木糖、果糖替代发酵培养基中的蛋白胨,考察碳源对酶活力和生物量的影响,结果见表1。
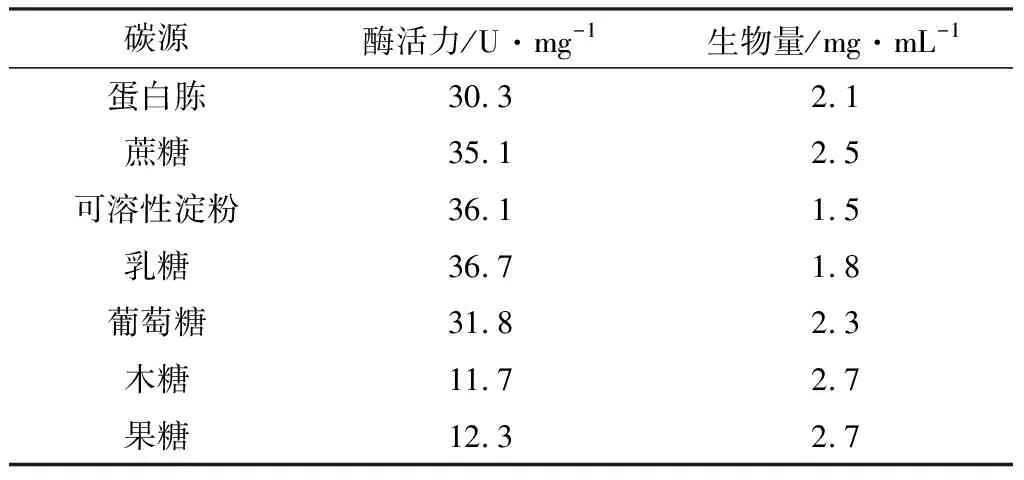
表1 碳源对酶活力和生物量的影响
由表1可知,不同的碳源对酶活和生物量的促进作用不同,以乳糖为碳源时,酶活最高,达到36.7 U·mg-1。因此,选择乳糖作为碳源。
2.2.2 乳糖浓度对酶活力及生物量的影响
以乳糖作为碳源,考察乳糖浓度对酶活力和生物量的影响,结果见表2。
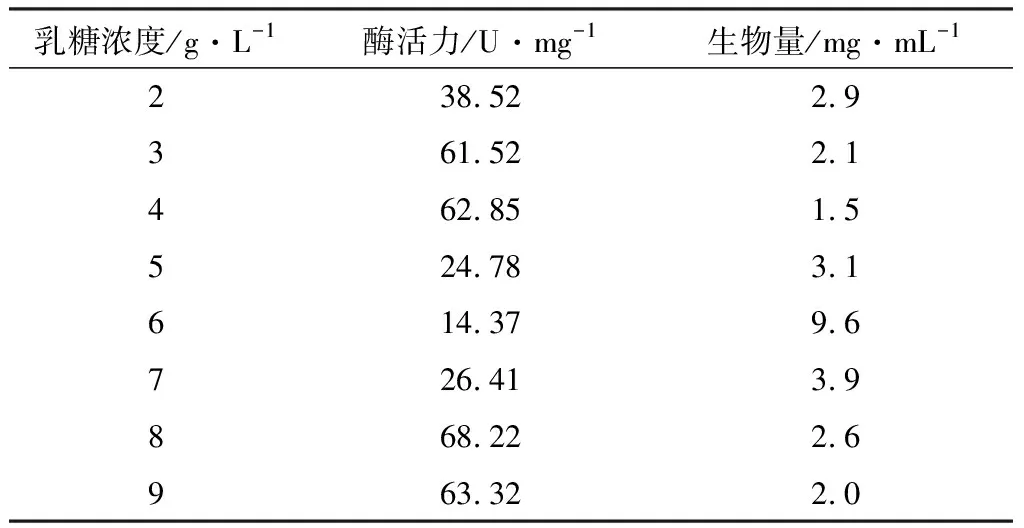
表2 乳糖浓度对酶活力和生物量的影响
由表2可知,当乳糖浓度为8 g·L-1时,酶活力达到最高,为68.22 U·mg-1。因此,选择发酵培养基中乳糖的浓度为8 g·L-1。
2.2.3 诱导物的浓度对酶活力及生物量的影响
由于诱导物氯乙酸酸性较强且有毒性,宜尽量选择较低的浓度。碳源为8 g·L-1的乳糖,考察诱导物氯乙酸的浓度对酶活力和生物量的影响,结果见表3。
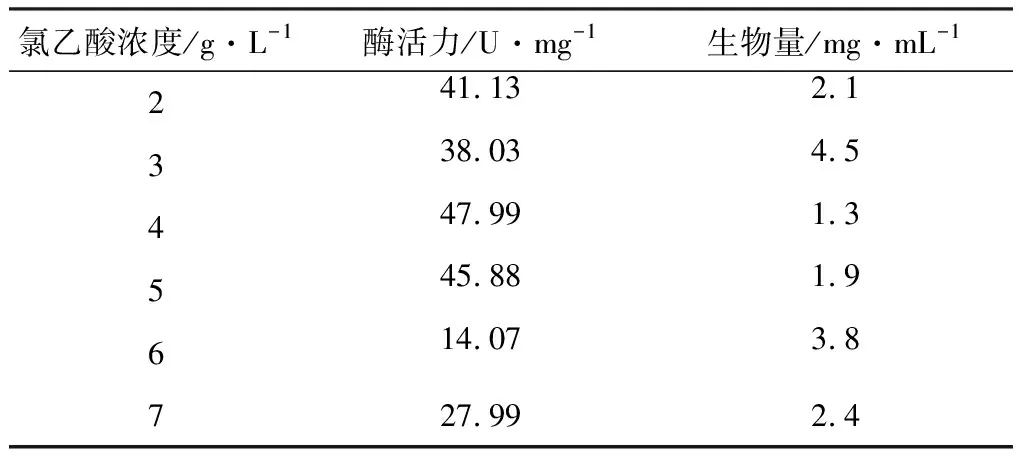
表3 诱导物浓度对酶活力和生物量的影响
由表3可知,氯乙酸的浓度为4 g·L-1时,酶活力达到最高,为47.99 U·mg-1。因此,选择诱导物浓度为4 g·L-1。
2.2.4 氮源对酶活力及生物量的影响
碳源为8 g·L-1的乳糖、诱导物浓度为4 g·L-1,选择浓度为5 g·L-1的蛋白胨、胰蛋白、硫酸铵、氯化铵代替发酵培养基中的酵母,考察氮源对酶活力和生物量的影响,结果见表4。
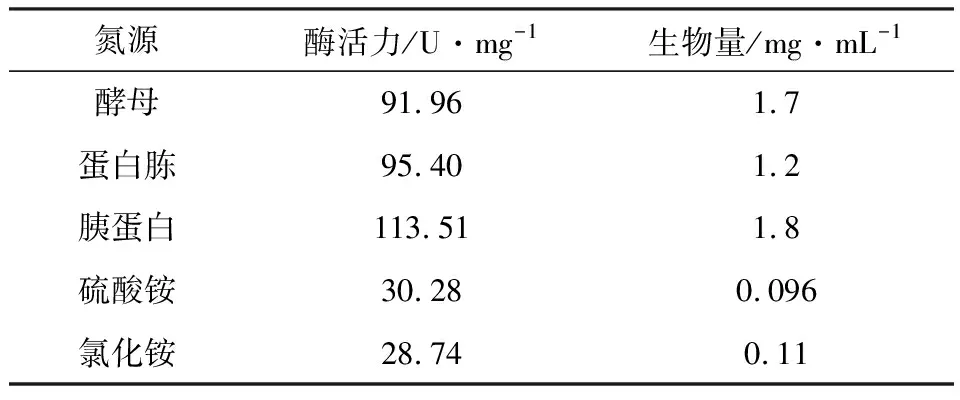
表4 氮源对酶活力和生物量的影响
由表4可知,以胰蛋白为氮源时,酶活力达到最高,为113.51 U·mg-1。因此,选择胰蛋白作为氮源。
2.2.5 胰蛋白浓度对酶活力及生物量的影响
碳源为8 g·L-1的乳糖,以胰蛋白作为氮源,考察氮源浓度对酶活力和生物量的影响,结果见表5。
由表5可知,胰蛋白浓度为6 g·L-1时,酶活力达到最高,为90.09 U·mg-1。因此,选择发酵培养基中胰蛋白浓度为6 g·L-1。
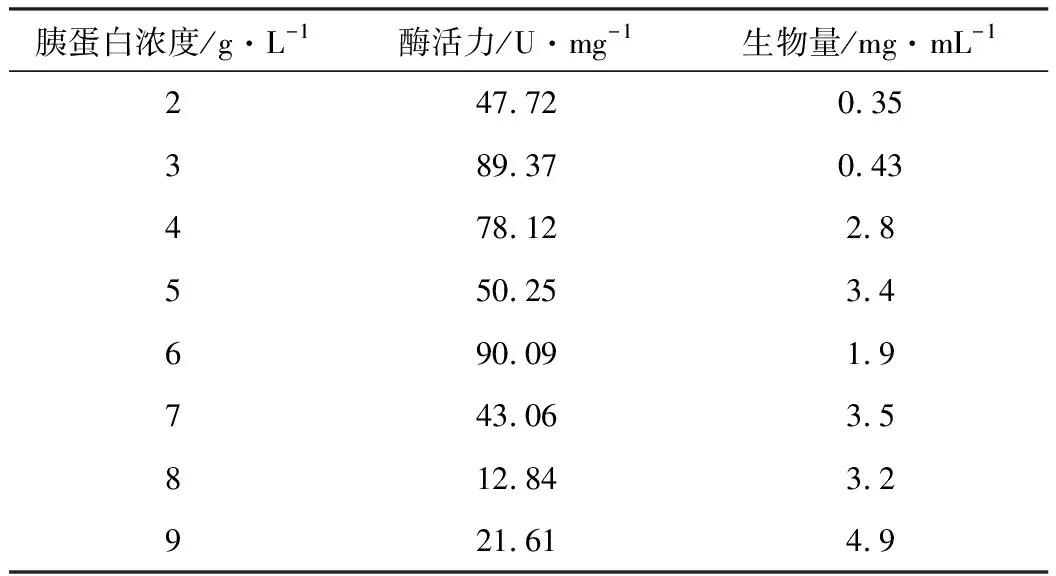
表5 胰蛋白浓度对酶活力和生物量的影响
2.2.6 金属离子对酶活力及生物量的影响
在培养基中分别添加浓度为1 mmol·L-1的不同金属离子,考察其对酶活力和生物量的影响,结果见表6。

表6 金属离子对酶活力和生物量的影响
由表6可知,除了Cu2+以外,其余金属离子对菌体的生长都有促进作用,可以显著提高酶活力;但是添加Cu2+时,酶活力反而下降。因此,培养基中不添加Cu2+。
2.2.7 初始pH值对酶活力及生物量的影响
考察发酵培养基初始pH值对酶活力和生物量的影响,结果见表7。
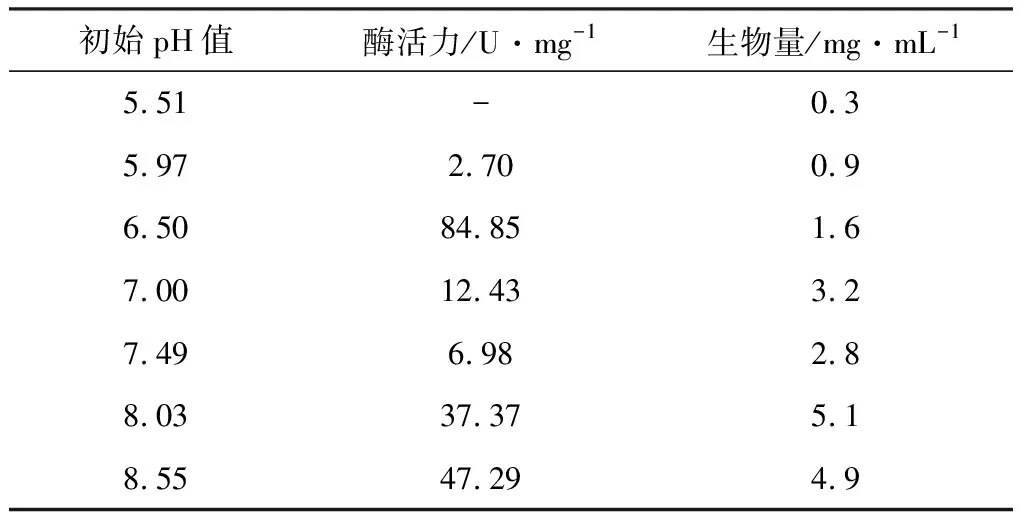
表7 初始pH值对酶活力和生物量的影响
由表7可知,当初始pH值为6.50时,酶活力达到最高,为84.85 U·mg-1。因此,选择培养基初始pH值为6.50。
2.2.8 培养温度对酶活力及生物量的影响
考察发酵温度对酶活力和生物量的影响,结果见表8。
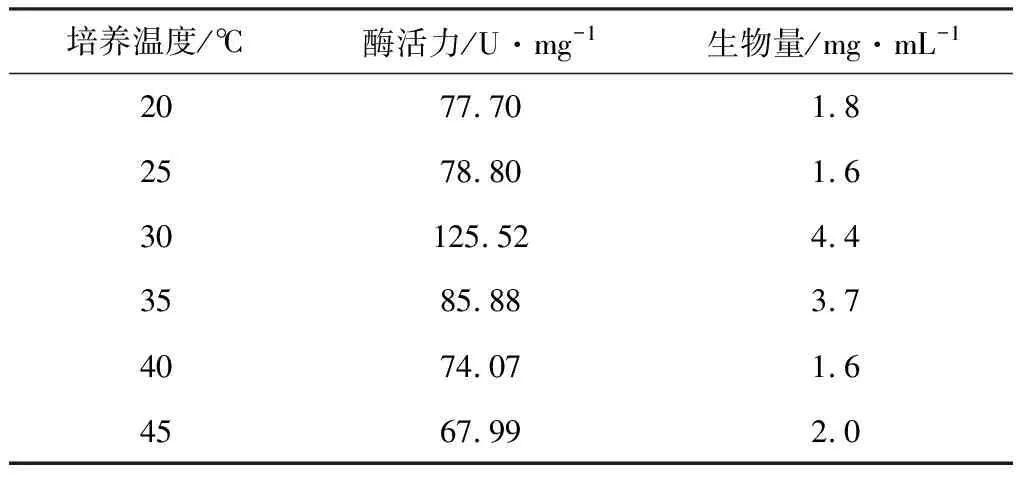
表8 培养温度对酶活力和生物量的影响
由表8可知,当培养温度为30℃时,酶活力达到最高,为125.52 U·mg-1。因此,选择培养温度为30℃。
2.2.9 培养时间对酶活力及生物量的影响
考察培养时间对酶活力和生物量的影响,结果见表9。
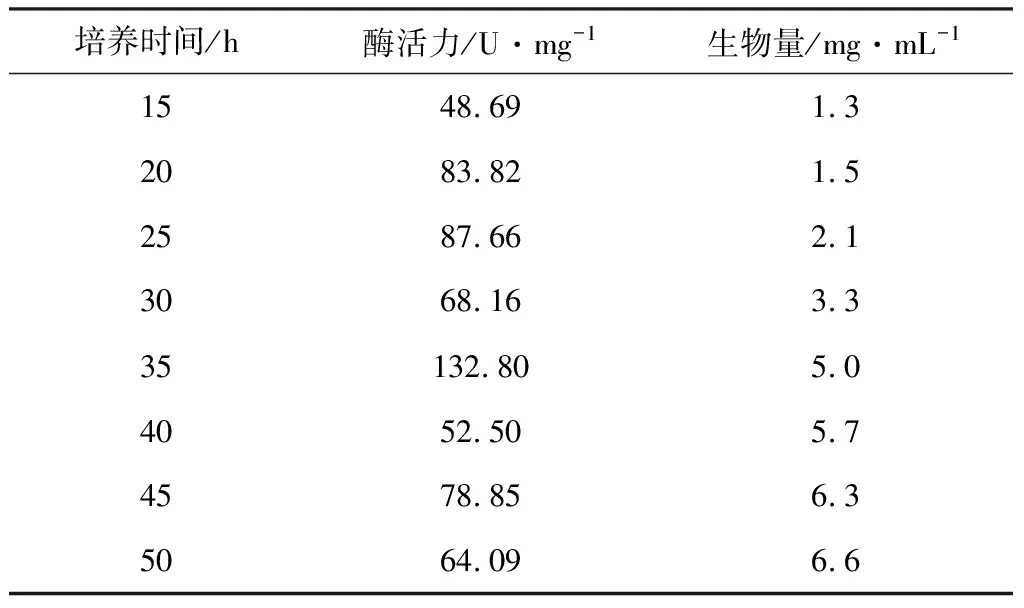
表9 培养时间对酶活力和生物量的影响
由表9可知,当培养时间为35 h时,酶活力达到最高,为132.80 U·mg-1。因此,选择培养时间为35 h。
2.3 转化条件的研究
2.3.1 转化温度对转化率的影响
考察转化温度对菌株17#转化效果的影响,结果见表10。
由表10可知,最适转化温度为35℃,此时转化率达到最高,为90.6%。
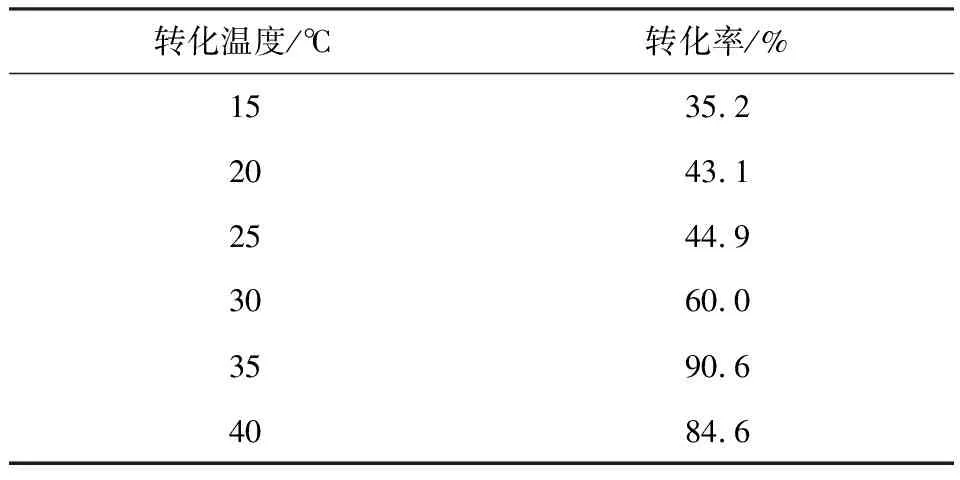
表10 转化温度对转化率的影响
2.3.2 转化时间对转化率的影响
考察转化时间对菌株17#转化效果的影响,结果见表11。

表11 转化时间对转化率的影响
由表11可知,最适转化时间为12 h,此时转化率虽然由于菌体批次不同的原因略有降低,但仍达87.4%。
3 结论
从土壤样本中筛选得到产脱卤酶菌株17#,可以将β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯。确定最适培养基组成(g·L-1)为:乳糖8,胰蛋白6,氯乙酸4,Na2HPO43.2,KH2PO41.5,MgSO498 mg,CaCl210 mg,FeSO41 mg,ZnSO40.1 mg,pH值6.50;最适培养条件为30℃培养35 h。最佳转化条件为35℃下转化β-溴对硝基苯乙醇12 h。菌株17#在最佳培养条件下,酶活力达到最高值132.80 U·mg-1。在最佳转化条件下的转化率最高为90.6%。菌株17#能高效地将β-溴对硝基苯乙醇转化为对硝基环氧苯乙烯,达到了筛选的目的。
参考文献:
[1] Spelberg J H L,Tang L X,Van Gelder M,et al.Exploration of the biocatalytic potential of a halohydrin dehalogenase using chromogenic substrates[J].Tetrahedron:Asymmetry,2002,13(10):1083-1089.
[2] Bras J L,蔡正艳.烯烃制备β-烷氧基醇的新方法[J].中国医药工业杂志,2006,37(8):549.
[3] 郝小燕,徐巧,李连友,等.水解动力学拆分外消旋环氧氯丙烷—手性单核Salen-Co(Ⅲ)络合物的制备[J].中国现代应用药学,2005,22(Z1):615-616.
[4] 史建俊,吴汝林,刘均洪.环氧化物生物催化转化的研究进展[J].化工技术与开发,2005,34(6):1-4.
[5] 王能强,吴坚平,王普,等.β-氯丙酸脱卤酶发酵条件研究[J].工业微生物,2007,37(1):57-61.
[6] 项炯华,吴坚平,王能强,等.2-氯丙酸脱卤酶产酶菌种的筛选及酶学性质研究[J].化学反应工程与工艺,2005,21(6):537-541.
[7] Bosma Tjibbe,Damborsky Jiri,Stucki Gerhard,et al.Biodegradation of 1,2,3-trichloropropane through directed evolution and heterologous expression of a haloalkane dehalogenase gene[J].Appl Environ Microbiol,2002,68(7):3582-3587.
[8] Lewandowicz A,Rudzinski J,Tronstas L,et al.Chlorine kinetic isotope effects on the haloalkane dehalogenase reaction[J].J Am Chem Soc,2001,123(19):4550-4555.
