阿魏酸与DNA相互作用的光谱电化学研究
2010-06-05项朋志,刘丽梅,郭英等
DNA是重要的生命遗传物质和遗传载体,小分子生物活性物质与DNA相互作用是生物化学研究的前沿领域之一[1,2],研究DNA与小分子之间的相互作用有助于深刻理解DNA与识别分子或药物分子的作用机理,对了解药物的作用机理,进而通过分子设计寻找有效的治疗药物等具有重要意义。凝胶电泳、印迹技术、紫外可见光谱、荧光光谱、原子力显微镜等已广泛应用于这项研究[1~4]。电化学方法[5~8]也越来越多地用于研究电氧化还原物质如抗癌物质与DNA的相互作用。
阿魏酸 (4-羟基-3-甲氧基肉桂酸,Ferulic acid) 是一种植物多酚,普遍存在于中药材中,具有抑制血小板聚集、抗血栓形成、抗氧化和自由基、调节免疫功能、利肝保湿等药理作用[9~11]。近年来,有关阿魏酸及其衍生物抑制DNA氧化损伤以及结肠癌、直肠癌和舌癌的报道不断增加[12~14],其结构如图1所示。
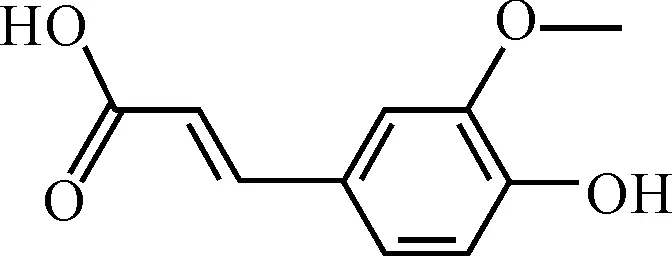
图1 阿魏酸的结构式
作者利用多壁碳纳米管(MWNT)修饰玻碳电极(MWNT/GCE)研究了阿魏酸与DNA的相互作用,对二者之间的作用机理进行研究,拟为深入了解阿魏酸类药物的生物活性提供实验依据。
1 实验
1.1 试剂与仪器
阿魏酸溶液的配制:用二次蒸馏水配制成1.00×10-3mol·L-1的储备液,4℃以下贮存。
小牛胸腺DNA(Sigma)储备液:用二次蒸馏水配制成8 μg·mg-1的储备液,4℃以下贮存(小牛胸腺DNA简写为DNA)。
B-R缓冲溶液的配制[15]:在100 mL混合液[3.92 mg·L-1H3PO4(2.71 mL·L-185%正磷酸)、2.40 g 乙酸(2.36 mL·L-1冰醋酸)、2.47 g·L-1H3BO3]中,加入0.2 mol·L-1的NaOH溶液40.0 mL,调节pH值为5.72。
其它试剂均为分析纯或优级纯;二次蒸馏水。
三电极体系:工作电极为玻碳电极(GCE),参比电极为饱和甘汞电极(SCE),对电极为铂电极;MEC-12B型多功能电化学分析系统(江苏江分电分析仪器有限公司);AS3120A型超声波清洗器;pH-213型酸度计。
1.2 MWNT/GCE的制备
MWNT/GCE的制备参考文献[16],将MWNT在浓HCl中超声7.5 h进行纯化,纯化后的MWNT加浓HNO3在140℃下回流8 h,水洗至中性,在100℃烘干研成粉末。经浓HNO3回流处理后的MWNT,在打开其端口的同时,引入羧基和羟基官能团。
称取功能化的MWNT粉末10.0 mg,超声分散于10 mL水中,形成黑色悬浊液备用。玻碳电极先用0.05 μm Al2O3抛光粉抛光成镜面,然后分别在无水乙醇和二次水中超声清洗5 min。用微量进样器取4 μL悬浊液滴加在玻碳电极表面,红外灯下烘干,即得MWNT/GCE。
1.3 DNA的变性处理
DNA变性处理参考文献[17],将8.0 μg·mg-1DNA置于70~100℃的水浴中约30 min,然后迅速置于冰浴中冷却,双链DNA (dsDNA)即解链变性为单链DNA(ssDNA)。
1.4 方法
在10 mL比色管中依次加入pH = 5.72的0.04 mol·L-1B-R缓冲溶液5 mL、1.00×10-3mol·L-1阿魏酸溶液3.0 mL、一定量的dsDNA或ssDNA,定容至10 mL,摇匀,静置一定时间。采用三电极系统,以0.10 V·s-1的扫描速度在0.8~0.0 V范围进行循环伏安分析。
2 结果与讨论
2.1 阿魏酸和dsDNA相互作用的电化学行为
图2是在pH=5.72的0.04 mol·L-1B-R缓冲溶液中,阿魏酸与dsDNA作用前后在MWNT/GCE电极上的循环伏安图。

a.dsDNA b.阿魏酸+dsDNA c.阿魏酸
从图2可知,含有8 μg·mg-1dsDNA的溶液在0.8~0.0 V范围内没有氧化还原峰产生;含有1.00×10-3mol·L-1阿魏酸的溶液在+0.36 V和+0.23 V产生氧化还原峰,峰电位差为13 mV,峰电流比ipa/ipc=0.872,表明阿魏酸电极过程为准可逆。
在阿魏酸中加入dsDNA溶液后,Epc正移,Epa=+0.40 V,Epc=+0.15 V,△Ep为25 mV;峰电流ip显著下降,表明阿魏酸与dsDNA相互作用时形成电活性较低的复合物。根据峰电位的位移可判断阿魏酸与dsDNA相互作用模式[18],峰电位正移、峰电流下降,推测阿魏酸与dsDNA相互作用以嵌插作用为主。
为了进一步探讨阿魏酸与DNA的作用机理,将8.0 μg·mg-1dsDNA和8.0 μg·mg-1ssDNA分别与3.0×10-4mol·L-1阿魏酸相互作用,结果见图3。
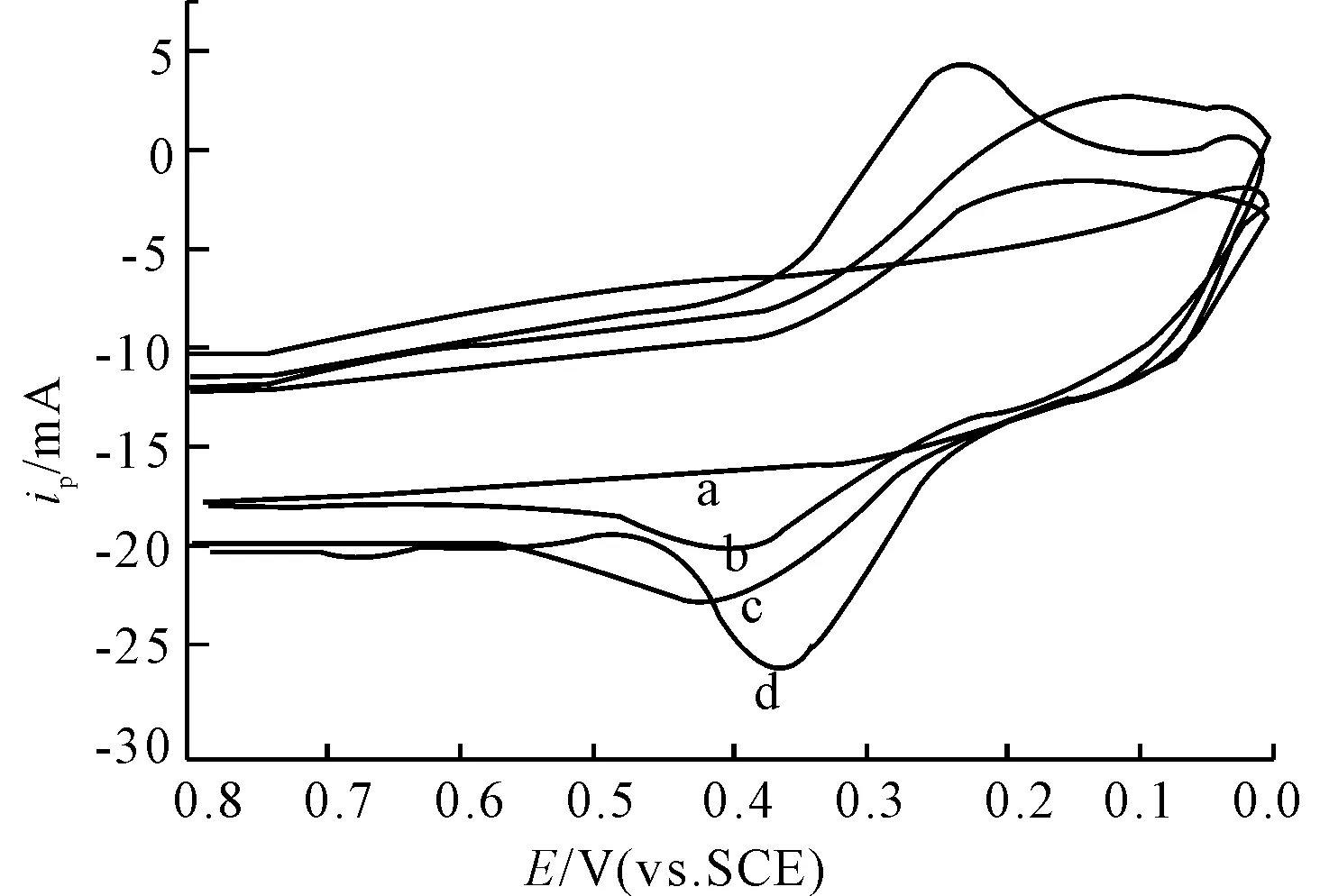
a.dsDNA b.阿魏酸+dsDNA c.阿魏酸+ssDNA d.阿魏酸
从图3可知,dsDNA和ssDNA均使阿魏酸的峰电流降低。但是dsDNA氧化峰电位右移明显高于ssDNA,且峰电流降低更明显,这是因为阿魏酸可以平面芳香环嵌插到dsDNA的双螺旋结构中,电活性降低,而ssDNA不具备双螺旋结构,其峰电流降低和氧化峰电位正移的原因可能是静电作用所致。
2.2 DNA与阿魏酸相互作用的紫外吸收光谱
阿魏酸和dsDNA相互作用前后的紫外吸收光谱图见图4。

a.dsDNA b.阿魏酸 c~e.阿魏酸+dsDNA
从图4可知,阿魏酸在310 nm处有特征吸收峰,dsDNA在260 nm 处有最大吸收。在加入dsDNA后,阿魏酸在310 nm处的吸收峰降低,呈减色效应,且出现两个等电吸收点。鉴于dsDNA在310 nm处几乎没有吸收,因此阿魏酸在310 nm处的吸收变化是与dsDNA作用所致,减色效应及两个等电吸收点是嵌插作用的结果[19]。吸收光谱进一步说明阿魏酸与DNA的相互作用以嵌插作用为主。
2.3 相互作用电子转移系数α和表观电子传递速率常数ks的测定
电子转移系数α是电极反应能量势垒对称性的量度,对于准可逆体系,根据Laviron理论,应遵循关系式(1)[20,21]:
(1)
式中:Epc为还原峰电位;α为电子转移系数;n为实际电子转移系数;k为常数;R为气体常数;F为法拉弟常数;v为扫描速度,V·s-1。
电子转移系数α可由Epc~lgv关系曲线的直线斜率求得,还原峰电位Epc和v的常用对数lgv关系曲线的直线斜率应为-2.303RT/αnF。依相关数据求得-2.303RT/αnF为-0.2204。由此得αn=0.27,则n=1时,α=0.27。
表观电子传递速率常数ks可由式(2)[20,21]求得:
(2)
式中:ΔEp为还原峰电位与氧化峰电位的差值。由式(2)求得ks=0.17 s-1,阿魏酸与dsDNA作用前后的电化学参数变化见表1。
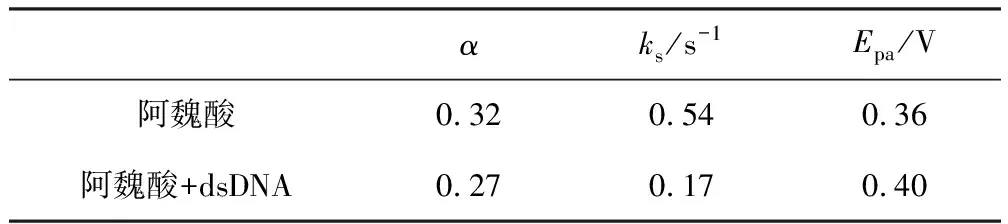
表1 阿魏酸与dsDNA作用前后的电化学参数变化
由表1可见,3.0×10-4mol·L-1阿魏酸与8.0 μg·mg-1dsDNA作用后,α、ks值有所下降,说明阿魏酸与DNA的复合物是非电活性的,可能的原因是阿魏酸嵌插到dsDNA的双螺旋结构中,电活性点被屏蔽,导致电子转移和传递能力降低。
2.4 相互作用的结合常数β和结合数m
根据参考文献[20,21]计算阿魏酸与DNA相互作用的结合常数β和结合数m。
假定阿魏酸(用A表示)和DNA只形成一种简单的复合物dsDNA-mA,则反应式和结合常数如下:
dsDNA+mA→dsDNA-mA
(3)
式中:cA0为阿魏酸的初始浓度。经推导可得式(4):
(4)
式中:Δipa,max为加入dsDNA前后Δipa的最大值。
综上可知,阿魏酸和DNA之间由于阿魏酸嵌入DNA的碱基对间形成了DNA-阿魏酸的简单缔合物,即1 mol DNA碱基对结合了1 mol的阿魏酸分子。
3 结论
在pH=5.72的B-R缓冲溶液中,阿魏酸和DNA发生嵌插作用形成非电活性的分子化合物DNA-阿魏酸。通过比较电子转移系数α和表观电子传递速率常数ks的变化,可从理论上说明阿魏酸和DNA发生相互作用;通过紫外吸收光谱分析对二者的嵌插作用进行了验证。求得阿魏酸和DNA嵌插作用的结合常数β为1.01×104,结合数m≈1。
参考文献:
[1] Zhou C F,Du X H,Li H.Studies of interactions among cobalt(Ⅲ) polypyridyl complexes,6-mercaptopurine and DNA[J].Bioelectrochemistry,2007,70(2):446-451.
[2] Alemán C,Teixeira-Dias B,Zanuy D,et al.A comprehensive study of the interactions between DNA and poly(3,4-ethylenedioxythiophene)[J].Polymer,2009,50(8,9):1965-1974.
[3] Long Y F,Huang C Z.Spectral studies on the interaction of Amido black 10B with DNA in the presence of cetyltrimethylammonium bromide[J].Talanta,2007,71(5):1939-1943.
[4] Zhou Y L,Li Y Z.Studies of the interaction between poly(diallyldimethyl ammonium chloride) and DNA by spectroscopic methods[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2004,233(1-3):129-135.
[6] Li Y Q,Guo Y J,Li X F,et al.Electrochemical studies of the interaction of Basic Brown G with DNA and determination of DNA[J].Talanta,2007,71(1):123-128.
[7] Kang J W,Li Z F,Lu X Q.Electrochemical study on the behavior of morin and its interaction with DNA[J].Journal of Pharmaceutical and Biomedical Analysis,2006,40(5):1166-1171.
[8] Radi A,El Ries M A,Kandil S.Electrochemical study of the interaction of levofloxacin with DNA[J].Analytica Chimica Acta,2003,495(1-2):61-67.
[9] Zhao Z H,Moghadasian M H.Chemistry,natural sources,dietary intake and pharmacokinetic properties of ferulic acid:A review[J].Food Chemistry,2008,109(4):691-702.
[10] Graf E.Antioxidant potential of ferulic acid[J].Free Radical Biology and Medicine,1992,13(4):435-448.
[11] Itagaki S,Kurokawa T,Nakata C,et al.Invitroandinvivoantioxidant properties of ferulic acid:A comparative study with other natural oxidation inhibitors[J].Food Chemistry,2009,114(14):466-471.
[12] Sudheer A R,Muthukumaran S,Kalpana C,et al.Protective effect of ferulic acid on nicotine-induced DNA damage and cellular changes in cultured rat peripheral blood lymphocytes:A comparison withN-acetylcysteine[J].Toxicology in Vitro,2007,21(4):576-585.
[13] Murakami A,Nakamura Y,Koshimizu K,et al.FA15,a hydrophobic derivative of ferulic acid,suppresses inflammatory responses and skin tumor promotion:Comparison with ferulic acid[J].Cancer Letters,2002,180(2):121-129.
[14] Alias L M,Manoharan S,Vellaichamy L,et al.Protective effect of ferulic acid on 7,12-dimethylbenz[a]anthracene-induced skin carcinogenesis in Swiss albino mice[J].Experimental and Toxicologic Pathology,2009,61(3):205-214.
[15] 印永嘉.大学化学手册[M].济南:山东科学技术出版社,1985:353-356.
[16] 郭英,贝玉祥,高云涛,等.灯盏花素在多壁碳纳米管修饰玻碳电极上的电化学行为及其测定[J].药物分析杂志,2009,29(7):1130-1133.
[17] 蔡怀鸿,杨培慧,蔡继业.青蒿素与DNA作用的电化学机理[J].应用化学,2007,24(4):411-414.
[18] Carter M T,Rodriguez M,Bard A J.Voltammetric studies of the interaction of metal chelates with DNA.2.Tris-chelated complexes of cobalt(Ⅲ) and iron(Ⅱ) with 1,10-phenanthroline and 2,2′-bipyridine[J].J Am Chem Soc,1989,111(24):8901-8911.
[19] Long E C,Barton J K.On demonstrating DNA intercalation[J].Accounts of Chemical Research,1990,(9):271-273.
[20] Laviron E.General expression of the linear potential sweep voltammogram in the case of diffusionless electrochemical systems[J].J Electroanal Chem,1979,101(1):19-28.
[21] Jiao K,Li Q J,Sun W,et al.Studies on the recognition interaction of rhodamine B and DNA by voltammetry[J].Chem Res Chin Univ,2005,21(2):145-148.
