血管组织细胞抽提物体外调控间质干细胞向内皮细胞分化的研究
2010-05-31潘侃达
潘侃达
骨髓间充质干细胞(mesenchymal stem cells,MSCs)在适宜的诱导条件下能够分化成为多种间质组织,包括骨、脂肪、软骨、心肌和骨骼肌细胞, 甚至还有神经元、星形胶质细胞等[1-2]。越来越多的研究表明,干细胞所处的微环境对干细胞的分化与表型变化有着十分重要的影响,而这个微环境主要是由干细胞周围的成体细胞所产生。大量胚胎学研究[3-4]结果表明造血系统祖细胞与血管内皮细胞来源于共同的干细胞——间充质干细胞,因此本论文拟通过研究血管组织抽提物对MSC分化的影响,证明血管内皮细胞是否含有对MSC分化命运决定的物质组份。
1 材料和方法
1.1 材料
SD大鼠(浙江医学科学院动物中心)、胎牛血清(杭州四季青生物技术有限公司)、DMEM培养基(Gibco,含1.0g/L葡萄糖)、青霉素-链霉素双抗(Hyclone)、淋巴细胞分离液(Gibco)、混合型胶原酶和胰蛋白酶(Gibco)、蛋白酶抑制剂(Amresco)、TrizolReagent(Invitrogen)、Taq DNA polymerase(Promega),dNTPs(Promega)、M-MLV Reverse transcriptase(Invitrogen)、琼脂粉、琼脂糖、DNA marker(BBI)、DEPC(上海生物工程有限公司)。
1.2 大鼠MSCs的分离培养
戊巴比妥钠(50mg/kg体重)腹腔注射麻醉SD大鼠,无菌操作剥离股骨、胫骨,剪去两端干骺端以显露骨髓腔。然后,以5mL含20%肝素的基础培养液(10%胎牛血清和100U/mL青/链霉素的DMEM)反复冲洗骨髓腔,制成细胞混悬液。将细胞混悬液加入装有等体积淋巴细胞分离液的离心管上层,600g离心20min,液体分成4层,收集中间交界面处乳白色的单个核细胞层,加入基础培养液,并将其最终体积调为6mL,400g离心5min,弃去上清液,加入基础培养液制备单个核细胞悬液并计数。将单个核细胞以1×105cells/ml细胞密度接种于培养瓶,置37℃、5%CO2培养箱中培养,24h后吸出未贴壁细胞悬液重新培养,培养基每3天换液1次,2周后待贴壁细胞达90%融合时以0.125%胰酶消化,按1:3传代,定期取生长状态细胞进行倒置相差显微镜观察。
1.3 血管组织细胞抽提物制备
无菌环境下取新鲜血管组织,用PBS冲洗三次,彻底去除表面附着物。然后剪碎,并在混合型胶原酶(0.5%),37℃温浴下消化6h;离心去掉上清,用胰酶(0.25%)再消化过夜;离心收集细胞沉淀,使用含蛋白酶抑制剂(1:100)细胞裂解液含重悬细胞,超声破碎裂解细胞,然后4℃,14,000g离心15min,重复两次。最后,将收集到的血管组织上清液在无菌条件下通过0.22um滤器过滤, 4℃冰箱保存待用。
1.4 大鼠MSCs的诱导分化
将第四代MSCs加入不同的诱导分化培养液进行诱导分化,间隔2~3d换液1次,诱导培养7~14天。诱导分化培养液分别为:基础培养液+基础培养液(实验组1,体积数与其他两组相等)、基础培养液+热处理血管组织上清液(实验组2,煮沸15min后置冰浴立即冷却)、基础培养液+血管组织上清液(实验组3)。另外,以相同条件培养原代血管内皮细胞作为阳性对照,进行特异性基因表达分析。当细胞培养融合成单层, 待细胞长满瓶底的80%时用0.125%的胰酶消化, 进行传代培养。
1.5 细胞分化鉴定
RT-PCR(Reverse transcription-polymerase chain reaction, RT-PCR)作为一种有效地检测基因表达的方法被广泛应用。本论文采用该方法从mRNA水平检测内皮细胞特异性基因是否表达,从而判断MSCs是否向血管内皮细胞发生分化。本论文所采用的引物序列见表1。扩增条件按照正常PCR进行。

表1 内皮细胞特征性基因检测特异性引物Table 1 The primers of the specific genes in the endothelial cells
2 研究结果
2.1 大鼠MSCs表面形态学及表面抗原检测
倒置显微镜下观察传代培养的大鼠MSCs呈扁平状或多角形,生长旺盛时呈旋涡样。随着细胞密度的增加,胞体变得细长,形态类似成纤维细胞(见图1A)。传代至第四代(Progenitor 4,P4)后,使用流式细胞仪分析细胞表面标志物表达,结果表明MSC表面抗原细胞CD73、CD90表达阳性,而CD34为阴性表达,说明P4代的细胞呈比较“纯化”的MSC(见图1B)。
2.2 诱导分化后细胞表面形态学观察
诱导培养后,三个实验组的细胞表面形态基本没有发生显著变化,均生长旺盛。但是,随着传代次数的增加,扁平细胞增加,细胞呈现衰老状态。
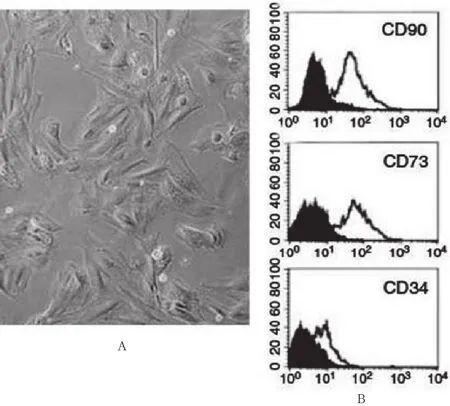
图1 大鼠MSCs表面形态学观察以及细胞表面抗原检测
2.3 诱导分化后内皮细胞特征性基因表达检测
取诱导分化培养后2周细胞,分别提取RNA,并采用RTPCR检测内皮细胞特征性基因表达情况,结果表明添加血管组织上清液的诱导实验组与原代培养内皮细胞内,均能检测到CD31、CD33、CD144以及一氧化氮合酶(endothelial nitric oxide synthase, eNOS)的表达,而未加血管组织上清液的诱导实验组和添加热处理血管组织上清液的诱导实验组内均无相关基因表达或表达量很低(见图2)。
3 讨论

图2 MSCs诱导分化后内皮细胞特征性基因表达检测
组织工程是近年来发展的热点,间充质干细胞是目前最常用的种子细胞。许多研究[5-7]表明骨髓来源的间充质干细胞(mesenchymal stem cells,MSCs)能在局部微环境影响下重新编程,在体外定向分化为不同类型的细胞,如成骨细胞、成纤维细胞、软骨细胞、脂肪细胞、肌肉细胞和内皮细胞等。这些结果表明细胞外基质成份对干细胞的命运具有决定性作用。但是,本研究通过在含内皮细胞抽提物的诱导培养液中培养间充质干细胞,使其在培养两周后表达内皮细胞特异性标志物,证明MSCs的分化方向不仅与细胞外基质环境密切相关,而且也受所处环境成体细胞内诱导因子的影响,分离鉴别这些诱导因子,对于间充质干细胞进一步在临床上的运用具有重要的意义。
细胞表面分子是多种细胞分化和定型的标志。一般认为,MSCs不表达分化相关的标志,如Ⅰ、Ⅱ、Ⅲ型胶原或碱性磷酸酶等,在细胞贴壁附着后,细胞均一致表达CD44、CD73、CD90、CD105、CD120a和CD124等多种表面蛋白[8-9]。但目前对MSCs表面特异性标志物的认识,尚存在不同观点。本实验选择CD90、CD73作为MSCs的特征性表面分子进行细胞鉴定。
血管内皮细胞普遍公认的特异性标志物包括CD31、CD34、CD144以及一氧化氮合酶等[10-11]。本研究通过胶原酶与胰酶的处理,彻底去除细胞外基质成份。然后裂解内皮细胞使其内容物外露,从而可以直接与间充质干细胞结合,成功地诱导其分化为可表达血管内皮细胞特征性标志物的细胞,验证了MSCs的多向分化潜能,也说明干细胞的分化机制和诱导条件很复杂,可受到很多因素的影响。此外,在图2中,可以看出热处理血管组织上清液诱导MSCs分化培养后,CD31和CD34也有痕量表达,这可能是由于血管组织抽提物内含有非蛋白质诱导因子或者是蛋白因子变性不彻底,从而使MSCs发生部分分化造成的。
总之,利用BMSCs可诱导出具有血管内皮细胞特性的细胞,该细胞可在体外继续培养扩增,可作为构建组织工程化血管的种子细胞。
[1]Satija NK,Singh VK,Verma YK,et al.Mesenchymal Stem Cell-based Therapy:A New Paradigm in Regenerative Medicine[J].J Cell Mol Med,2009 Jul 10.[Epub ahead of print].
[2]裴瑛波.骨髓间充质干细胞分离培养和定向分化的研究现状[J].中国组织工程研究与临床康复,2009,13(13):2775-2778.
[3]Hirashima M,Kataoka H,Nishikawa S,et al.Maturation of embryonic stem cells into endothelial cells in an in vitro model of vasculogenesis[J].Blood,1999,93(4):1253-1263.
[4]Young PP,Vaughan DE,Hatzopoulos AK.Biologic properties of endothelial progenitor cells and their potential for cell therapy[J].Prog Cardiovasc Dis,2007,49(6):421-429.
[5]Lozito TP,Taboas JM,Kuo CK,et al.Mesenchymal stem cell modification of endothelial matrix regulates their vascular differentiation[J].J Cell Biochem,2009,107(4):706-713.
[6]Oswald J,Boxberger S,J rgensen B,et al.Mesenchymal stem cells can be differentiated into endothelial cells in vitro[J].Stem Cells,2004,22(3):377-384.
[7]郭尚春,陈欣,袁霆,等.诱导人骨髓间充质干细胞向成骨细胞和内皮细胞分化[J].上海交通大学学报(医学版),2009,29:154-157.
[8]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[9]Turnovcova K,Ruzickova K,Vanecek V,et al.Properties and growth of human bone marrow mesenchymal stromal cells cultivated in different media[J].Cytotherapy,2009,25:1-12.
[10]Hristov M,Schmitz S,Schuhmann C,et al.An optimized flow cytometry protocol for analysis of angiogenic monocytes and endothelial progenitor cells in peripheral blood[J].Cytometry A,2009,75A(10):848-853.
[11]晏开力,汪健,李庆,等.成人骨髓间充质干细胞分化为血管内皮细胞的研究[J].中国修复重建外科杂志,2007,21(1):76-80.
