猪IL-2和IL-6的原核表达及多克隆抗体的制备*
2010-05-31甄洪花沈志强王金良
甄洪花,沈志强,单 虎,王金良
(1.青岛农业大学动物科技学院,山东青岛 266109;2.山东省滨州畜牧兽医研究院,山东滨州 256600)
猪IL-2和IL-6的原核表达及多克隆抗体的制备*
甄洪花1,沈志强2*,单 虎1,王金良2
(1.青岛农业大学动物科技学院,山东青岛 266109;2.山东省滨州畜牧兽医研究院,山东滨州 256600)
IL-2和IL-6是机体重要的免疫调节因子,在佐剂的应用方面具有很好的发展前景。论文以pTIL-2和pTIL-6为模板进行PCR扩增得到猪白细胞介素2(pIL-2)和猪白细胞介素6(pIL-6)的全基因序列,通过EcoRⅠ和HindⅢ双酶切及连接反应将目的基因亚克隆到原核表达载体pET30a中构建了融合表达质粒pETIL-2和pET IL-6。将重组质粒分别转化大肠埃希菌BL21(DE3)和 Rosetta(DE3),37℃在IPTG诱导下高效表达了pIL-2和pIL-6,分子质量分别约为26 ku和30 ku。将包涵体纯化并复性后免疫家兔,制备的兔抗pIL-2和pIL-6的多克隆抗体经ELISA检测效价在1∶12 800以上。
猪白细胞介素2;猪白细胞介素6;原核表达;多克隆抗体
白细胞介素(interleukin,IL)是由免疫细胞和某些非免疫细胞经刺激后转录表达和分泌的一类小分子多肽或糖蛋白的生物活性物质,是机体内重要的细胞因子之一。其在体内能激活和调节免疫活性细胞,对免疫应答的产生和调节具有重要作用。白细胞介素2(IL-2)和白细胞介素6(IL-6)是机体重要的免疫调节因子,具有多种生物学活性。IL-2属于Thl细胞因子,能刺激T细胞和B细胞生长增殖,激活T细胞分泌 IFN,增强CTL、自然杀伤细胞、巨噬细胞的细胞毒活性,诱导HK、肿瘤浸润淋巴细胞的抗肿瘤活性和抗感染活性,主要发挥细胞免疫功能。IL-6属于Th2细胞因子,可诱导B细胞增殖分化并产生抗体,主要作用于成熟的B细胞,产生免疫球蛋白IgM 、IgG、IgA,主要发挥体液免疫功能,也可以促进PHA或刀豆球蛋白A激活的T细胞增殖生长。两者在免疫应答系统中相辅相成,在分别刺激细胞与体液免疫的同时也能相互诱导对方而开启另一支路[1-3],IL-2与IL-6的这种协同作用有可能成为一种能够平衡Thl和Th2应答的新型、高效的免疫增强剂。但天然动物机体内细胞因子含量低,且机体组织与体液成分错综复杂,分离纯化过程繁琐费时。已有研究证明,猪IL-2和IL-6基因在大肠埃希菌中表达出的融合蛋白具有一定生物活性[4-6],且同一种物种的白细胞介素具有极高的保守性[7],本试验采用基因工程方法构建了猪IL-2和IL-6的原核表达载体,分别转化大肠埃希菌BL21(DE3)和Rosetta(DE3)进行了表达,其后提取包涵体,纯化复性后免疫家兔制备了兔抗猪IL-2、IL-6的多克隆抗体,为进一步研究这两种细胞因子的结构、生物学功能及今后的产业化应用奠定基础。
1 材料与方法
1.1 材料
各种限制酶及T4 DNA连接酶、PCR相关试剂、DNA Marker、UNIT-10柱式DNA胶回收试剂盒均为宝生物工程(大连)有限公司产品;质粒提取试剂盒为上海生工生物工程技术服务有限公司产品;葡萄球菌A蛋白购自武汉博士德生物工程有限公司;DAB显色试剂盒购自北京中杉金桥公司;受体菌E.coliDH5α及表达菌E.coliBL21(DE3)和Rosetta(DE3)、表达载体pET30a均为山东省滨州畜牧兽医研究院实验室保存;pTIL-2和pT IL-6为山东省滨州畜牧兽医研究院王金良研究员构建保存。其他试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物的设计与合成 根据pTIL-2和pTIL-6的基因序列,用Primer 5.0软件设计合成了特异性引物 P21 和 P22,P61 和 P62,P21:5′-CTGGAATTCGACGATTCAATGTATAAGAT -3′(EcoRⅠ),P2 2:5′-AGTAAGCTTCCCGGGGATCCTCT -3′(HindⅢ);P61:5′-CGGGAATTCGCTATGAACTCC CTC-3′(EcoRⅠ);P62:5′-TAGAAGCTTGTGCCCCAGC-TACATTAT-3′(HindⅢ),引物由上海生工生物工程技术服务有限公司合成。
1.2.2 猪IL-2、IL-6基因的PCR扩增、克隆及序列测定 以含有IL-2和IL-6基因的质粒pT IL-2和pTIL-6为模板进行PCR 反应,反应体系(50 μ L)如下 :10 ×PCR buffer 5 μ L,引 物 (10 μ mol/L)各2 μ L,dNTPs(2.5 mmol/L)2 μ L,rTaqDNA 聚合酶1 μ L。PCR反应条件为:94 ℃预变性5 min;94℃40 s,56℃35 s,72℃40 s,35个循环;72℃再延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳分析。将目的基因与pMD18T载体连接后(分别命名为pMDIL-2和pMDIL-6)送上海生工生物工程技术服务有限公司进行测序。
1.2.3 原核表达载体的构建与鉴定 用EcoRⅠ和HindⅢ同时分别双酶切 pMDIL-2、pMDIL-6和pET30a,然后回收目的片段和载体片段,用T4连接酶连接进行定向克隆,构建原核表达载体pETIL-2和pETIL-6,PCR和酶切方法进行鉴定。
1.2.4 重组质粒pETIL-2和pETIL-6的诱导表达及鉴定 将构建正确的重组质粒pETIL-2、pETIL-6转入表达菌BL21(DE3)和Rosetta(DE3)中,挑选单菌落接种于1 mL含卡那霉素(50 μ g/mL)的LB培养液,37℃震荡培养过夜,取过夜培养物以1∶50~1∶100的比例接入新的含卡那霉素(50 μ g/mL)的LB培养液中,37℃震荡培养至对数中期(OD600=0.4~0.6),加 IPTG(终浓度为 1 mmol/L)诱导2 h~6 h,离心收集菌体进行 SDS-PAGE和Western bolt分析鉴定目的蛋白的表达情况(以诱导前的菌体为对照)。
1.2.5 重组蛋白包涵体的提取、纯化 将大量诱导的表达菌(150 mL)离心收集菌体,用10 mmol/L TE缓冲液(pH 8.0)洗菌体一次,除去残留培养基成分,再用10 mmol/L TE缓冲液(pH 8.0,内含200 μ g/mL溶菌酶)重悬菌体,置37℃温浴1 h后,加DT T与T riton X-100至终浓度分别达5 mmol/L与10 mL/L。然后进行高频短时超声波处理数次。再4℃,12 000 r/min离心10 min后,分别收集上清与沉淀进行120 g/L的SDS-PAGE电泳,鉴定重组蛋白是可溶形式还是以包涵体形式存在。依据SDS-PAGE结果,将重组包涵体溶解于8 mol/L的尿素中,装入透析袋中4℃进行梯度透析复性,再用PEG20000浓缩透析液,用Bradford染料结合法测定蛋白浓度,调整蛋白浓度至 0.5 mg/mL~1 mg/mL,过滤除菌后备用。
1.2.6 兔抗猪IL-2、IL-6多克隆抗体的制备 将上述纯化的蛋白与等体积弗氏完全佐剂混合,充分乳化,于家兔颈部、背部多点皮下注射,剂量为1 mg免疫原/只,间隔15 d,再将纯化蛋白与等量弗氏不完全佐剂相混,充分乳化进行加强免疫,之后每周加强免疫一次。每周采血用ELISA方法检测抗体效价,抗体水平达到要求后颈动脉采血收集血清,-20℃保存备用。
2 结果
2.1 猪IL-2、IL-6基因的PCR扩增结果
PCR扩增产物经10 g/L琼脂糖凝胶电泳后,在凝胶成像系统下观察,可见约524 bp和669 bp大小的清晰条带,与预期片段大小相符(图1),连接T载体后测序结果与原序列进行比对,结果相符。
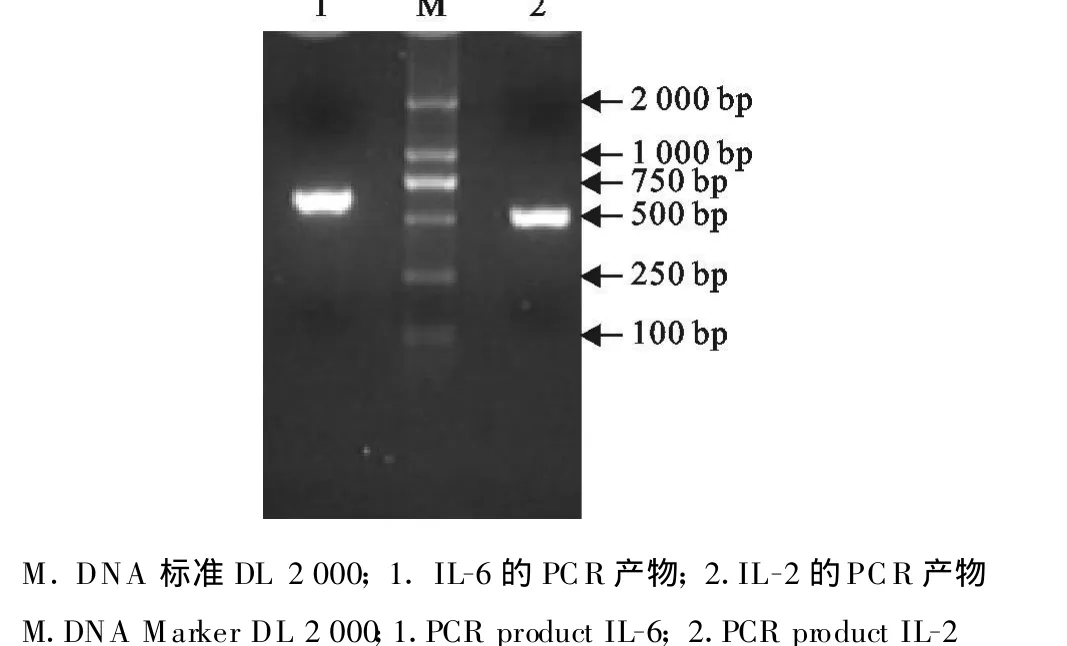
图1 IL-2和IL-6基因的PCR产物Fig.1 PCR products of IL-2 and IL-6
2.2 重组表达质粒pETIL-2、pETIL-6的鉴定
分别以阳性重组子pETIL-2和pETIL-6为模板进行PCR鉴定,用10 g/mL的琼脂糖凝胶电泳分析PCR产物,扩增片段大小与预期相符(图2)。重组子pETIL-2、pETIL-6分别用EcoRⅠ和HindⅢ双酶切,分别可得到5 422 bp和524 bp、5 422 bp和669 bp的片段(图3),结果与预期大小相符,表明目的片段已插入pET30a中。
2.3 重组质粒 pETIL-2、pETIL-6表达产物的SDS-PAGE与Western-blot鉴定结果
重组质粒在大肠埃希菌BL21(DE3)、Rosetta(DE3)中均大量表达,表达产物经SDS-PAGE结果显示,pETIL-2、pETIL-6分别在26 ku和30 ku处有一条特异蛋白带(图4),与预期大小相符,而对照无此条带。经凝胶薄层扫描,IL-2在BL21(DE3)、Rosetta(DE3)中的表达量分别为14.5%和27.4%,IL-6在BL21(DE3)、Rosetta(DE3)中的表达量分别为59.7%和49.5%。Western blot鉴定结果显示所表达的两种蛋白均可以与鼠源的抗HIS标签的抗体发生反应(图5),表明所表达的蛋白具有良好 的反应原性。
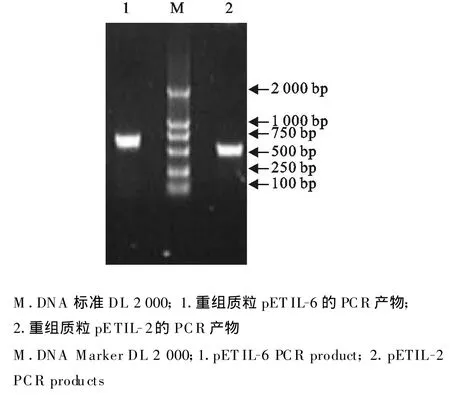
图2 重组质粒pETIL-2和pETIL-6的PCR鉴定结果Fig.2 PCR products of pETIL-2 and pET IL-6
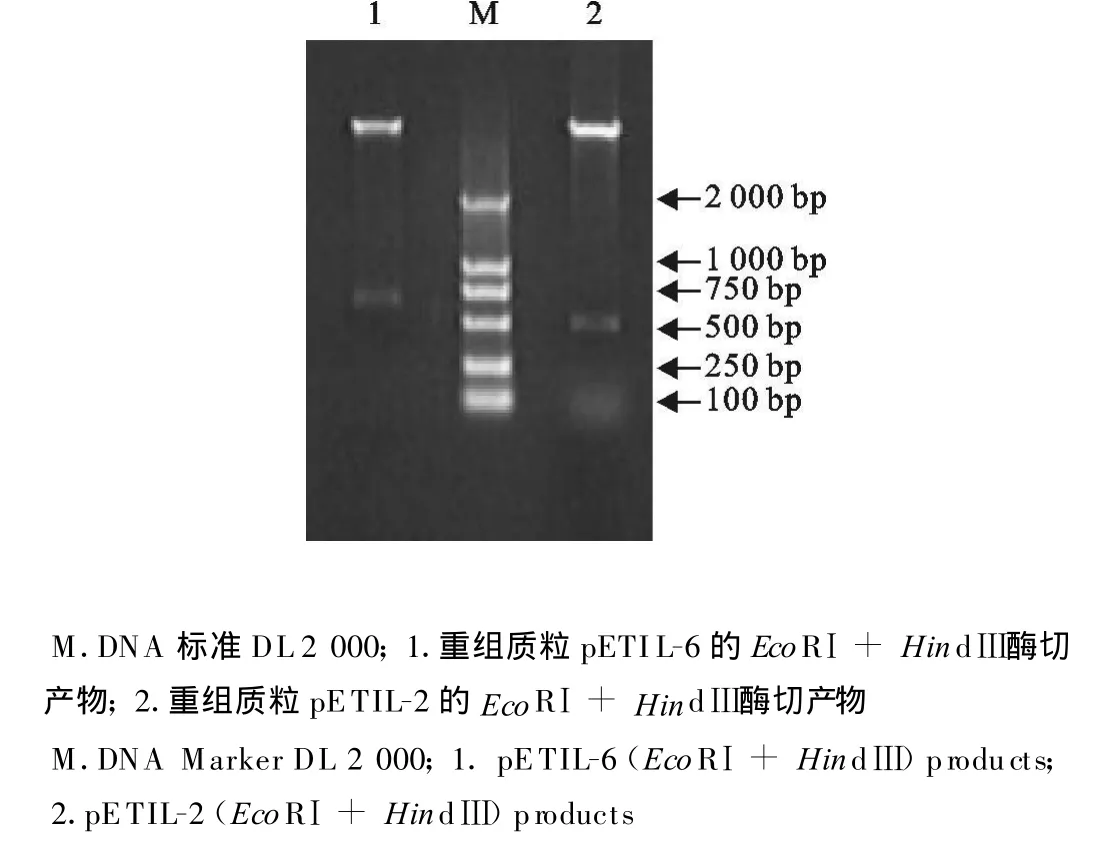
图3 重组质粒pETIL-2和pETIL-6的酶切鉴定结果Fig.3 Identification of recombinant plasmid pETIL-2 and pETIL-6 by enzyme digestion
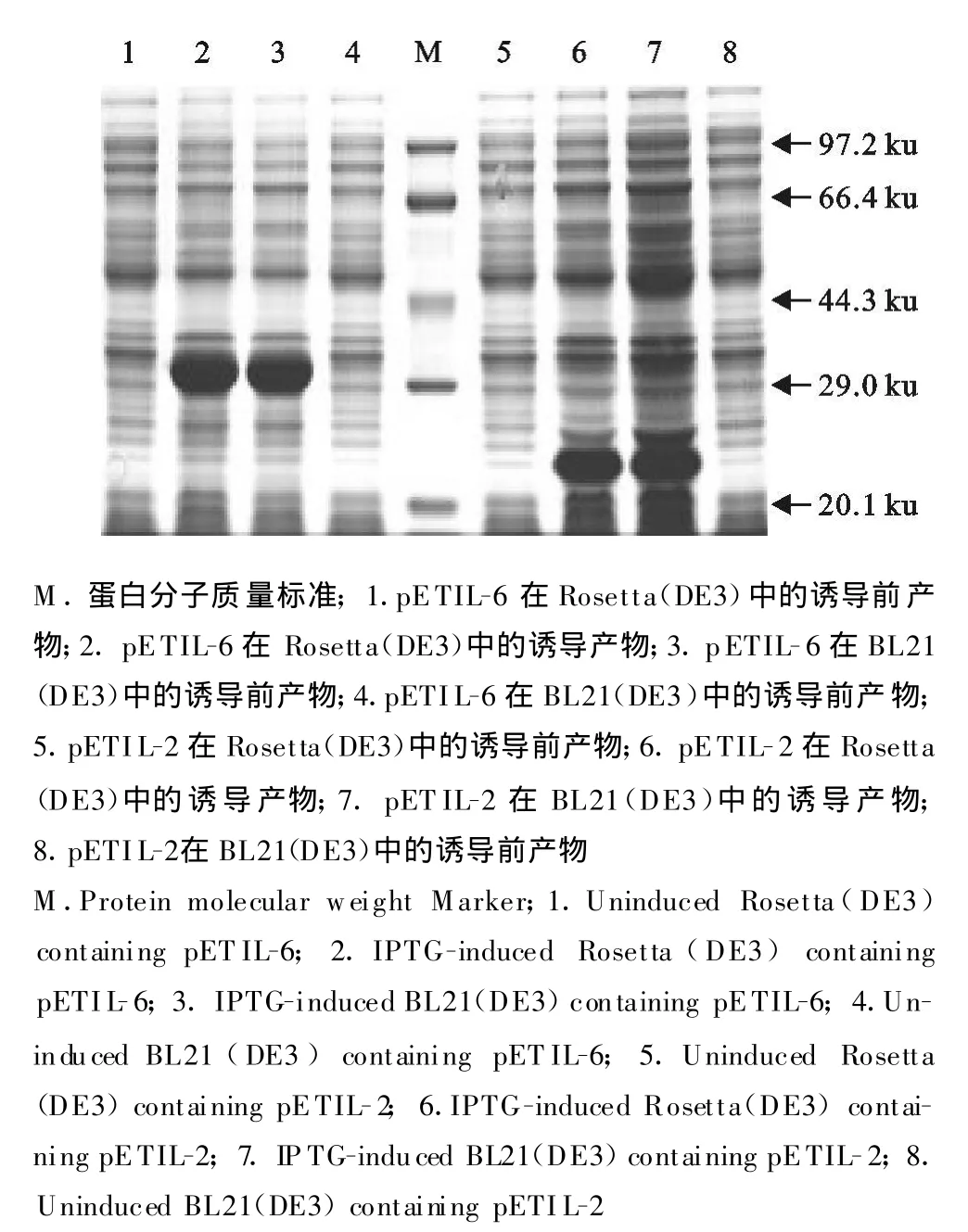
图4 pETIL-2和pETIL-6表达产物的SDS-PAGE结果Fig.4 SDS-PAGE analy sis of expressed products of pETIL-2 and pETIL-6
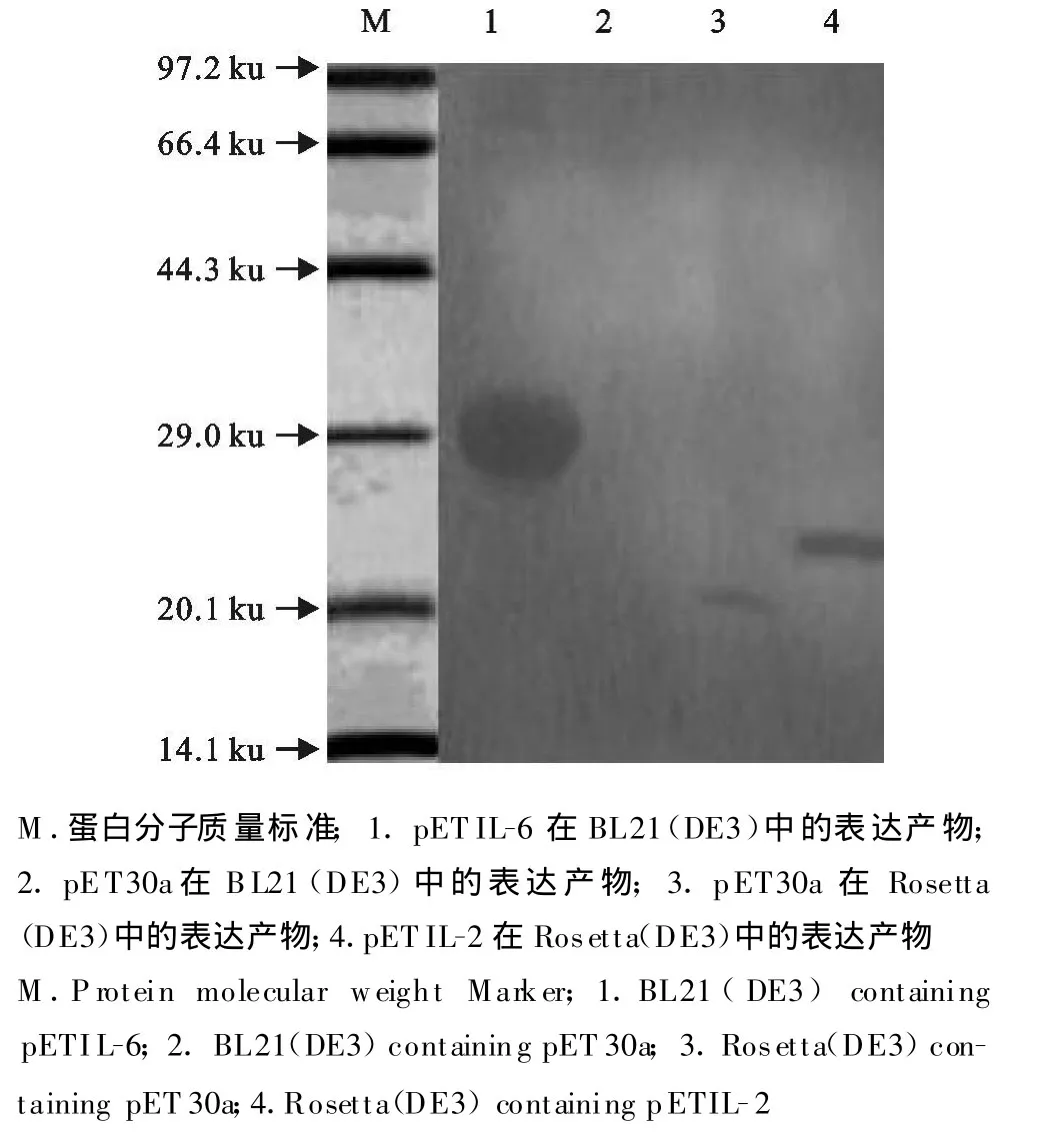
图5 pETIL-2和pETIL-6表达产物的Western-blot鉴定结果Fig.5 Western-bolt analysis of expressed products of pETIL-2 and pETIL-6
2.4 重组蛋白包涵体的提取与纯化
pIL-2与pIL-6在大肠埃希菌表达体系中得到大量表达,以致形成不可溶的包涵体形式,纯化后目的蛋白的含量可达90%以上。复性、浓缩后测定蛋白浓度可达1.2 mg/mL。
2.5 兔抗猪IL-2、IL-6多克隆抗体的制备
以纯化复性后的IL-2和IL-6蛋白稀释1 000倍后作为包被抗原,间接ELISA法测定IL-2和IL-6的抗体效价。结果表明二免一周后的效价可达1∶6 400,三免后的效价可达 1∶12 800以上,而未免疫的家兔对照组抗体均为阴性,说明所表达的IL-2和IL-6蛋白具有良好的免疫原性,能够使家兔产生高效价的多克隆抗体。
3 讨论
养猪业在我国国民经济中占据着相当重要的地位,但是猪的一些烈性传染病严重威胁着养猪业的发展。目前在我国疫苗的使用仍是猪病防控的主要途径,而佐剂直接关系到疫苗的使用效果。猪IL-2和IL-6是高活性、多功能的生物活性糖蛋白,具有调节机体免疫功能,增强机体免疫力的作用,作为佐剂使用可以有效提高疫苗的免疫保护力。田国宝等[8]研究表明,猪IL-2、IL-4分子佐剂能显著提高口蹄疫疫苗的抗体水平及保护率。Yang Y等[9]将猪的IL-2基因亚克隆到真核表达质粒VR1020中,用壳聚糖纳米颗粒包裹后肌肉注射已免疫猪副伤寒菌疫苗的小鼠,35 d后给小鼠口服沙门菌,发现小鼠的IgG、IgA 、IgM 、IL-2、IL-4 、IL-6、特异性抗体的含量及免疫活性细胞的数量均比对照组有明显增加。苏丹等[10]将改组的猪IL-2基因与重组CpG质粒经离子交联法制备的壳聚糖纳米颗粒包裹后肌肉注射已接种猪伪狂犬病灭活疫苗的免疫猪,结果猪对伪狂犬病灭活疫苗的体液免疫水平和细胞免疫水平显著增加。Zheng L H等[11]将IL-6基因与CpG基序作为伪狂犬弱毒疫苗佐剂免疫刚出生的小猪,其后检测其特异性抗体、淋巴细胞活性及诱导的IL-2的活力等各项指标发现小猪的免疫应答能力显著提高。Wu M等[12]将猪IL-6基因与CpG序列亚克隆到真核表达质粒上,与猪瘟-巴氏杆菌-猪丹毒三价苗共同免疫小鼠,结果显示小鼠的白细胞、单核细胞、颗粒细胞和淋巴细胞的数量及特异性抗体的含量均显著增加。陈建林等[13]将包裹有猪IL-4、IL-6的融合基因和CpG基序的壳聚糖纳米颗粒肌肉注射接种过猪蓝耳病灭活苗的长白川白杂交猪,接种后发现血清中 IL-2、IL-4、IL-6和 IgG 、IgA 、IgM 及特异抗体的含量较对照组均显著增多,淋巴细胞和单核细胞数量也明显升高。上述研究表明猪白细胞介素作为佐剂具有很大的应用价值,且选取不同的白细胞介素进行组合使用可能会有更好的效果。本研究选用的猪IL-2和IL-6分属于 Th1型和 Th2型细胞因子,将它们进行组合使用有可能成为一种新型、高效的免疫佐剂。
利用原核表达系统获取目的蛋白是基因工程技术中常用的方法,相对于真核表达其制备过程简单,目的蛋白产量大。本研究选用PET30a质粒采用基因工程方法构建了大肠埃希菌表达质粒PET IL-2和pETIL-6对猪IL-2和IL-6的全基因序列进行表达,在BL21(DE3)和 Rosetta(DE3)两种宿主菌中都得到了表达,严琳等[14]曾用PET28b载体表达含有IL-6信号肽的全基因序列结果未获得表达,而去掉信号肽后则获得了高效表达,分析可能与信号肽序列中的疏水氨基酸有关,与本试验的结果并不相符,但信号肽疏水性氨基酸的存在是否影响其表达量还有待于进一步证实。IL-2的表达量较低,分析可能与IL-2有明显的疏水区域有关,真核基因在原核生物中的表达存在密码子偏爱性的问题也可能是原因之一,可以尝试更换不同的载体进行试验。
PET30a为高效原核表达载体,表达的融合蛋白含有6个组氨酸配体。配体相对分子质量小,不需要切割,也不影响融合蛋白的生物学活性,本研究采用尿素溶解、低浓度的复性液复性、PBS透析等方法对重组融合蛋白进行纯化、复性,得到的蛋白纯度可达90%以上,纯化过程免去了过镍-铬金属螯合剂亲和层析柱的步骤,具有成本低廉,操作简单,纯化效果好、易于规模化生产等优点。采用PEG20000浓缩后的蛋白浓度可达1.2 mg/mL,完全可以满足佐剂的使用剂量。此方法也存在一定的缺陷,纯化复性后的蛋白极不稳定,4℃放置不到1周即有沉淀产生,这可能与原核表达的重组蛋白未糖基化有关,如果要长时间保存,可以进行冻干保存。
试验中制备多克隆抗体所选用的家兔对重组蛋白反应良好,三免后ELISA检测抗体效价即可达到1∶12 800以上,用此制备的抗体作为一抗稀释500倍后做Wester blot检测原核表达的IL-2和IL-6的串联蛋白有明显的反应,特异性较好(待发表)。此外,此抗体还可用于检测猪体内IL-2和IL-6的含量水平,评价猪体的免疫状态,为以后佐剂的使用剂量提供参考依据。
[1]Camille A,Flamme L,Pearce E J.T he absence of IL-6 does not affect T h2 cell developmentin vivo,but does lead to impaired proliferation,IL-2 receptor expression,and B cell responses[J].J Immunol,1999,162:5829-5837.
[2]Uyttenhove C,Coulie P G,Snick J V.T cell growth and differ-entiation induced by ineterleukin-HP1/IL-6,the murine hybridoma/plastocytoma growth factor[J].J Exp Med,1988,167:1417-1427.
[3]Joseph S B,Miner K T,Croft M.Augmentation of naive,Th1 and Th2 effector CD4 responses by IL-6,IL-l,and T NF[J].Eur J Immunol,1998,28(l):277-289.
[4]严 琳,何启盖,陈焕春,等.猪IL-2与IL-6的原核表达及其对伪狂犬病基因缺失疫苗的佐剂效应研究[J].中国农业科学,2003,36(10):1213-1218.
[5]张 芳,郭万柱,吴 华.荣昌猪白细胞介素-2基因的原核表达[J].中国预防兽医学报,2007,29(5):355-358.
[6]范俊娟,陈 建,余兴龙,等.猪白细胞介素-6基因在大肠杆菌中的表达及其产物的促淋巴细胞增殖活性[J].中国兽医科学,2008(6):531-534.
[7]景志忠,窦永喜,罗启慧,等.猪白介素家族重要基因的克隆表达及其结构与功能预测分析[J].中国农业科学,2006,39(3):612-619.
[8]田国宝.猪白细胞介素2、4分子佐剂对猪口蹄疫疫苗免疫增强作用研究[D].四川雅安:四川农业大学,2006.
[9]Yang Y,Chen J,Li H,et al.Porcine interleukin-2 gene encapsulated in chitosan nanoparticles enhances immune response of mice to piglet paratyphoid vaccine[J].Comp Immunol Microbiol Infect Dis,2007,30(1):19-32.
[10]苏 丹,李 栋,程 驰,等.改组猪 IL-2基因与CpG序列对猪伪狂犬病灭活疫苗免疫应答的影响[J].中国兽医科学,2008,38(9):767-771.
[11]Zhang L,Tian X,Guo Y,et al.Effect of transgenic expression of porcine interleukin-6 gene and CpG sequences on immune responses of newborn piglets inoculated with pseudorabies attenuated vaccine[J].Res Vet Sci,2006,80(3):281-286.
[12]Wu M,Gao R,Meng M,et al.Regulating effects of porcine interleukin-6 gene and CpG motifs on immune responses to porcine trivalent vaccines in mice[J].Res Vet Sci,2004,77(1):49-57.
[13]陈建林,杨 肖,章 欢,等.猪白细胞介素4、6融合基因和CpG基序对猪蓝耳病疫苗免疫的强化效应[J].四川动物,2008,27(6):1012-1016.
[14]严 琳.猪白细胞介素2与猪白细胞介素6的基因表达及作为疫苗佐剂的研究[D].湖北武汉:华中农业大学,2005:104.
Prokaryotic Expression and Preparation of Polyclonal Antibody for Porcine Interleukin-2 and Interleukin-6
ZHEN Hong-hua1,SHEN Zhi-qiang2,SHAN Hu1,WANG Jin-liang2
(1.College of Animal Science and Technology,Qingdao Agricultural University,Qingdao,Shandong266109,China;2.Shandong Binzhou Animal Science And Veterinary Medicine Institute,Binzhou,Shandong,256600,China)
The interleukin-2(IL-2)and interleukin-6(IL-6)are the important factors for immunoloregulation,and have great development prospects in the application of adjuvants.The genes of porcine IL-2 and IL-6 were amplified from recombinant plasmid pTIL-2 and pTIL-6.After being digested by restriction endonucleases,the IL-2 and IL-6 genes were subcloned into the prokaryotic expression vector pET30a.After restriction enzyme digestion,PCR identification and sequence analysis of the recombinant plasmids,the positive recombinant plasmids were selected and designated as pETIL-2 and pETIL-6.The pETIL-2 and pETIL-6 were transformed intoE.coliBL21(DE3)and Rosetta(DE3)and then induced with IPTG at 37℃.SDS-PAGE and Western-blotting analysis showed that the expressed recombinant IL-2 and IL-6 proteins presented in inclusion bodies and were about 26ku and 30ku in molecular weight.The recombinant IL-2 and IL-6 protein which were purified and refolded were used to immunize rabbit for specific IL-2/IL-6 antibody generation.
porcine interleukin-2;porcine interleukin-6;prokaryotic expression;polyclonal antibody
S858.28;S852.4
A
1007-5038(2010)02-0060-05*
2009-10-10
甄洪花(1985-),女,山东济南人,硕士研究生,主要从事兽医生物制品学研究。*通讯作者
