猪圆环病毒2型甘肃株全基因组克隆及序列分析*
2010-05-31贾怀杰王晓霞房永祥陈国华李玩生窦永喜李克斌瞿惠玲景志忠
贾怀杰,王晓霞,房永祥,陈国华,李玩生,窦永喜,李克斌,2,瞿惠玲,2,3,景志忠*
(1.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点实验室,甘肃兰州 730046;2.甘肃农业大学动物医学院,甘肃兰州 730070;3.甘肃省兽医局,甘肃兰州 730030)
猪圆环病毒2型甘肃株全基因组克隆及序列分析*
贾怀杰1,王晓霞1,房永祥1,陈国华1,李玩生1,窦永喜1,李克斌1,2,瞿惠玲1,2,3,景志忠1*
(1.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,农业部兽医公共卫生重点实验室,甘肃兰州 730046;2.甘肃农业大学动物医学院,甘肃兰州 730070;3.甘肃省兽医局,甘肃兰州 730030)
参照GenBank中登录的猪圆环病毒2型(PCV-2)全基因组序列,设计合成了两对特异性引物,从甘肃白银疑似断奶仔猪多系统衰竭综合征(PMWS)病料中提取病毒DNA,分步扩增全基因组。回收PCR产物,将其插入pGEM-T Easy载体,构建了重组质粒pGEM-PCV-2,转化后筛选、提取阳性重组质粒进行测序。结果表明,克隆到的PCV-2全基因组长度为1 767 bp。应用DNA Star序列分析软件,对所测PCV-2序列与GenBank中登录的包括甘肃在内的国内外PCV毒株进行同源性分析。结果显示,克隆的PCV-2与英国株(UK-EU656143)遗传关系最近,其核苷酸和推导的氨基酸序列同源性高达96.2%和91.0%,与已报道的2株甘肃毒株(GS03-EU547458,GSLZ-FJ447482)遗传关系较远,可能是流行于甘肃白银的一个变异毒株(GSBY)。
猪圆环病毒2型;基因组;克隆;序列分析
猪圆环病毒2型(Porcine circovirus 2,PCV-2)是引起断奶仔猪多系统衰竭综合征(Post-weaning multisystemic wasting syndrome,PMWS)等的主要病原。自1991年PMWS在北美洲最先发现以来,已在世界范围内流行[1]。郎洪武等[2]首次报道中国猪群存在PCV-2感染,感染率为42.9%。周绪斌等[3]报道,我国在2000年-2005年期间20多个省市PCV-2感染平均阳性率达55.0%。由于PCV-2主要侵害机体的免疫系统,导致感染猪免疫抑制,易继发感染其他病毒和细菌[4-6],能引起多种疾病,防控难度加大。PMWS既可水平传播,导致断奶仔猪发病死亡,亦可垂直传播,引起繁殖障碍[5],仔猪死亡率明显升高,对中国的养猪业造成巨大的经济损失,成为目前中国养猪业重要传染病之一。
在我国养猪生产实践中,PCV-2的混合感染和持续性感染非常普遍,仅仅依赖单一疫苗防控显然是不够的,因此,需对该病进行系统研究和重新认识。本试验采用PCR分步扩增技术,从疑似 PMWS病料中克隆PCV-2的全基因组,分析地方毒株间的差异,探讨PCV-2毒株间的基因组序列的变异规律,从而为研究其生物学特性、流行病学、致病机理等奠定基础。
1 材料与方法
1.1 材料
病料来自甘肃白银某猪场疑似PMWS病死猪的组织(包括肺、淋巴结、肝和肾)。pGEM-T Easy Vector购自Promega公司,病毒DNA/RNA提取试剂盒、PCR试剂盒(包括TaqDNA聚合酶、dNTP Mixture、10×PCR buffer)、限制性内切酶EcoRⅠ、DNA Marker DL 2 000均购自宝生物工程(大连)有限公司;氨苄青霉素(Amp)购自Amresco公司。宿主菌大肠埃希菌DH5α由农业部兽医公共卫生重点实验室保存。DNA胶回收试剂盒购自博大泰恒公司。其余试剂均为进口或国产分析纯。
1.2 方法
1.2.1 引物的设计与合成 参照GenBank发表的PCV-2全基因序列,利用Oligo6.0生物软件设计2对引物分A、B两段进行扩增。预期扩增大小分别为1 141 bp和1 169 bp的A、B片段。其序列如下:
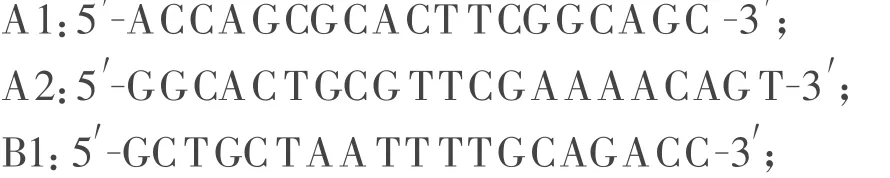
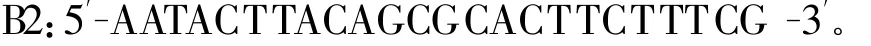
以上引物由上海生工生物工程技术服务有限公司合成并经PAGE电泳纯化,使用前用灭菌三蒸水溶解 ,浓度为 25 μ mol/L,置-20 ℃保存。
1.2.2 模板的制备 将所采病料加入石英砂充分研磨,反复冻融3次,5 000 r/min离心5 min,取0.25 mL上清,按照宝生物工程(大连)有限公司病毒DNA/RNA提取试剂盒说明书提取病毒基因组DNA。取适量用作PCR模板。
1.2.3 PCV-2全基因片段的PCR扩增
1.2.3.1 A、B片段的PCR扩增 建立50 μ L PCR反应体系 ,DNA 模板 3 μ L,10 ×PCR buffer 5 μ L,2.5 mmol/L dNTPs 4 μ L,25 μ mol/L上下游引物各1 μ L,TaqDNA 聚合酶0.5 μ L,加 H2O 至50.0 μ L 。PCR反应程序为94℃预变性5 min;94℃1 min,58℃1 min,72℃1.5 min,共 35个循环;最后72℃延伸10 min。经10 g/L琼脂糖凝胶电泳检查PCR产物。B片段PCR扩增:建立50 μ L PCR反应体系,DNA 模 板 3 μ L,10 ×PCR buffer 5 μ L,2.5 mmol/L dNT Ps 4 μ L,25 μ mol/L 上 下游引物各 1 μ L,TaqDNA 聚 合 酶 0.5 μ L,加 H2O 至50.0 μ L。PCR反应程序为:94 ℃预变性5 min;94℃1 min,55℃1 min,72℃1.5 min,35个循环;最后72 ℃延伸10 min。反应结束后,各取5 μ L PCR产物于15 g/L琼脂糖凝胶中进行电泳检测。建立50 μ L PCR 反应体系,分别扩增 A、B 片段:DNA 模 板 3 μ L,10 × PCR buffer5 μ L,2.5 mmol/L dNT Ps 4 μ L,25 μ mol/L 上 下游引物各 1 μ L,TaqDNA 聚 合 酶 0.5 μ L,加 H2O 至50.0 μ L。PCR反应程序为:94 ℃预变性 5 min;94℃1 min,57℃1 min,72℃1.5 min,共35个循环;最后72℃延伸10 min。经10 g/L琼脂糖凝胶电泳检查PCR产物。
1.2.3.2 A、B片段PCR产物的回收 PCR产物经10 g/L琼脂糖凝胶电泳,以DNA胶回收试剂盒回收PCR产物,按说明书操作,电泳鉴定回收的PCR产物。
1.2.3.3 全基因组片段的PCR扩增 以回收的A、B片段PCR产物为模板、A1和 B2为上、下游引物扩增PCV-2全基因组。建立50 μ L PCR反应体系,A、B片段 PCR 产物各 1 μ L,10×PCR buffer 5 μ L,2.5 mmol/L dNTPs 4 μ L,TaqDNA 聚合酶0.5 μ L,最后加水至49 μ L。反应条件为:94 ℃预变性5 min;94℃1 min,56.7℃1 min,72℃2 min,1个循环,停止 PCR仪运行,补加 A1和 B2各0.5 μ L,94 ℃1 min,56.7 ℃1 min,72 ℃2 min,再运行34个循环;最后72℃后延伸30 min。反应结束后,各取5 μ L PCR产物于15 g/L琼脂糖凝胶中进行电泳检测。
1.2.4 PCR产物的连接及转化 按分子克隆操作把回收的目的基因片段和pGEM-T Easy载体连接。连接体系 :2×Rapid Ligation buffer 5.0 μ L,目的片 段 2 μ L,pGEM-T Vector 1.0 μ L,T4 DNA Ligase 1.0 μ L,补加去离子水至终体积 10 μ L 。连接产物于 4℃连接过夜、转化感受态大肠埃希菌DH5α,并涂布于含氨苄(50 mg/L)的琼脂LB平板上,37℃恒温培养12 h~16 h。菌落经PCR鉴定后,挑取单个阳性菌落接种于含氨苄(50 mg/L)的液体LB培养基中,振荡培养,按照博大泰恒公司质粒提取试剂盒提取质粒,PCR和EcoRⅠ酶切鉴定。
1.2.5 阳性重组质粒的筛选及鉴定 随机挑取上述转化平皿中的白色单菌落,接种到含氨苄的 LB液体培养基中,37℃振荡过夜培养,至培养液呈云雾状,对菌液提取质粒进行PCR鉴定、酶切鉴定,筛选阳性克隆。
1.2.6 序列分析 将阳性重组质粒送往上海生工生物工程技术服务有限公司测序,并与GenBank中登录的国内外毒株进行序列的同源性比较。
2 结果
2.1 PCV-2全基因片段的PCR扩增
2.1.1 PCV-2 A、B片段的 PCR扩增 以疑似PMWS病死猪的组织提取病毒的DNA,以此DNA为膜板,以A1和A2,B1和B2为引物分别进行A和B片段的 PCR扩增,结果扩增出了大小约1 100 bp的两个片段,与预期结果相符(图1)。
2.1.2 PCV-2全基因片段的PCR扩增 以回收的A、B片段PCR产物为模板,A1、B2为上、下游引物扩增PCV-2全基因组,扩增产物经10 g/L琼脂糖凝胶电泳分析,结果扩增出了1 800 bp左右的特异性片段,暂定为PCV-2甘肃白银株(PCV-2-GSBY)基因组序列,与预期片段大小相符(图2)。
2.2 全基因组的克隆与鉴定
将扩增纯化产物与pGEM-T Easy载体连接后,转化到大肠埃希菌DH5α,经过PCR、酶切快速鉴定和测序结果表明,克隆的阳性重组质粒均带有相应的目的片段(图3和图4)。
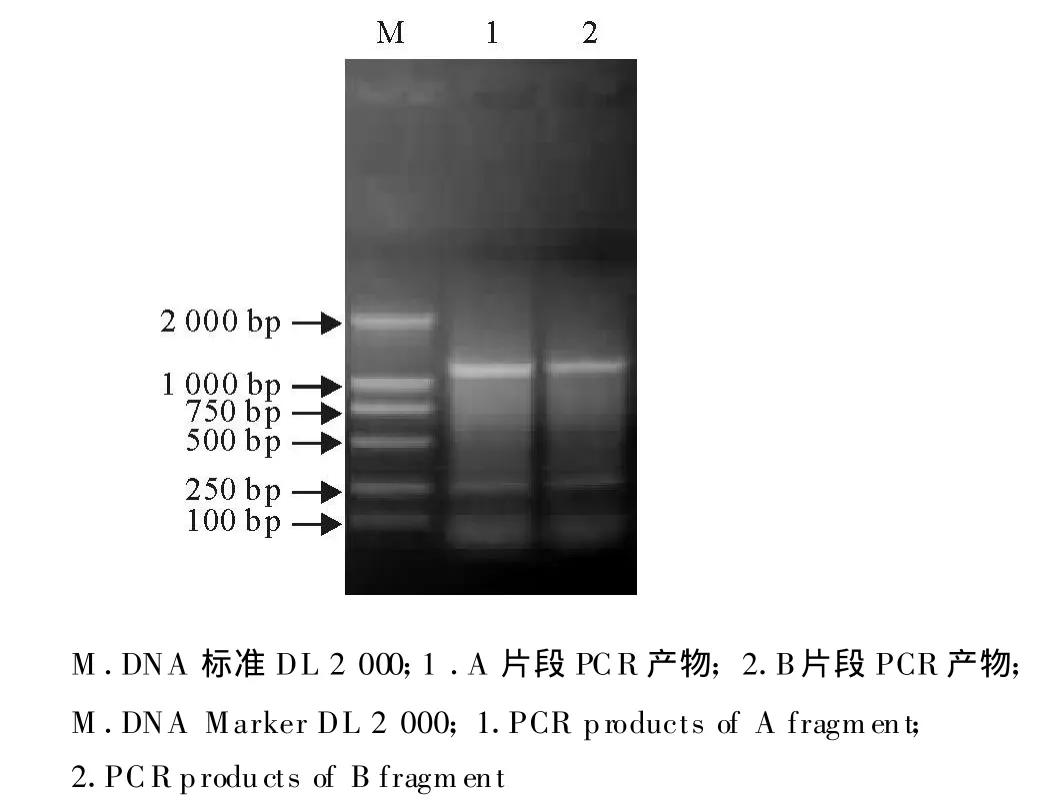
图1 PCV-2 A、B片段的PCR扩增Fig.1 Amplification of A and B fragments of PCV-2 by PCR
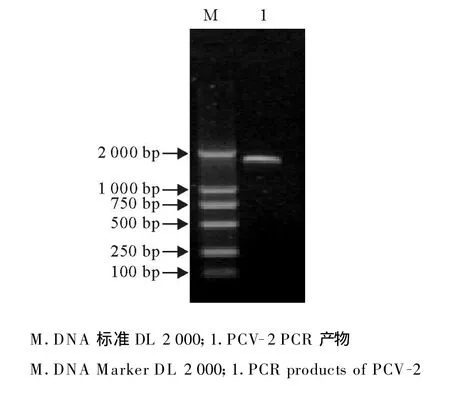
图2 PCV-2全基因组的PCR扩增Fig.2 Amplification of PCV-2 genome by PCR
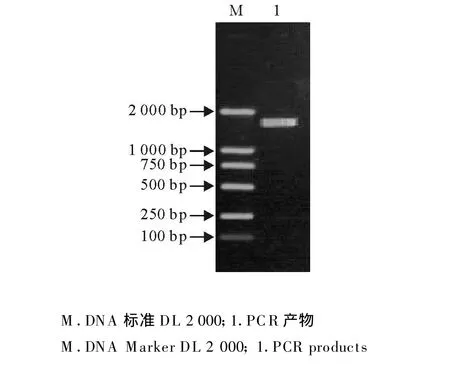
图3 重组质粒pGEM-PCV-2 PCR鉴定Fig.3 Identification of recombinant plasmid pGEM-PCV-2 by PCR
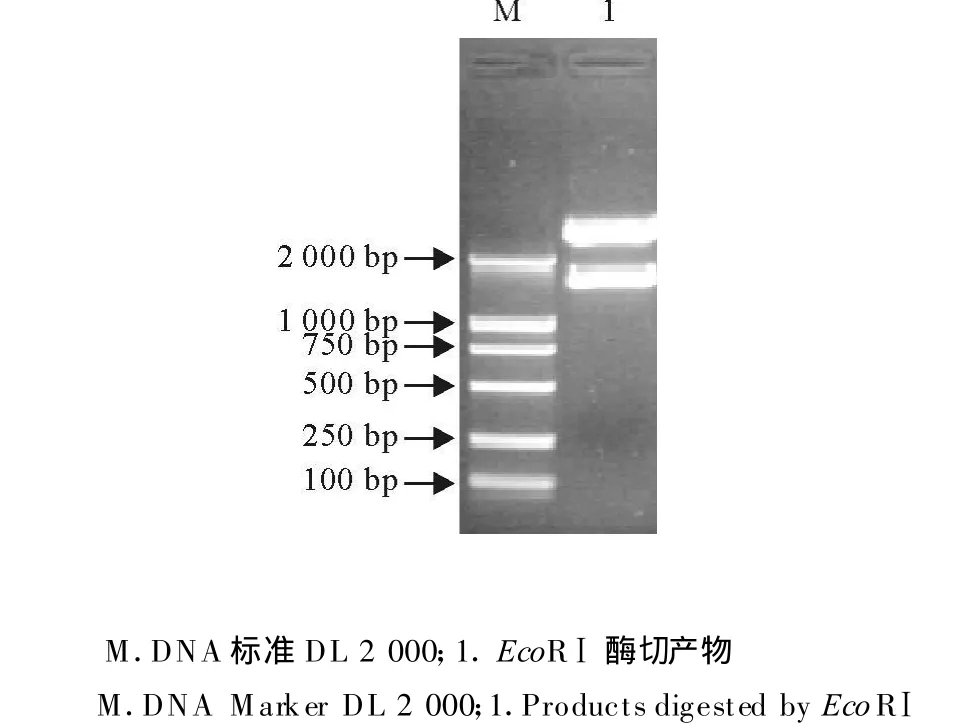
图4 重组质粒pGEM-PCV-2的酶切鉴定Fig.4 Identification of recombinant plasmid pGEM-PCV-2 by digestion
2.3 测序和序列比较
将经PCR和酶切鉴定阳性的重组质粒进行测序。所得病毒基因组序列长度为1 767 bp,与预期结果相符。用DNA Star软件将所克隆的PCV-2 GSBY的全基因组核苷酸序列、ORF1的氨基酸和ORF2的氨基酸与GenBank的代表毒株核苷酸及氨基酸进行比对,并绘制其进化树。PCV-2毒株间的核苷酸及其推导的氨基酸序列同源性比较,结果显示,所有 PCV-2毒株间同源性均很高,分别为95.3%~99.7%、62.4%~99.5%,本研究所克隆的PCV-2 GSBY毒株的核苷酸及其推导的氨基酸序列与其他毒株的同源性在95.3%~96.2%、62.4%~91.0%之间。
将编码PCV-2主要蛋白(Rep蛋白和Cap蛋白)的2个阅读框(ORF1与ORF2)进行了氨基酸序列的变异分析。结果显示,ORF1编码的Rep蛋白的氨基酸序列同源性为95.2%~100%;ORF2编码Cap蛋白的氨基酸同源性为79.1%~100%,说明不同PCV-2毒株之间ORF1比较稳定,ORF2相对差异较大。本研究分离克隆的PCV-2 GSBY的Rep、Cap蛋白与其他毒株的氨基酸序列比较,同源性分别为95.2%~96.2%和79.1%~88.0%(表1)。
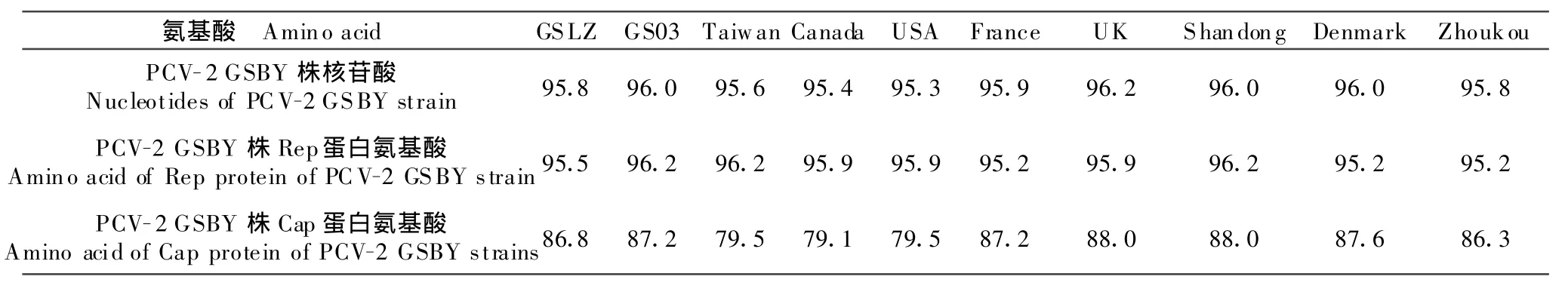
表1 PCV-2毒株核苷酸、Rep蛋白和Cap蛋白氨基酸同源性比较Table 1 Homological comparison of the nucleotide,Rep protein,Cap protein of PCV-2 strains
表1中对应的GenBank登录号如下:甘肃兰州株(GSLZ-FJ447482),甘肃株(GS03-EU547458),台湾株(Taiwan-AF166528),加拿大株(Canada-AF408635),美国株(USA-AJ223185),法国株(France-AY321987),英国株(UK-EU656143),山东株(Shandong-DQ346683),丹麦株(Denmark-EF565349),河南株(Zhoukou-EU656143)。
为了更好地了解PCV-2 GSBY毒株的分类地位及其遗传演化关系,在分析PCV毒株同源性的基础上与GenBank的16株PCV-2和2株PCV-1代表毒株核苷酸遗传进化分析,并绘制了其系统发生进化树(图6)。从图中可以看出,PCV-1和PCV-2两个基因型间差异较大,明显分为两支。PCV-2各个分离毒株间在进化上存在着某些地理位置上的相关性,分为两大主群。一群以北美洲地区分离毒株为主,主要有加拿大株和美国株。另一群以欧洲地区分离毒株为主,主要有英国株、法国株和丹麦株等,还有部分中国分离毒株。本研究克隆的PCV-2 GSBY毒株与英国株同源性较高,被分在同一主支上,在此主支中又由两个分支组成。本研究克隆的PCV-2 GSBY毒株与已报道的GS03(EU547458)、GSLZ(FJ447482)和山东(DQ346683)等其他国内分离(流行)毒株关系较远,被分在两个不同的小分支上,而后处于一个小的分支。
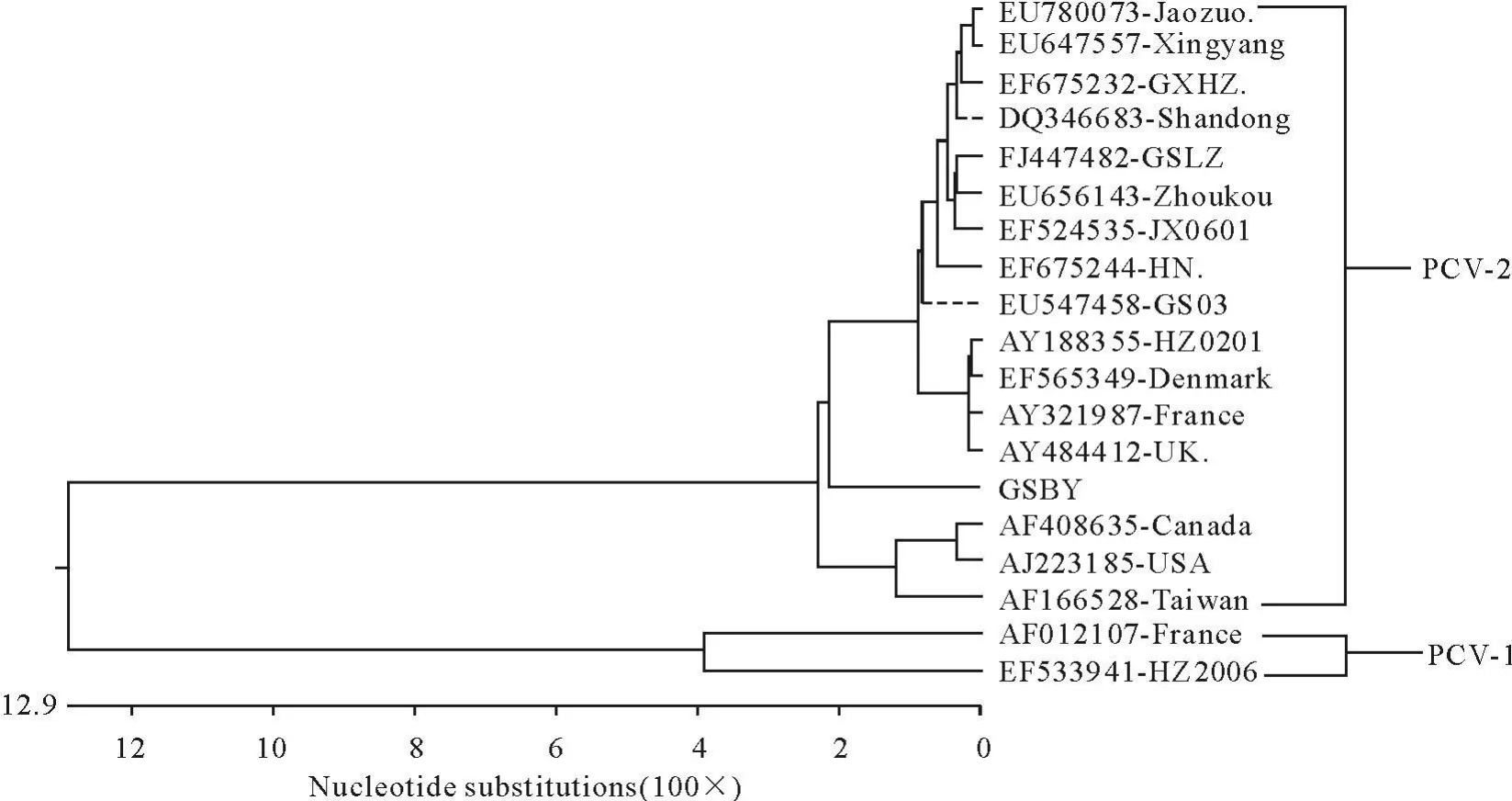
图5 PCV进化树分析图Fig.5 Phylogenetic tree of PCV
2.4 PCV-2 GSBY株ORF2基因编码的氨基酸抗原性和亲水性分析
测序结果表明PCV-2 GSBY株ORF2基因长702 bp,编码230个氨基酸,其推导的氨基酸序列如下所示:LRVKWGVFKIKFSELYIHGYTDIVVLVVYTVFERSAEAYMVYISSSLSQPELISFVIGLEVIDCPIKDRFGGEIAGVVGEGLGYGMAGGVVYIGVIG.GISLCYKVIINNSSGAHSPVT LGDWGAGPESNLNLPYSVVFKGHSEGVAPSWGKKIINIKSHHVHIPGGRSYCGSFDSITDGAGEAGVEDAIFPSPAVTVAGVDEPGAAAEDLAKMAAGAVSSSSVTPPWIRH。分子质量大约为 24 ku。该蛋白含有15个碱性氨基酸(K,R),且有多处串联的碱性氨基酸(R);22个酸性氨基酸(D,E);91个亲水性氨基酸(A,I,L,F,W,V);45个极性氨基酸(N,C,Q,S,T,Y)。
利用DNA Star软件对Cap蛋白的抗原表位预测,ORF2编码的氨基酸在第68位~73位、113位~116位 、129位 ~133位、143 位~148位、169位~174位、181位~184位和205位~209位可能存在抗原表位(图6)。对ORF2编码蛋白的亲水性分析表明,该蛋白具有较强的亲水性(图7)。
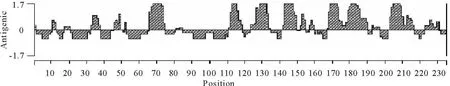
图6 GSBY株ORF2多肽抗原表位分析Fig.6 Antigenicity of ORF2 protein of GSBY
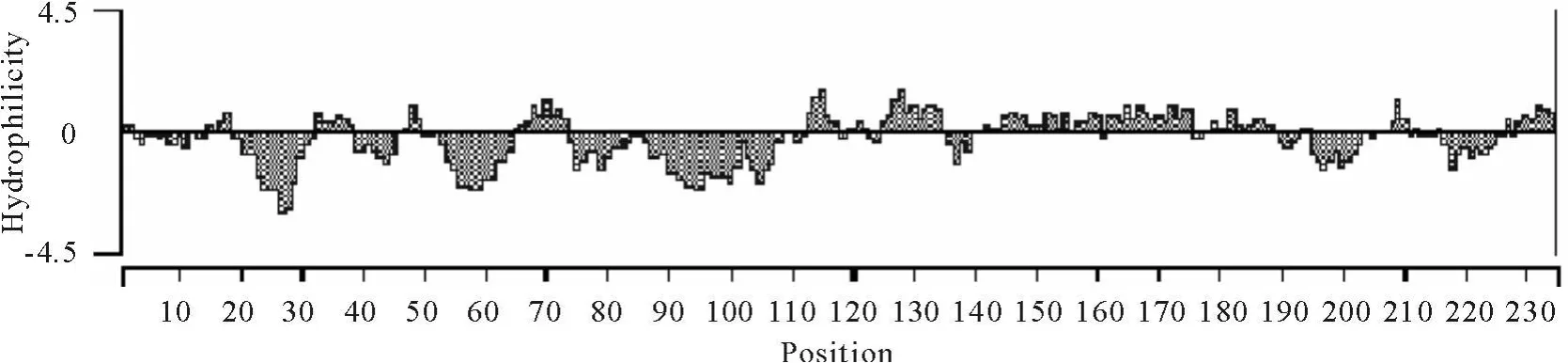
图7 GSBY株ORF2多肽亲水性分析Fig.7 Hydrophilicity of ORF2 protein of GSBY
3 讨论
PCV-2被认为是PMWS、猪皮炎-肾炎综合征(PDNS)、猪呼吸道疾病综合征(PRDC)、先天性震颤(CT)等疾病的主要病原。该病毒引起的疾病在世界范围内广泛流行,给养猪业造成了的巨大经济损失,己引起各国高度重视。
猪圆环病毒(PCV)有2种基因型,即PCV-1和PCV-2,其中 PCV-1全基因组大小为 1 759 bp,PCV-2全基因组大小有1 767 bp或1 768 bp 2种。PCV-2有11个开放阅读框(ORFs),研究较多的是ORF1和ORF2,其中对ORF2的研究已成为热点。PCV-2的ORF编码Rep蛋白的有945个碱基,编码314个氨基酸,有3个糖基化位点,其编码蛋白与PCV的复制相关,与PCV-1的ORF1编码蛋白有相同的抗原性。ORF2编码的Cap蛋白是PCV-2的核衣壳蛋白,具有很好的免疫原性,是构建重组疫苗和检测病原的首选基因[7-8]。Mahe等用杆状病毒和质粒载体表达了ORF1和ORF2,发现PCV-1 ORF2虽与PCV-2 ORF2的抗原性相关,但只有ORF2蛋白可以被PCV-2多抗识别。Liu Q等[8]将ORF2基因连接到MBP-His(8)-tag基因3′端,在细菌中表达了ORF2融合蛋白,该融合蛋白可以与PCV-2的多抗反应。这一结果表明,可以用ORF2来区分PCV-1和PCV-2。
虽然PCV在进化上比较保守,但是引起的临床疾病却广泛多样,而且病毒基因会随着时间的推移逐渐发生变异。据报道,病毒在连传120代的过程中发生了碱基突变,使得病毒的复制能力提高[9-10]。而且,病毒随着时间的流逝也逐渐发生了变异,这些变异是否导致毒力发生变化,至今为止,还未能证明当前不同国家和不同临床病症下分离到的PCV-2毒株间的致病性有何差异。目前,虽然PCV的研究己取得了很大的进展,但病毒是从何而来的,是如何传入家猪群的,又是如何演变的,尚不十分明了。因此,对PCV-2毒株基因组序列差异的研究,有助于阐明疫病暴发的真正原因。
本研究克隆的甘肃白银流行毒株(PCV-2 GSBY)基因组大小为1 767 bp,与其他PCV-2毒株全基因组核苷酸序列同源性在95.7%~96.2%之间,而与PCV-1核苷酸同源性仅为77.4%~83.6%,说明PCV-2 GSBY与所有PCV-2毒株间有较近的遗传演化关系,与PCV-1间关系较远。已有研究证实,尽管PCV-2基因组比较保守,但也存在着变异,变异的发生与地理分布有某种程度上的相关性。从遗传进化树上可以看出,目前全球圆环病毒2型主要有两大群,即以英国毒株为主的欧洲群和以美国和加拿大毒株为主的美洲群,而这两大洲是发生猪圆环病毒病较早的地区。另外,还可看出国内毒株与欧洲株遗传关系较近。根据流行病学的情况,该病在亚洲地区是近些年发生的,这提示我们,我国猪圆环病毒病的发生可能与在不同地区、不同时间引种有关。本研究克隆的PCV-2 GSBY毒株与英国株(UK-EU656143)关系最为密切,而与已报道的两株甘肃毒株(GS03-EU547458,GSLZ-FJ447482)关系较远,说明该毒株可能是流行于甘肃的一个变异毒株,这些研究结果将为甘肃PCV的流行病学和疫病防控提供科学依据。
本研究从甘肃省白银市某猪场采集疑似PMWS症状的病料,采用PCR检测方法对 PCV-2进行DNA病原检测,对其阳性病料的PCV-2进行全基因组扩增、克隆和测序,分析甘肃白银流行株基因组、ORF2编码Cap蛋白与国内外分离株间的遗传演化关系以及抗原性,补充了 PCV-2流行病学资料,为我国深入研究和防控该病奠定了基础。
[1]Segale S J,Domingo M.Postweaning multisystemic wasting syndrome(PM WS)in pigs:a review[J].Vet Q,2002,24(3):109-124.
[2]朗洪武,张广川,吴发权,等.断奶猪多系统衰弱综合征血清抗体检测[J].中国兽医科技,2000,30(3):3-5.
[3]周绪斌,张馨玉,许秀梅.我国猪圆环病毒2型的流行情况和分析[J].中国猪业,2007(5):37-41.
[4]Kim J,Chung H K,Chae C.Association of porcine circo-virus 2 with porcine respiratory disease complex[J].Vet J,2003,166(3):251-256.
[5]Ellis J,Clark E,Haines D,et al.Porcine circovirus2 and concurrent infections in the field[J].Vet Microbiol,2004,98(2):159-163.
[6]Sarli G,Mandrioli L,Laurenti M,et al.Immunohistochemical characterization of the lymph node reaction in pig post-weaning multisy stemic wasting syndrome(PM WS)[J].Vet Immunol Immunopathol,2001,83(12):53-67.
[7]Blanchard P,M ah D,Cariolet R,et al.Protection of swine against-postweaning multisystemic wasting syndrome(PM WS)by porcine circovirus type2(PCV2)proteins[J].Vaccine,2003,(21):4 565-4 575.
[8]Liu Q,Willson P,Attoh-poku S,et al.Bacterial expression of an immunologically reactive PCV2 fusion protein[J].Protein Expr Purif,2001,21(1):115-120.
[9]Ellis J,Krakiwka S,Lairmore M,et al.Reproduction of lesions of post-weaning multisy stemic wasting syndrome in gnotobiotic piglets[J].J Vet Diagn Invest,1999,11:3-14.
[10]温永俊,吴国军,蔡雪辉,等.猪圆环病毒和猪繁殖与呼吸综合征病毒混合感染对仔猪致病性的评估[J].中国预防兽医学报,2007,29(5):336-340.
Cloning and Sequence Analysis of the Complete Genome of Porcine Circovirus Type 2 Gansu Isolate
JIA Huai-jie1,WANG Xiao-xia1,FANG Yong-xiang1,CHEN Guo-hua1,LI Wan-sheng1,DOU Yong-xi1,LI Ke-bin1,2,QU Hui-ling1,2,3,JING Zhi-zhong1
(1.State K ey Laboratory of Veterinary Etiological Biology,Key Laboratory of Veterinary Public Health of Ministry of Agriculture,Lanzhou Veterinary Research Institute,CAAS,Lanzhou,Gansu,730046,China;2.Veterinary College of Gansu Agricultural University,Lanzhou,Gansu,730070,China;3.Veterinary Bureau of Gansu Province,Lanzhou,Gansu,730030,China)
Two pairs of primers were designied and synthesized according to the full length genome of PCV-2 in GenBank.Virus DNA was extracted from samples of suspected postweaning multisystemic wasting syndrome(PMWS)pig in Baiyin,Gansu province,and the full length genome of PCV-2 was cloned into pGEM-T easy vector,recombinant vector pGEM PCV-2 was constructed and then sequenced.Sequence analysis with DNA Star software showed that the genome of PCV-2 Gansu Baiyin isolate(GSBY)is 1 767 bp,the results of homology comparison of the full length genome among isolates published in GenBank indicated that GSBY isolate displayed high nucleotide and amino acid identities with England(UKEU656143)isolate(96.2%nucleotide identity and 91.0%amino acid identity),but was different from other two Gansu epidemic isolates(GS03-EU547458,GSLZ-FJ447482).So GSBY isolate in this test may be a variant isolate prevalent in Baiyin,Gansu.
Porcine circovirus type 2;genome;cloning;sequence analysis
Q78;S852.659.2
A
1007-5038(2010)02-0001-06
2009-05-26
国家自然基金项目(30871884);国家支撑计划(2006BAD31B03)和甘肃省支撑计划项目(0804NKCA076)
贾怀杰(1980-),男,甘肃临夏人,研究实习员,硕士,主要从事人兽共患病及病原与宿主分子生物学与免疫学研究。*通讯作者
