脑益康药物血清对 D-半乳糖致海马神经元凋亡的影响
2010-05-31周爱玲胡亚娥茅家慧施海燕
朱 燕 周爱玲 胡亚娥 茅家慧 施海燕
(南通大学医学院,江苏 南通 226001)
阿尔茨海默病(AD)是老年人中最常见的神经系统退行性疾病,严重危害老年人的身心健康,并给其家庭和社会带来沉重负担。目前治疗 AD的方法仅能缓解症状,不能改变疾病病程,尚无有效预防和治愈措施,因而研究开发有效的药物成为热点。近年来,氧化应激和氧自由基在 AD发病中的作用已经被许多体外实验和临床研究所证实〔1〕。脑益康(naoyikang,NYK)是由制首乌、知母、巴戟天等组成的中药复方,具有药物多靶位作用〔2~4〕。本实验运用血清药理学方法制备脑益康药物血清,采用 D-半乳糖(D-galactose,D-gal)建立AD细胞模型,观察脑益康药物血清对 AD细胞模型的保护作用及其机制,为脑益康的临床应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性 SD大鼠,体重(250±10)g;24 h内 SD新生鼠;均由南通大学实验动物中心提供。合格证号:SYXK(苏)2002-0022。
1.1.2 药品与试剂 NYK由南通市中医院制剂室制成颗粒剂。D-gal(上海恒信化学试剂有限公司);维生素E(VitE,南京白敬宇制药厂);DMEM培养基(美国 GIBCO公司);胎牛血清(杭州四季青生物制品公司);四甲基偶氮唑盐(MTT,上海实生细胞生物技术有限公司);考马斯亮蓝法测蛋白试剂盒、丙二醛(MDA)试剂盒、超氧化物歧化酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒(南京建成生物医学工程研究所)。PCR引物由上海英骏生物技术服务有限公司合成。
1.1.3 仪器 754型紫外可见分光光度计(上海光谱仪器有限公司);核酸蛋白定量监测仪(德国 Biophotometer公司);PTC-100型 PCR仪(美国 MJ.RESEARCH.INC.);小源凝胶图像分析系统(上海小源科技有限公司)。
1.2 方法
1.2.1 NYK药物血清的制备 雄性 SD大鼠 15只,随机分为正常对照组、VitE处理组和 NYK处理组,每组 5只。所有动物自由饮水,适度光照。正常对照组:喂养基本饲料观察 3 d后,用生理盐水 10.0 ml/kg灌胃。VitE处理组:将 VitE溶于菜油中,配成 0.125%的溶液,按10.0 ml/kg灌胃。NYK处理组:将中药颗粒加 ddH2O,配成 17.1%的水溶液,按 10.0 ml/kg灌胃(相当于临床成人用量)。各组大鼠每天灌胃 2次,连续3 d〔5〕,末次灌药后 1 h颈总动脉取血,4℃过夜,待全血凝固后,2 500 r/min离心 20 min,分离血清,经 56℃,30 min灭活,0.22μm滤膜过滤除菌,-70℃保存备用。
1.2.2 海马神经元的培养 取新生 24 h的 SD大鼠,无菌条件下取脑,分离双侧海马,剔除血管,用冰浴 D-Hank′s液洗 2次,剪碎,0.125%胰蛋白酶 2 ml,37℃消化 30 min,每 5 min振荡 1次。用等体积含 10%胎牛血清的 DMEM终止消化,吹打成细胞悬液,1 000r/min离心 10 min,弃上清,吹打分散细胞,分别经 60目和 200目的筛网过滤。计数后将细胞悬液稀释至所需密度接种于用 0.1 mg/ml多聚赖氨酸处理的培养板。48 h后加入终浓度为 10μmol/L阿糖胞苷作用 24 h更换新培养液,以后每 2天半量换液,培养 6 d的海马神经元用于实验。
1.2.3 分组与处理 将细胞分为正常对照组、模型组、VitE处理组、NYK处理组。正常对照组:培养 6 d的海马神经元,弃培养液,加入无血清 DMEM和 10%正常大鼠血清培养 24 h。模型组:培养 6d的海马神经元,弃培养液,加入无血清 DMEM、10%正常大鼠血清和 D-gal(D-gal终浓度为 100 mmol/L〔6〕)培养 24 h。VitE处理组:培养 6 d的海马神经元,加入无血清DMEM和 10%VitE药物血清后 1 h,再加入 D-gal培养 24 h。NYK处理组:培养 6 d的海马神经元,弃培养液,加入无血清DMEM和 NYK药物血清后 1 h,再加入 D-gal,其中药物血清分别以 5.0%、10.0%、20.0%稀释浓度添加〔7〕,培养 24 h。
1.2.4 MTT法检测NYK药物血清对D-gal诱导损伤后海马神经元存活率的影响 常规培养的海马神经元用含有 10%胎牛血清的 DMEM稀释成 5×105个/ml,每孔 100μl接种于 96孔培养板中,使各孔细胞数基本相同;培养板的第 1列不接种细胞而每孔只加无细胞 DMEM,作为空白调零孔。培养6 d后,弃培养液,设正常对照组、模型组、VitE处理组、NYK处理组,每组11个复孔。每孔加入 25μl MTT溶液(终浓度 1 mg/ml),孵育4 h,每孔再加入 100μl 20%SDS,继续孵育 24 h后取出,用酶标仪测定各孔在 570 nm处的光吸收值并计算出细胞存活率。细胞存活率 =实验组 OD/对照组 OD×100%。
1.2.5 生化指标的检测 常规培养的海马神经元用含有10%胎牛血清的 DMEM稀释成 5×105个/ml,每孔 1ml接种于24孔培养板中,使各孔细胞数基本相同;培养6 d,各组细胞按不同的要求处理,用于检测生化指标。收集细胞上清液检测MDA含量、SOD和 GSH-Px活力。细胞培养液直接加样检测。具体方法见试剂盒说明书。
1.2.6 检测海马神经元 Bcl-2 mRNA的表达 常规培养的海马神经元用含有 10%胎牛血清的 DMEM稀释成 1×106/ml,每孔 2 ml接种于 6孔培养板中,使各孔细胞数基本相同。培养6 d后各组按不同的要求处理,用于 RT-PCR检测。β-action:引物序列为上 游 5′-gcaccacactttctacaatga-3′,下游 5′-gaaccgctcattgccgatagt-3′,508bp;Bcl-2:引物序列为上游 5′-cgactttgcagagatgtcca-3′,下游 5′-catccacagagcgatgttgt-3′,202 bp。 按照 常规步 骤提取各组细胞的 RNA,并逆转录成 cDNA。按设定的程序进行PCR扩增反应。反应条件:Bcl-2:94℃ 3 min,94℃ 40 s,48℃ 30 s,72℃ 45 s(循环 35次),72℃ 10min。 β-action为内参。琼脂糖凝胶电泳鉴定 PCR产物,用 Scion Image图像分析软件对电泳结果进行分析,以目的基因带密度与内参 β-action带密度的比值表示该基因 mRNA相对含量。
1.3 统计学处理 所有数据均以 x±s表示,用 SAS7.0统计软件处理,进行方差分析和两两比较,对数据进行统计分析。
2 结 果
2.1 NYK药物血清对 D-gal诱导损伤后海马神经元存活率的影响 MTT法测定显示,各组海马神经元存活率均比正常对照组(细胞存活率设为 100%)低,模型组细胞存活率(0.367±0.104)显著降低(P<0.01)。与模型组相比,VitE处理组(0.882±0.749)、5%NYK处理组(0.826±0.129)、10%NYK处理组(0.794±0.257)、20%NYK处理组(0.736±0.166)存活率升高(P<0.01)。
2.2 NYK药物血清对D-gal诱导损伤后海马神经元 MDA含量、SOD、GSH-Px活力的影响 模型组 MDA含量显著高于正常对照组(P<0.01)。5%、10%NYK处理组 MDA含量显著低于模型组(P<0.01)。模型组 SOD及 GSH-Px活力显著低于正常对照组(P<0.01)。VitE处理组和 NYK处理组 SOD及GSH-Px活力显著高于模型组(P<0.01)。见表 1。
2.3 NYK药物血清对 D-gal诱导损伤后海马神经元 Bcl-2 mRNA表达的影响 模型组(0.76±0.16)海马神经元 Bcl-2 mRNA的表达水平与正常对照组(1.24±0.39)比较,有降低趋势,但差异无统计学意义(P>0.05)。VitE处理组、5%NYK处理组、20%NYK处理组海马神经元 Bcl-2 mRNA表达分别为1.17±0.27、1.33±0.34、1.07±0.10。 10%NYK处理组海马神经元 Bcl-2 mRNA的表达水平(1.48±0.62)高于模型组(P<0.05)。见图 1。
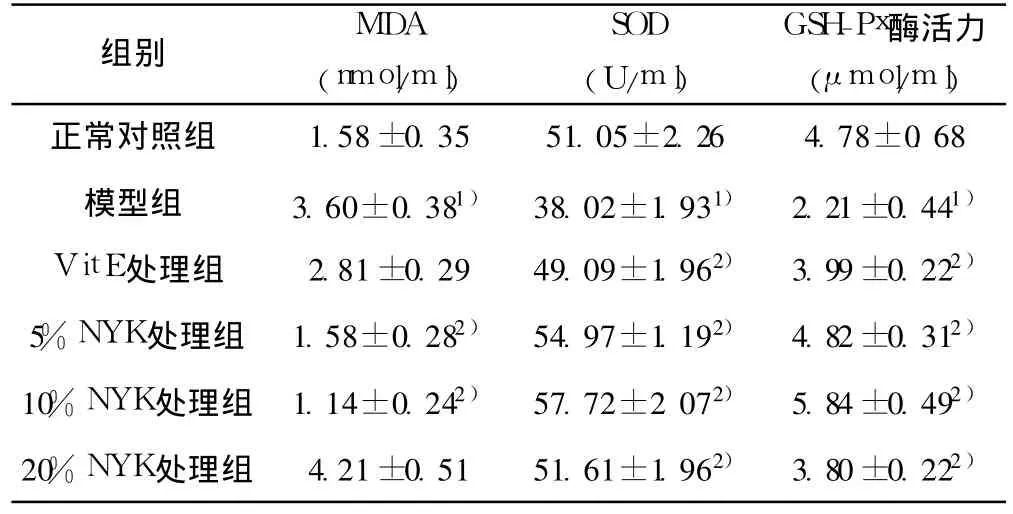
表1 各组海马神经元的 MDA含量和SOD、GSH-Px活力的比较(x±s,n=6)
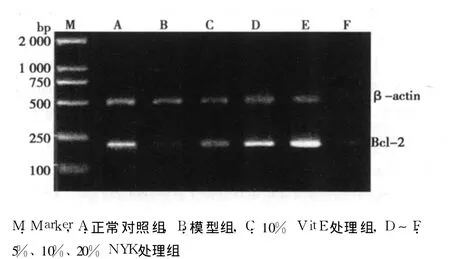
图1 各组海马神经元 Bcl-2mRNA的表达
3 讨 论
脑和神经是耗氧率较高的器官,因为含有大量的脂质,容易因自由基引起氧化应激而变得脆弱。在对神经内科疾病进行分类时发现,以脑卒中、AD、肌萎缩性侧索硬化症及 Parkinson病等与氧化应激的关系最为密切〔8〕。AD患者脑组织和全身各系统都存在氧化应激,氧化应激是 AD发生发展过程中的关键因素,在 AD早期 NFT和 SP出现之前就发挥作用〔1〕,最终可造成神经元损伤。因此,近年来自由基所致的氧化应激反应在AD中的作用受到人们的高度重视,而且自由基损伤在散发性 AD的病因学意义更是AD研究中最活跃的领域之一。许多研究表明老年人和 AD患者脑内抗氧化物质减少,自由基增多。当体内 D-gal过多时,可产生过多的氧自由基,造成氧化应激损伤〔9〕。故本研究采用 D-gal诱导海马神经元损伤,制备AD细胞模型,观察NYK药物血清通过抗氧化作用保护细胞,减少细胞凋亡的作用机制。
MTT可以间接反映活细胞的数量。GSH-Px是一种重要的催化H2O2分解的酶,SOD则主要清除超氧化物如。它们的活力降低,可造成脑内大量自由基的堆积,使许多生物大分子发生过氧化反应而交联、断裂,引起一系列异常的生化过程,以致细胞结构和功能破坏等。MDA是不饱和脂肪酸降解的产物,MDA的含量常可作为反映脂质过氧化程度及间接反映氧自由基对细胞损伤程度。此外Bc1-2基因家族中 Bcl-2是抑凋亡基因,同时也具有抗氧化剂作用,可以抑制超氧化物的产生;还可以诱导细胞内源性抗氧化物质表达,保护其活性,清除产生的自由基,起到抗凋亡作用〔10〕。本实验提示 NYK有一定的神经保护作用,适宜的剂量(5%和 10%)对 D-gal致海马神经元损伤的保护作用较好。其机制可能是通过提高神经元的抗氧化能力,降低海马神经元的 MDA含量,减轻自由基损伤,上调海马神经元 Bcl-2 mRNA的表达,从而发挥其细胞保护作用,减少细胞凋亡。
1 Ved C,Abha C.Oxidativestress in Alzheimer′s disease〔J〕.Pathophysiology,2006;13(3):195-208.
2 耿劲松,周爱玲,茅家慧,等 .脑益康对 AD大鼠学习记忆及海马NGF-TrkA mRNA表达的影响〔J〕.中国老年学杂志,2009;29(2):152-5.
3 朱 燕,周爱玲,茅家慧,等 .脑益康对 D-半乳糖和亚硝酸钠所致Alzheimer病小鼠模型的保护作用〔J〕.中国应用生理学杂志,2008;24(3):296-300.
4 胡亚娥,周爱玲,朱 燕,等.脑益康药物血清对谷氨酸诱导海马神经元损伤的保护作用〔J〕.中国应用生理学杂志,2007;23(3):300-3.
5 王 睿 .中药血清药理学研究进展〔J〕.齐齐哈尔医学院学报,2006;27(18):2243-4.
6 朱 燕,周爱玲,胡亚娥,等.脑益康含药血清对 D-半乳糖诱导海马神经细胞损伤的保护作用〔J〕.南通大学学报(医学版),2006;26(1):3-5.
7 胡亚娥,周爱玲.中药复方对原代培养海马神经元生长影响的时效和量效关系研究〔J〕.南通医学院学报,2004;24(4):363-4.
8 阿部康三.氧化应激与神经系统疾病〔J〕.日本医学介绍,2006;27(12):556-8.
9 Wang J,Xiong S,Xie C,et al.Increased oxidative damage in nuclear and mitochondrial DNA in Alzheimer′s disease〔J〕.J Neurochem,2005;93(4):953-62.
10 Ephrem E,Talin G,Rainer S,et al.Expression of apoptosis related proteins in brains of patients with Alzheimer′s disease〔J〕.Neurosci Lett,2001;303(2):79-82.
