小檗碱对高脂兔模型脂代谢及脂肪 PPARγ、INSIG-2基因表达的影响
2010-05-31周岐新杨俊霞
何 琦 金 磊 周岐新 杨俊霞
(重庆医科大学药理学教研室 重庆市生物化学与生子生物学重点实验室,重庆 400016)
黄连素学名小檗碱,有广泛的药理作用,在治疗阿尔茨海默病 (AD)、抗肿瘤、降血糖、调血脂等方面都有显著的作用。过氧化物酶体增殖物激活受体 (peroxisome proliferator activated receptor,PPAR)的一种亚型PPARγ,可控制脂肪的储存和释放,并维持机体能量平衡,调节胰岛素以及血糖的稳定,促进脂肪细胞基因的表达,在脂肪细胞分化的早期起正向调节作用〔1~3〕。胰岛素诱导基因 2(insulin induced gene 2,INSIG-2)是近年来发现的与脂质代谢和脂肪细胞分化密切相关的基因,其编码的 INSIG-2内质网膜蛋白,通过与胆固醇 (TC)调节元件结合蛋白 (sterol regulatory element-binding protein,SREBP)及 SREBP裂解活化蛋白 (SREBP cleavage activating protein,SCAP)相结合,从而影响 SREBP活化而阻断TC和脂肪酸的合成,在维持体内 TC代谢稳定方面具有十分重要的作用〔4,5〕。因此,PPARγ与 INSIG-2均与体内脂质代谢紊乱的发生和发展存在着密切的相关性。本实验以饮食诱导的兔高脂模型为研究对象,旨在探讨小檗碱调节血脂的作用,并进一步探讨其作用机制是否与 PPARγ、INSIG-2基因表达相关。
1 材料与方法
1.1 动物和试剂 清洁级雄性新西兰大耳白兔,40只,体重2.0~2.2 kg,由重庆医科大学实验动物中心提供(医学动物合格证:SCXK渝 20070003)。小檗碱购于四川鸿鸣植物制品有限公司,纯度≥97%,批号 080626;非诺贝特购于河南开封制药有限公司,纯度≥98%,批号 080527;RNA提取试剂 RNAiso Plus与实时荧光定量PCR试剂盒购于TaKaRa公司;PCR引物由上海生工设计并合成。
1.2 动物分组以及模型制作〔6〕40只白兔单笼饲养,自由摄食及饮水。以基础饲料适应性喂养 1 w后,随机选取 8只为普通饲料组 (ND),以基础饲料喂养。其余 32只以高脂饲料喂养 (饲料组成:每 10 kg基础饲料加 150 g TC、500 g猪油、1 kg鸡蛋),并随机分为高脂饲料组 (HFD);高脂饲料+阳性对照药非诺贝特组 (FD):高脂饲料基础上按30 mg◦kg-1◦d-1灌胃给予非诺贝特;高脂饲料 +小檗碱低剂量组 (BLD):高脂饲料基础上按 28 mg◦kg-1◦d-1灌胃给予小檗碱;高脂饲料 +小檗碱高剂量组 (BHD):高脂饲料基础上按 112 mg◦kg-1◦d-1灌胃给予小檗碱。每周称体重,实验期为 16w。
1.3 血脂的测定 分别于实验前和实验末禁食 12 h后兔耳缘静脉采血,离心分离血清,采用全自动生化分析仪检测血清TC、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。
1.4 实时荧光定量 PCR法检测脂肪组织 PPARγ和 INSIG-2基因表达 取兔肾周脂肪组织,在液氮下研磨,按RNAiso Plus试剂说明书提取总 RNA,紫外分光光度计定量并计算 A260/A280比值,琼脂糖凝胶电泳检测确保 RNA的完整性。反转录体系:5×PrimeScriptTMBuffer 2μl,PrimeScriptTMRT Enzyme MixⅠ0.5μl,Oligo dT Primer 0.5μl,Random 6mers 0.5μl,Total RNA 2μl(300ng),RNase Free d H2O补足至 10μl,混匀。反转录条件:37℃ 15 min,85℃ 5 s终止反应。 PPARγ基因上游引物:5′-AGGACATCCAGGACAACC-3′, 下 游 引 物:5′-GTCTCCGTCTTCTTTATCAC-3′;INSIG-2 基因 上 游引 物:5′-TGGACTGTGGTGGACTTT-3′;下 游 引 物:5′-TGTTTCCCATTGTTATGC-3′;内 参β-actin基因上游引物:5′-CGAGATCGTGCGGGACAT-3′,下游引物:5′-AGGAAGGAGGGCTGGAACA-3′。 PCR 反 应 体 系(25μl):SYBR Rremix Ex TaqTMⅡ 12.5μl,上下游引物(浓度10μmol/L)各 1μl,cDNA 2μl,灭菌蒸馏水 8.5μl,混匀。反应条件均为:95℃,预变性 5 s;95℃ 5s,55℃ 30s,72℃ 30s,循环40次。反应结束后自动生成溶解曲线,结果以 Ct值表示。以公式 F=2-△△Ct来计算各处理组和普食组之间目的基因的相对表达量。
1.5 统计学处理 实验数据用 x±s表示,采用 SPSS13.0统计分析软件进行统计分析,组间比较采用单因素方差分析(One-Way ANOVA)。
2 结 果
2.1 小檗碱对高脂兔血脂的影响 实验前各组家兔的血脂水平(TC、TG、LDL-C和 HDL-C)相近,无显著性差异。经 16 w营养干预后,HFD组、FD组、BLD组、BHD组与 ND组相比,TC、TG和 LDL-C浓度均显著升高(P<0.05),表明高脂兔模型建立成功。药物干预后,与 HFD组比较,BLD组中 TC、TG及LDL-C浓度均显著降低(P<0.05),BHD组 TC、TG浓度显著降低(P<0.05),而 FD组则只有 TG浓度显著降低(P<0.05)。由此可见非诺贝特具有降低血清TG的作用,而小檗碱则对血清 TG、TC和 LDL-C均有降低作用,以低剂量小檗碱作用更突出。见表 1。
2.2 小檗碱对高脂兔脂肪组织 PPARγ、INSIG-2基因表达的影响 结果显示 HFD组PPARγ和INSIG-2mRNA表达明显高于 ND组(P<0.05);药物干预后,BLD、BHD、FD组 PPARγ mRNA表达较HFD组有明显下降(P<0.05),其中BLD组作用最强,FD组次之。而 BLD、BHD、FD组 INSIG-2 mRNA表达则较 HFD组明显升高(P<0.05),其中 FD组作用最强,BLD组次之。见图 1。
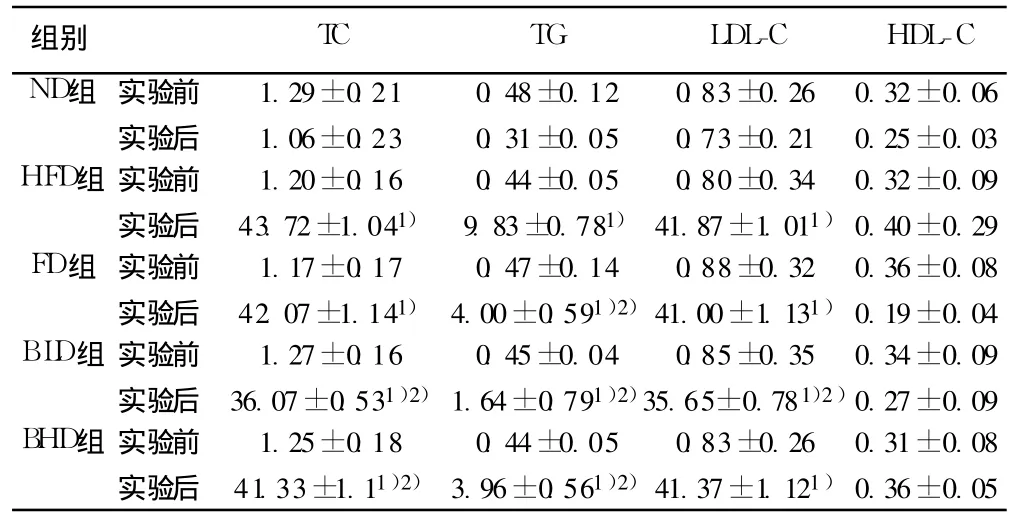
表1 小檗碱对高脂兔血脂的影响(mmol/L,x±s,n=8)

图1 小檗碱对兔脂肪组织 PPARγ、INSIG-2基因 m RNA表达的影响
3 讨 论
在体和离体研究表明小檗碱具有改善胰岛素抵抗、降低血糖、纠正脂质代谢紊乱的作用,但无促进胰岛素分泌作用,推测小檗碱是通过胰岛素外机制降低血糖,加之药代动力学显示小檗碱在脂肪组织中的浓度最高,提示脂肪细胞是小檗碱的主要靶细胞〔7〕。现代研究认为小檗碱具有良好的降颓、降脂、提高胰岛素敏感性及改善胰岛素抵抗的作用〔8〕,但尚未能在更深层面上揭示其作用靶点和具体作用机制。PPARγ是调节脂肪生成相关的基域,在脂肪细胞中浓度较高,是诱导脂肪细胞分化的特异性转录因子,研究发现小檗碱促进 3T3-L1前脂肪细胞的增殖和降低脂肪细胞胞浆中脂肪的堆积;降低脂肪细胞PPARγmRNA的表达和抑制PPARγ蛋白质水平。最新发现小檗碱抑制 3T3-L1脂肪细胞分化是通过 PPAR信号通路实现的〔9〕。INSIG-2是新近发现的参与调控脂肪代谢的分布在内质网上的膜蛋白,通过与SCAP/SREBP复合物结合,使其滞留在内质网,阻止 SREB进入高尔基体进行两次蛋白酶解加工活化,进而阻断脂肪细胞的脂质合成和分化〔10〕。有研究证明INSIG-2过表达能减少Zucker糖尿病肥胖大鼠和禁食再喂正常大鼠的脂肪合成〔11〕。
本实验结果显示,小檗碱可以明显降低血清 TG、TC以及LDL-C的浓度,其中低剂量组效果更明显,证明小檗碱具有良好的降血脂作用。通过实时荧光定量 PCR检测脂肪组织PPARγ基因表达可见,高脂组 PPARγmRNA表达明显高于普食组,而小檗碱灌胃给药后,与高脂组相比,可显著降低 PPARγ mRNA表达,由此推测小檗碱可通过抑制 PPARγ的转录活性,进而抑制其下游靶基因中涉及脂肪细胞分化的如脂肪细胞结合蛋白 2(aP2)、细胞分化抗原(CD36)、乙酰辅酶 A氧化酶(ACO)、脂蛋白脂酶(LPL)等脂肪细胞分化成熟标记物,从而抑制前脂肪细胞向成熟脂肪细胞的分化,减少脂肪细胞分化过程中脂质的堆积。对脂肪组织INSIG-2基因表达检测结果显示,高脂组INSIG-2 mRNA表达较普食组明显上调,在小檗碱干预后,INSIG-2 mRNA表达较高脂组显著升高,其中低剂量组上调作用更为明显,这可能是由于 INSIG-2基因参与 TC合成的调节,同时其自身的表达也受细胞内 TC浓度的影响,当TC升高时促进 INSIG-2基因表达以抑制TC的合成,当胆固醇降低时则反馈性抑制 INSIG-2基因表达。因此,高脂组随着 TC合成增加而出现代偿性 INSIG-2基因过表达,而高剂量小檗碱则可能与肝细胞内胆固醇合成减少而反馈性下调,而出现对INSIG-2上调作用弱于低剂量小檗碱的现象。由此可见,小檗碱可通过促进 INSIG-2表达,而控制脂质合成与脂肪细胞分化,防止过多的脂质贮藏。综上所述,本研究证明小檗碱具有明显的降血脂作用,其作用机制与下调脂肪组织 PPARγ基因表达、而上调 INSIG-2基因表达有关。
1 Rosen ED,Spiegelman BM.PPAR gamma:a nuclear regulator of metabolism,differentiation,and cell growth〔J〕.J Biol Chem,2001;276(41):37731-4.
2 Knouff C,Auwerx J.Peroxisome proliferator-activated receptor-gamma calls for activation in moderation:lessons from genetics and pharmacology〔J〕.Endocr Rev,2004;25(6):899-918.
3 Lehrke M,Lazar MA.The many faces of PPARgamma〔J〕.Cell,2005;123(6):993-9.
4 Attie AD.Insig:a significant integrator of nutrient and hormonal signals〔J〕.JClin Invest,2004;113(8):1112-4.
5 Krapivner S,Popov S,Chernogubova E,et al.Insulin-induced gene 2 involvement in human adipocyte metabolism and body weight regulation〔J〕.J Clin Endocrinol Metab,2008;93(5):1995-2001.
6 常 伟,王 红,尹华峰,等.小檗碱对胆固醇代谢及肝脏 Insig-2基因表达的影响〔J〕.中国药理学通报,2009;25(1):85-8.
7 Yin J,Hu R,Chen M,et al.Effects of berberine on glucose metabolism in vitro〔J〕.Metabolism,2002;51(11):1439-43.
8 魏 敬,吴锦丹,蒋建东,等 .盐酸小檗碱治疗 2型糖尿病合并脂肪肝的临床研究〔J〕.中西医结合肝病杂志,2004;14(6):334-6.
9 Huang C,Zhang Y,Gong Z,et al.Berberine inhibits 3T3-L1 adipocyte differentiation through the PPAR gamma pathway〔J〕.Biochem Biophys Res Commun,2006;348(2):571-8.
10 Yabe D,Brown MS,and Goldstein JL.Insig-2,a second endoplasmic reticulum protein that binds SCAP and blocks export of sterol regulatory element-binding proteins〔J〕.Proc Natl Acad Sci USA,2002;99(20):12753-8.
11 Takaishi K,Duplomb L,Wang MY,et al.Hepatic insig-1 or-2 overexpression reduces lipogenesis in obese Zucker diabetic fatty rats and in fasted/refed normal rats〔J〕.Proc Natl Acad Sci USA,2004;101(18):7106-11.
