结肠癌患者转录因子 Snail mRNA和蛋白的表达及临床意义
2010-05-31陆洪军王淑秋刘振平任翊华
陆洪军 王淑秋 刘振平 任翊华
(佳木斯大学第一附属医院普通外科,黑龙江 佳木斯 154002)
在肿瘤的生物学行为中,浸润和转移是最重要的特征,也是一些实质性肿瘤难以治愈的原因。尽管外科手术治疗、放射治疗和化学治疗日益完善,但如何早期诊断,及时正确治疗,抑制恶性肿瘤浸润和转移,提高患者的生存率已成为当今肿瘤防治的重要课题。研究证实,上皮-间充质转化(epithelial-mesenchymal transition,EMT)是包括结肠癌在内的许多肿瘤细胞获得侵袭、转移能力的重要机制。转录因子Snail通过与E-cadherin启动子区的 E-盒(E-box)结合,下调 E-cadherin的表达,进而诱导 EMT的发生,促使肿瘤细胞侵袭转移〔1〕。本文旨在探讨转录因子 Snail在结肠癌中的表达,以判定该转录因子在结肠癌侵袭、转移中的作用。
1 对象与方法
1.1 对象 2007年1月至 2008年 8月,在本院行根治性手术的大肠癌患者 68例,男 42例,女 26例;年龄 32~75岁(中位年龄 57.3岁);术中留取标本。所有病例术前均未接受化疗及放疗。①肿瘤部位:左半结肠 38例、右半结肠 30例;②肿瘤大小:≤5cm者 48例、>5cm者20例。③组织学分型:乳头状腺癌 4例,管状腺癌 48例,黏液腺癌 11例,印戒细胞癌 5例;④分化程度:高分化腺癌 24例,中分化腺癌 30例,低分化腺癌 14例;⑤浸润深度:未及浆膜层 25例,浸及浆膜层 43例;⑥淋巴结转移:有转移 18例,无转移 50例;⑦Dukes分期:A期 32例,B期 20例,C期 11例,D期 5例。另取 20例结肠癌正常肠段的肠黏膜(经病理检查无异常)作对照。
所用试剂为兔抗人Snail多克隆抗体(购自 Santa Cruz公司);逆转录酶试剂盒(购自 Promega公司);Trizol试剂(购自美国宝生公司)。
1.2 方法
1.2.1 Snail mRNA检测 按 Trizol试剂盒说明提取总 RNA。用紫外分光光度仪测定 A 260/A 280,比值在 1.9~2.0之间,计算 RNA含量。引物设计:(1)上游引物:5′-AATCGGAAGCCTAACTACAG-3′;下 游引物 :5′-GGAACAGGCTGAAGTAGAG-3′(扩增长度 320 bp)。 (2)GAPDH:上游引物:5′-ACCACAGTCCATGCCATCAC-3′;下 游 引 物:5′-TCCACCACCCTGTTGCTGTA-3′(扩增长度 452 bp,为内参照)。逆转录反应按试剂盒操作。RT-PCR产物用 2%琼脂糖凝胶电泳分离检测。
1.2.2 Snail蛋白的检测 Western印迹法。总蛋白提取:4℃收集细胞,每孔加入 100μl细胞裂解液(50 mmol/L Tris-HCl、150 mmol/L NaCl、5 mmol/L pH 8.0 EDTA、1%NP40、0.05%PMSF、2μg/ml Aprotinin、0.5 μg/ml Leupeptin),超声破碎,4℃12 000 r/min离心 5 min,收集上清液。细胞核蛋白提取:参照文献方法〔2,3〕,略改动。蛋白质样品与等体积 2×上样 buffer混匀,煮沸 5min,紫外分光光度计测定蛋白质浓度。按蛋白含量测定结果每孔上样 50μg,12.5%SDS-PAGE分离样品。低温100V 3 h将蛋白转至硝酸纤维膜上,用封闭液(5%脱脂奶粉、3%BSA、0.02%Tween-20溶于 PBS)室温封闭 2 h,将膜与溶于封闭液中的一抗(兔抗人 Snail多克隆抗体 1∶500)室温孵育2 h,PBS洗 5 min×3次,TBS洗5 min×4次,将膜与溶于二抗稀释液 (5%脱脂奶粉、0.02%Tween-20、150 mmol/L NaCl、50 mmol/L Tris-HCl,pH7.5)中的二抗室温孵育 1 h,TBS洗5 min×4次,将膜装入可热接封的塑料袋中,加入 ECL试剂,暗室曝光、显影、定影,对 X光底片拍照保存。
1.3 统计学处理 所有数据均采用x±s表示,应用 SPSS13.0统计软件对数据进行分析。各组Snail mRNA相对水平经方差齐性检验后采用 Student-t检验。
2 结 果
2.1 结肠癌组织Snail mRNA表达与临床病理因素的关系Snail mRNA在结肠癌中的表达水平与性别、年龄、肿瘤部位及大小无关(P>0.05),而与肿瘤浸润深度、组织学分型、分化程度、淋巴结转移及 Dukes分期均有关。Snail mRNA在黏液癌(印戒细胞癌、黏液腺癌)、低分化、浸及浆膜、有淋巴结转移及处于 Dukes C+D期的结肠癌组织中表达均明显增高(P<0.05,P<0.001)。Snail与结肠癌肿瘤细胞的侵袭、转移密切相关。见表 1。
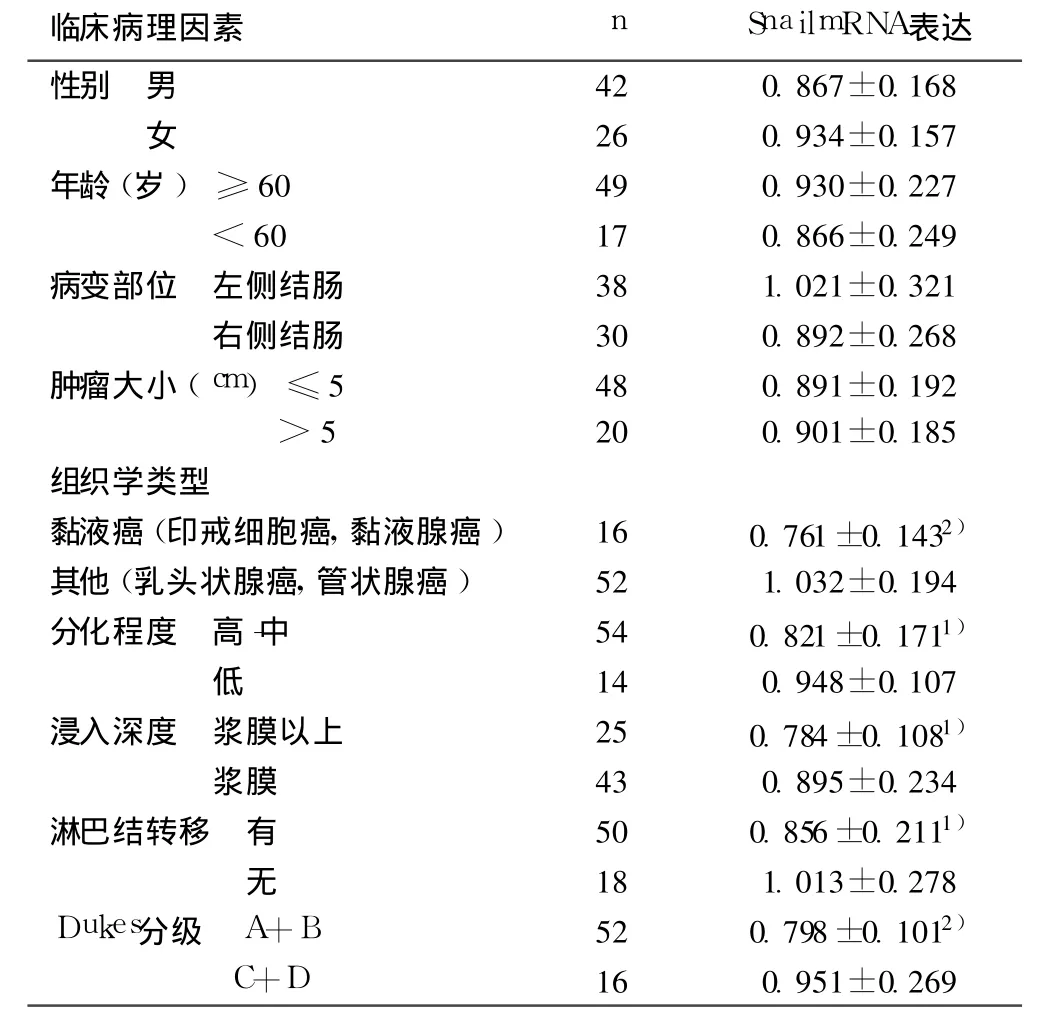
表1 结肠癌组织Snail mRNA表达指数与临床病理因素间的关系(x±s)
2.2 结肠癌和癌旁组织 Snail mRNA及其蛋白的表达 结肠癌组织与癌旁正常肠黏膜组织中均有 Snail mRNA表达,但与正常结肠上皮相比较,结肠癌 Snail mRNA的表达升高(P<0.01)。见表 2和图 1。结肠癌 Snail P30条带较正常对照组加宽加深,应用Chen Image 5500v2.03软件计算蛋白平均灰度值,结果显示 Snail蛋白表达与正常结肠上皮相比较,有显著差异(P<0.001)。见表 2和图 2。
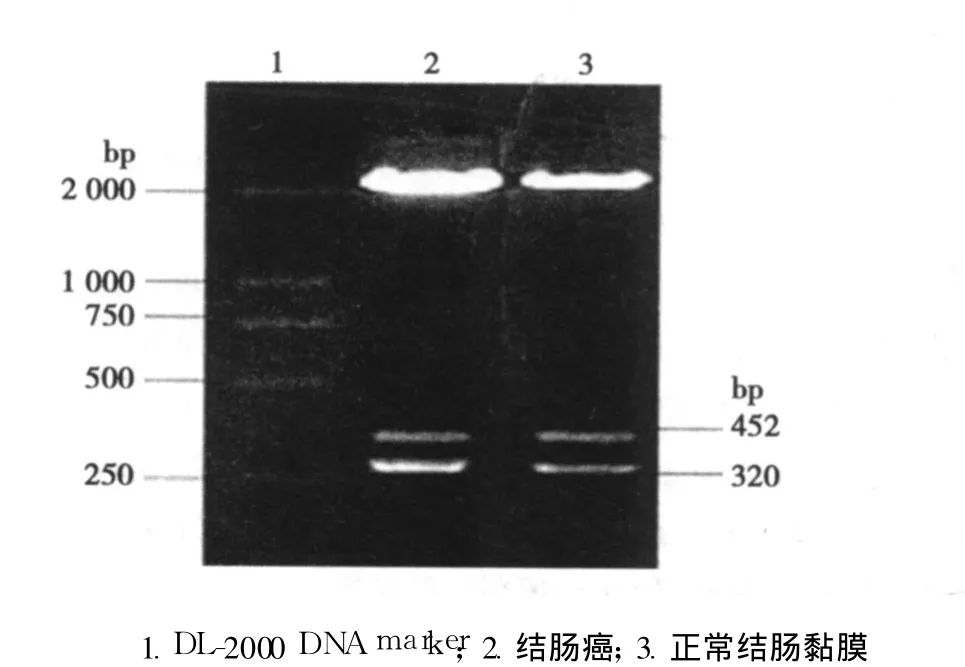
图1 Snail m RNA的表达

表2 结肠癌和癌旁正常肠黏膜组织中Snail m RNA及其蛋白的表达(x±s)

图2 Snail P30的表达
3 讨 论
EMT是指上皮细胞在特定的生理和病理条件下向间充质细胞转化的现象,是许多肿瘤细胞获得侵袭、转移能力的重要机制〔4〕。EMT在个体胚胎发育、组织形成、伤口愈合和慢性炎症中,均发挥着重要作用〔5〕。研究证实,Snail参与了包括乳腺癌、胃癌和鳞状上皮细胞癌在内的某些肿瘤细胞发生EMT并促进其侵袭转移〔6~8〕。 Snail可使细胞 E-钙黏素及 α、β 、γ-连环素等上皮细胞标志物表达降低或消失,可表达成纤维细胞特异性蛋白-1、N-连环素等多种间充质细胞标志蛋白,且可增强肿瘤细胞侵袭和转移能力。在一定条件下逆转 EMT表型时,就可以降低肿瘤细胞的侵袭转移能力并延长荷瘤动物的生存期。
Snail通过以下机制引起肿瘤侵袭转移:①作用于启动子上的 E-boxes连接基序,直接抑制 E-cadherin、claudins、occludins等上皮黏附位点成分的转录,使细胞间黏附紊乱;②抑制ABLIM-l、EPLIN等细胞骨架成分表达,使细胞骨架重组;③促进基质金属蛋白酶表达,降解基质以促进细胞侵袭。研究证实,Snail引起的EMT在肿瘤转移过程中发挥重要作用,但不是惟一的,免疫抑制也起着一定作用〔9〕。
本研究表明:(1)结肠癌组织和癌旁正常组织Snail mRNA及其蛋白表达间存在差异:结肠癌组织 Snail mRNA及其蛋白表达增加,提示Snail的高表达是结肠癌的发生、发展过程中的重要事件。(2)Snail mRNA及其蛋白的表达与组织学类型、分化程度、浸润深度、有无淋巴结转移、Dukes分期均有关:在黏液癌、低分化、侵及浆膜、有淋巴结转移和处于 Dukes C+D期的结肠癌中 Snail mRNA及其蛋白表达明显升高,同样提示 Snail的表达增加可以评价结肠癌的浸润、转移。
1 Shirakihara T,Saitoh M,Miyazono K.Differential regulation of epithelial and mesenchymal markers by delta EF1 proteins in epithelial mesenchymal transition induced by TGF-beta〔J〕.Mol Biol Cell,2007;18(9):3533-44.
2 Samy TA,Ayala A,Catania RA,et al.Trauma-hemorrhage activates signal transduction pathways in mouse splenic T cells〔J〕.Shock,1998;9(6):443-50.
3 Dignam JD,Lebovtz RM,Roeder RG.Accurate transcription initiation by RNA polymerase II in a soluble extract from isolated mammalian nuclei〔J〕.Nucleic Acids Res,1983;11(5):1475-89.
4 Thomson S,Buck E,Petti F,et al.Epithelial to mesenchymal transition is a determinant of sensitivity of non-small-cell lung carcinoma cell lines and xenografts to epidermal growth factor receptor inhibition〔J〕.Cancer Res,2005;65(20):9455-62.
5 Epithelial-Mesenchymal Transitions in development and disease:old viewsand new perspectives〔J〕.Int J Dev Biol,2008;10.
6 Côme C,Magnino F,Bibeau F,et al.Snail and slug play distinct roles during breast carcinoma progression〔J〕.Clin Cancer Res,2006;12(18):5395-402.
7 Castro AC,Rosivatz E,Schott C,et al.Slug is overexpressed in gastric carcinomas and may act synergistically with SIP1 and Snail in the downregulation of E-cadherin〔J〕.JPathol,2007;211(5):507-15.
8 Usami Y,Satake S,Nakayama F,et al.Snail-associated epithelial-mesenchymal transition promotes oesophageal squamous cell carcinomamortality and progression〔J〕.J Pathol,2008;215(3):330-9.
9 Kudo-Saito C,Shirako H,Takeuchi T,et al.Cancer metastasis is accelerated through immunosuppression during Snail-induced EMT of cancer cells〔J〕.Cancer Cell,2009;15(3):195-206.
