Li-Fe-Si-H2O体系的热力学分析
2010-05-31张有新曹才放刘旭恒赵中伟
张有新,曹才放,刘旭恒,赵中伟
(中南大学 冶金科学与工程学院,湖南 长沙,410083)
橄榄石型LiFePO4正极材料具有原料丰富、价廉、无毒、环境友好、理论比容量高(170 mA·h/g),与其他锂离子电池正极材料相比,它的工作电压适中(Li/Li+为3.45 V),充放电电压变化平缓,循环性能、高温性能和安全性能优良等优点[1-6],顺应了锂离子电池的发展,成为近年来研究和开发的热点。由于Li2FeSiO4的成功开发与应用,人们开始对Li-Fe-Si-O系进行研究。Fe-Si-O系在自然界大量存在,具有成本低、无毒、环境友好等特点。目前,对Li2FeSiO4研究的相关报道较少,主要制备方法是高温固相法[7]、水热法[8]、溶胶凝胶-高温固相合成[9-10]。高温固相合成具有工艺简单、容易实现工业化等优点,但是,产品粒度大、粒度分布较宽,需要长时间高温处理。采用液相合成法,反应物可以实现均一混合,合成产物的粒度小、粒度和形貌可控、粒度分布窄,可以在低温下完成反应。本文作者对锂、铁、硅等在水溶液中的化学特性进行热力学分析, 绘制 Li-Fe-Si-H2O体系溶解组分的lgc-pH图(25 ℃时)、Li-Fe-Si-H2O体系主要物种的优势区图(25 ℃时)以及强碱性区域Li-Fe-Si-H2O体系各沉淀的优势区图(25 )℃,并对合成Li2FeSiO4的可行性进行简单分析,以期为进一步研究Li2FeSiO4提供一定的理论指导。
1 溶解组分lgc-pH图的绘制
Li2H2SiO4·Fe(OH)2,FeH2SiO4·Fe(OH)2,Li2H2SiO4和 FeH2SiO4的生成自由能的生成自由能分别满足式(1)~(4):
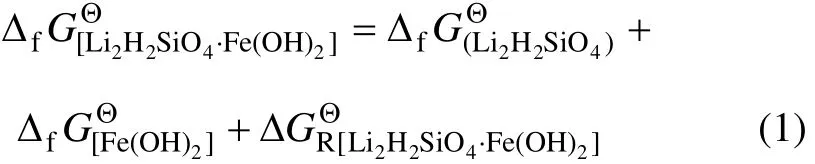
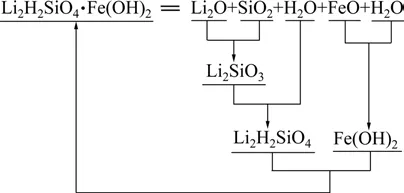
图1 复杂硅酸盐Li2H2SiO4·Fe(OH)2的生成方式Fig.1 Formation reaction of complicate silicate Li2H2SiO4·Fe(OH)2
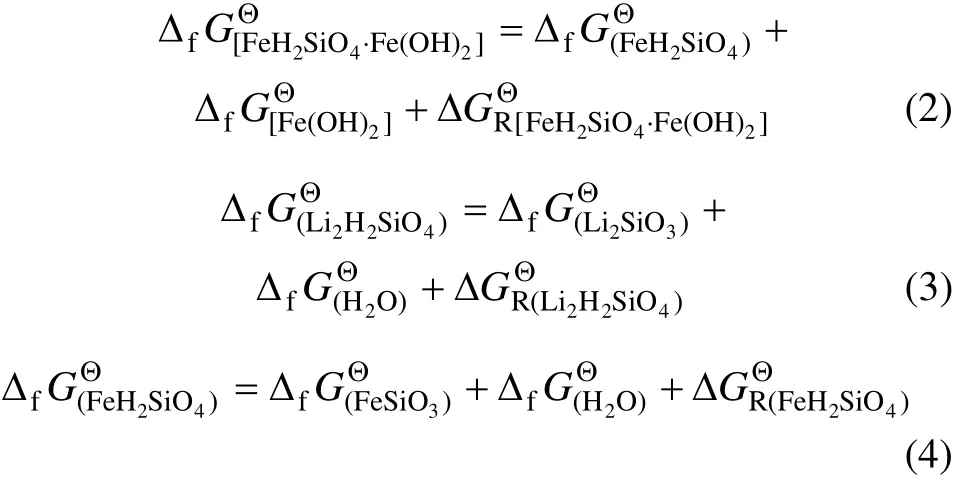
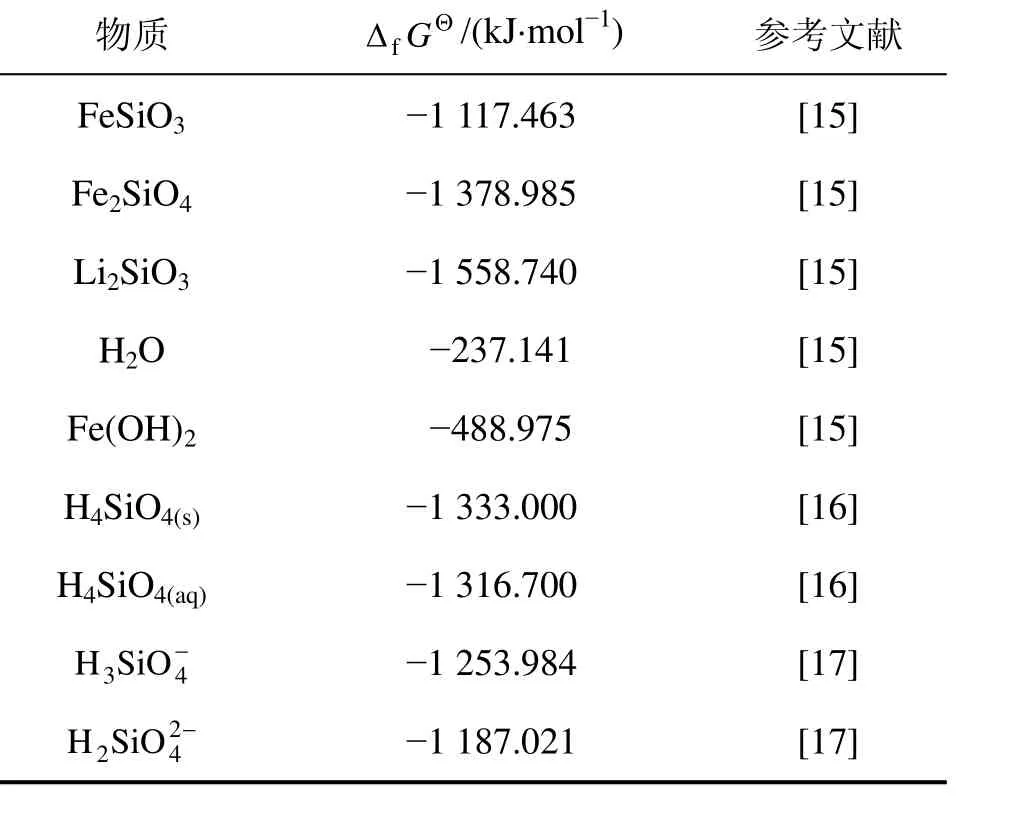
表1 Li-Fe-Si-H2O体系部分物种的热力学数据Table 1 Thermodynamic data of some species in Li-Fe-Si-H2O system
利用表 1中数据,通过公式(2)~(4)可求得Li2H2SiO4,FeH2SiO4和 FeH2SiO4·Fe(OH)2的 ΔfGΘ分别为-1 795.881,-1 354.604 和-1 853.267 kJ/mol。
沉淀物的溶度积可通过溶解平衡反应的自由能变化 Δ GΘ求得,公式如下:
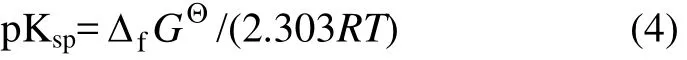
其中:R为8.3145 J/(mol·K);T为热力学温度,取298.15 K。利用表1的数据,可求得FeH2SiO4,Li2H2SiO4,FeH2SiO4·Fe(OH)2和H4SiO4的pKsp分别为15.54,3.90,33.97和24.23。Li-Fe-Si-H2O体系所涉及的平衡反应及其平衡常数见表 2。在缺少有关离子活度系数的情况下,下面计算均以浓度代替活度。

表2 25 ℃时Li-Fe-Si-H2O体系的平衡反应及其平衡常数Table 2 Equilibrium reactions and constants for Li-Fe-Si-H2O system at 25 ℃
溶液中游离Li,Fe和Si的存在形态有Li+,Fe2+,FeOH+,Fe(OH)2(aq),F e (OH)3-,F e (OH)24-,H2SiO24-,H3SiO-和H4SiO4(aq),由平衡关系式(6)~(11)可知,它4们的平衡浓度满足以下方程:


体系内可能存在的固体有FeH2SiO4,Li2H2SiO4,H4SiO4,Fe(OH)2和 FeH2SiO4·Fe(OH)2,由平衡关系式(1)~(5)可知,某一固体存在时,与之相关的游离组分应满足其溶度积限定的平衡浓度:

由表 1数据可得,FeH2SiO4和 Fe(OH)2生成FeH2SiO4·Fe(OH)2的ΘΔG 为负,说明Fe(OH)2存在时,FeH2SiO4容易与之反应生成 FeH2SiO4·Fe(OH)2。经过计算,在 pH>6.5的中性至碱性区域内,FeH2SiO4·Fe(OH)2比 FeH2SiO4稳定;pH=5.8~6.5 时,FeH2SiO4能稳定存在;pH<5.8时,FeH2SiO4结合H+生成H4SiO4。
由于 Li2H2SiO4在碱性条件下容易生成,根据式(5)~(15),计算了pH>7时Fe-Si-H2O体系各溶解组分的 lgc-pH图,然后,根据该体系 H2浓度以及Li2H2SiO4的溶度积,计算 Fe-Si-H2O体系中能生成Li2H2SiO4的Li+平衡浓度线,结果如图2所示。在图2的基础上绘制Li-Fe-Si-H2O体系主要物种的优势区图以及强碱性区域各沉淀的优势区图(25 ℃),分别如图3和图4所示。
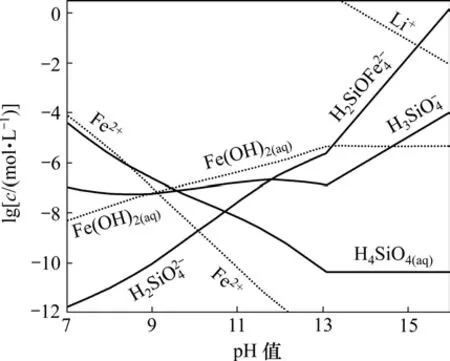
图2 25 ℃时Fe-Si-H2O体系溶解组分的lgc-pH图Fig.2 lgc-pH diagram for Fe-Si-H2O system at 25 ℃
从图 3可知:FeH2SiO4·Fe(OH)2在中性至碱性范围内稳定存在,在强碱性条件下能分解为Fe(OH)2(s)。而Li2H2SiO4(s)仅在碱性较强、 H2SiO24-浓度较高的情况下生成,其优势区在图3中右上角虚线以上部分。

图3 25 ℃时Li-Fe-Si-H2O体系主要物种的优势区图Fig.3 Predominance area phases diagram for Li-Fe-Si-H2O system at 25 ℃
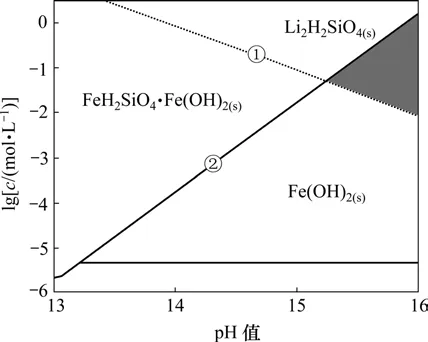
图4 25 ℃时强碱性区域Li-Fe-Si-H2O体系各沉淀的优势区图Fig.4 Predominance area phases diagram for Li-Fe-Si-H2O system in strong alkaline solutions at 25 ℃
2 分析与讨论
通过对Li-Fe-Si-H2O体系的热力学分析可知:若要在水溶液中合成硅酸铁锂的前驱物,则必须保证较强的碱性。通常硅源采用正硅酸、偏硅酸、胶态化的二氧化硅,再采用可溶性的二价铁源,氢氧化锂为原料来制备硅酸铁锂。由于晶化所得的产物结晶程度不是很好或者只形成1种共沉淀形态的混合物,因此,通常需后续的高温煅烧才能得到晶型完整的硅酸铁锂,大多数液相法合成粉体材料时往往都需要高温煅烧过程。例如,Dominko等[8]以胶态化的二氧化硅、氯化亚铁、氢氧化锂为原料,在不锈钢高压釜中于150℃保温14 d,制备出灰绿色粉末,将粉末在700 ℃煅烧得到了硅酸铁锂。当pH值大于15时,溶液中的Fe2+极容易被氧化,即使采取措施控制沉淀过程的还原性氛围,也很难控制 Fe2+在后续过滤洗涤的阶段不被氧化。
目前,已报道制备硅酸铁锂的方法主要为固相合成法。与液相合成法类似,固相法仍然需要保证较高的碱度。固相法往往可采用乙酸亚铁、草酸亚铁和氧化亚铁为铁源,以乙酸锂、草酸锂、碳酸锂和氢氧化锂为锂源。在固相合成过程中,铁或锂的草酸盐、乙酸盐和碳酸盐在高温下分解为碱性的氧化亚铁或氧化锂,固相碱度随着酸性气体CO2的挥发而逐步增加。因此,固相法仍然是在碱性较高的还原性氛围下进行。固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于制备。对于固/固反应,其反应速率比液相反应或者液/固反应进行得更慢;因此,研究者们通过不同的手段来强化反应,以提高反应速率。机械化学法在强化过程方面有很强的优势。机械化学法主要是将机械能转化为化学驱动力,提高反应体系的自由能,使反应物质发生化学变化或物理变化,从而加快反应速度或者降低反应所需的条件。Armand等[18]以FeO和Li2SiO3作为原料,球磨后在800 ℃烧结4 h得到硅酸铁锂。Nyten等[7]采用FeC2O4·H2O和Li2SiO3为原料,在球磨过程中加入10%的碳凝胶,在CO/CO2气氛中于750 ℃烧结24 h,合成了Li2FeSiO4材料,在 60 ℃进行充放电,首次充电比容量为 165 mA·h/g(理论容量的 99%),首次放电比容量为 140 mA·h/g(理 论 容 量 的 84%)。Zaghib 等[19]采 用FeC2O4·H2O和Li2SiO3为原料,球磨后在800 ℃烧结12 h得到了Li2FeSiO4材料。X线衍射分析结果表明:该材料为单一相结构,平均微晶粒尺寸为78 nm。
还有研究人员采用溶胶凝胶法制备前驱物,然后在高温下煅烧前驱物而制备得硅酸铁锂。在这种方法中,溶胶凝胶过程主要是为了获得胶态化二氧化硅,与锂源、铁源混合更均匀;而后续的烧结过程与高温固相合成相类似,随着前驱物的分解,酸性气体不断移除,固相碱度逐步升高至强碱性。Gong等[10]通过乙酸锰、乙酸锂、草酸亚铁和正硅酸乙酯与蔗糖一起球磨混合,球磨后在氮气保护下于 600 ℃烧结 10 h得到Li2MnFeSiO4材料,放电比容量为214 mA·h/g(理论容量的86%)。Gong等[20]将乙酸锂、草酸亚铁盐和正硅酸乙酯在水和乙醇体系中反应24 h,再蒸发乙醇得到前驱体,在前驱体中加入蔗糖,并通过高温煅烧得到Li2MnFeSiO4/C材料。杨勇[21]提出Li2MSiO4(M=Mn1-xFex)作为可充锂电池正极材料的制备方法,制备时将锂盐、锰盐、亚铁盐和正硅酸乙酯在水和乙醇体系中混合,加热后烘干并通过高温煅烧得到硅酸铁锰锂材料。
结合上述热力学分析,本文作者在合成Li2FeSiO4方面进行了初步探索。试验的具体过程是:将氢氧化锂、草酸亚铁、二氧化硅按物质的量比 2∶1∶1混合,在无水乙醇介质中抽真空进行球磨2 h,球磨后的前驱体转移至管式炉中,在高纯氮气的保护下于750 ℃烧结15 h,随炉冷却至室温,研磨得到Li2FeSiO4材料。Li2FeSiO4样品的衍射峰与 Nyten等[7-9]报道的结果一致。
3 结论
(1) 根据已有的热力学数据,绘制出 25 ℃时Li-Fe-Si-H2O体系溶解组分的lgc-pH图,Li-Fe-Si-H2O体系主要物种的优势区图,强碱性区域 Li-Fe-Si-H2O体系各沉淀的优势区图。
(2) 在强碱性体系,通过控制 H2SiO24-和Li+的浓度,可以制备出Li2H2SiO4·Fe(OH)2前驱体,且体系的碱性越强,Li2H2SiO4·Fe(OH)2的优势区域越宽,这更有利于合成出Li2H2SiO4·Fe(OH)2前驱体。
(3) 从热力学理论对液相法制备硅酸铁锂进行了分析。采用固相法制备硅酸铁锂,其保护性气氛容易控制,工艺简单,流程短,便于制备。
[1] Andersson A S, Thomas J O, Kalska B, et al. Thermal stability of LiFePO4-based cathodes[J]. Electrochemical and Solid-state Letters, 2000, 3(2): 66-68.
[2] Paolo P P, Maria C, Silvera S, et al. A new synthetic route for preparing LiMnPO4with enhanced electrochemical performance[J]. J Electro Chem Soc, 2002, 149(7): A886-890.
[3] Zhao H C, Dahn J R. Reducing carbon in LiFePO4/C composite electrodes to maximize specific energy, volumetric energy, and tap density[J]. J Electrochem Soc, 2002, 149(9): A1184-A1189.
[4] 赵中伟, 刘旭恒. Li-Fe-P-H2O系热力学分析[J]. 中国有色金属学报, 2006, 16(7): 1257-1263.ZHAO Zhong-wei, LIU Xu-heng. Thermodynamic analysis of Li-Fe-P-H2O system[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(7): 1257-1263.
[5] 张宝, 罗文斌, 李新海, 等. LiFePO4/C锂离子电池正极材料的电化学性能[J]. 中国有色金属学报, 2005, 15(2): 300-304.ZHANG Bao, LUO Wen-bin, LI Xin-hai, et al. Electrochemical properties of LiFePO4/C for cathode materials of lithium ion batteries[J]. The Chinese Journal of Nonferrous Metals, 2005,15(2): 300-304.
[6] 陈学军, 赵新兵, 曹高劭, 等. 一步固相合成 Nb 掺杂LiFePO4/C及其电化学性能[J]. 中国有色金属学报, 2006,16(10): 1665-1670.CHEN Xue-jun, ZHAO Xin-bing, CAO Gao-shao, et al.Electrochemical properties of Nb doped LiFePO4/C prepared by one-step solid-state synthesis[J]. The Chinese Journal of Nonferrous Metals, 2006, 16(10): 1665-1670.
[7] Nytén A, Abouimrane A, Armand M, et al. Electrochemical performance of Li2FeSiO4as a new Li-battery cathode material[J]. Electrochemistry Communications, 2005, 7(2):156-160.
[8] Dominko R, Bele M, Gaberscek M, et al. Structure and electrochemical performance of Li2MnSiO4and Li2FeSiO4as potential Li-battery cathode materials[J]. Electrochemistry Communications, 2006, 8(2): 217-222.
[9] Dominko R, Conte D E, Hanzel D, et al. Impact of synthesis conditions on the structure and performance of Li2FeSiO4[J].Journal of Power Sources, 2008, 178(2): 842-847.
[10] GONG Zheng-liang, LI Yi-xiao, YANG Yong. Synthesis and characterization of Li2MnxFe1-xSiO4as a cathode materials for Lithium-ion battery[J]. Electrochemistry Communications, 2006,9(12): A542-A544.
[11] 王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科学技术出版社, 1988: 23-24.WANG Dian-zuo, HU Yue-hua. Flotation solution chemistry[M].Changsha: Hunan Science Technology Press, 1988: 23-24.
[12] 孙传尧, 印万忠. 硅酸盐矿物浮选原理[M]. 北京: 科学出版社, 2001: 91-92.SUN Chuan-yao, YIN Wan-zhong. The flotation theory of silicate mineral[M]. Beijing: Science Press, 2001: 91-92.
[13] 温元凯, 邵俊. 离子极化导论[M]. 合肥: 安徽教育出版社,1985: 262-267.WEN Yuan-kai, SHAO Jun. The theory of ionic polarization[M].Hefei: Anhui Education Press, 1985: 262-267.
[14] 李小斌, 李永芳, 刘祥民, 等. 复杂硅酸盐矿物 Gibbs自由能和焓的一种近似计算法[J]. 硅酸盐学报, 2001, 19(3): 232-237.LI Xiao-bin, LI Yong-fang, LIU Xiang-min, et al. A simple method of estimation of Gibbs free energy and enthalpy of complicate silicates[J]. Journal of the Chinese Ceramic Society,2001, 19(3): 232-237.
[15] 伊赫桑巴伦. 纯物质热化学手册[M]. 程乃良, 牛四通, 徐桂花, 译. 北京: 科学出版社, 2003.Barin I. Thermochemical data of pure substances[M]. CHENG Lai-liang, NIU Si-tong, XU Gui-hua, trans. Beijing: Science Press, 2003.
[16] 迪安 J A. 兰氏化学手册[M]. 尚久方, 操时杰, 辛无名, 等译.北京: 科学出版社, 1991.Dean J A. Lange’s handbook of chemistry[M]. SHANG Jiu-fang,CAO Shi-jie, XIN Wu-ming, et al, trans. Beijing: Science Press,1991.
[17] 林传仙, 白正华, 张哲儒. 矿物及有关化合物热力学数据手册[M]. 北京: 科技出版社, 1985.LIN Chuan-xian, BAI Zheng-hua, ZHANG Zhe-ru. The handbook of mineral and the related compounds thermodynamic data[M]. Beijing: Science and Technology Press, 1985.
[18] Armand M. Lithium insertion electrode materials based on orthosilicate: US, 6085015[P]. 2000-07-04.
[19] Zaghib K, Salah A A, Ravet N, et al. Structural, magnetic and electrochemical properties of lithium iron orthosilicate[J].Journal of Power Sources, 2006, 160: 1381-1386.
[20] Gong Z L, Li Y X, He G N, et al. Nanostructured Li2FeSiO4electrode material synthesized through hydrothermal-assisted sol-gel process[J]. Electrochemical and Solid-State Letters, 2008,11(5): A60-A63.
[21] 杨勇. 可充锂电池用硅酸铁锂/碳复合正极材料及其制备方法:中国, 1803608[P]. 2006-07-19.YANG Yong. Lithium iron orthosilicate/C composite cathodes and preparation method for rechargeable lithium battery. China,1803608[P]. 2006-07-19.
