广玉兰叶、花总黄酮提取方法与含量比较
2010-05-30蒋新龙
蒋新龙
(浙江树人大学 生物与环境工程学院,浙江 杭州 310015)
广玉兰 (Magnolia grandifore),系木兰科木兰属乔木树种。原产北美,现作为观赏植物在我国各地大量栽培。其叶及花中含有挥发油、木兰花碱等多种化学成分,药理实验表明对正常或麻醉状态下的动物有缓慢的降压作用[1-2]。其花蕾的醇提物具有明显的扩张血管降压作用,并对血小板聚集与血栓形成有抑制作用,可能与其黄酮成分有关[3]。王琪等[4]用微波法进行木兰属植物花蕾总黄酮含量测定和提取工艺研究,我们曾用醇提法进行广玉兰花总黄酮提取工艺研究[5],张斌等[6]用醇提法进行广玉兰叶总黄酮提取工艺研究,但对广玉兰花和叶用微波法和常规浸提法提取总黄酮的对比研究很少。本实验探讨微波提取和醇提取法对广玉兰叶花中总黄酮类化合物的提取效果,并对其含量作对比。
1 材料与方法
1.1 材料
鲜广玉兰叶和花采自浙江树人大学生物与环境工程学院校园,经60℃烘干、粉碎过0.42 mm(40目)筛备用。芦丁标样购自中国医药集团上海化学试剂公司。其它试剂均为分析纯。
仪器有GZX-91400MBE电热恒温鼓风干燥箱(上海博迅实业有限公司医疗设备厂);7200型紫外可见分光光度计 (上海尤尼柯仪器有限公司);M700型美的微波炉 (广东美的微波炉制造有限公司);FW80高速万能粉碎机 (天津泰斯特仪器有限公司);AL204电子分析天平 (梅特勒托利多仪器上海有限公司);HH-S11-4-S型电热恒温水浴锅(上海悦丰仪器仪表有限公司);RE540旋转蒸发(日本)。
1.2 方法
1.2.1 总黄酮测定的标准曲线
采用硝酸铝-亚硝酸钠比色法测定总黄酮含量。
标准液配置和标准曲线[7]。将芦丁于120℃干燥至恒重,准确称取芦丁标样20 mg,用80%乙醇溶解,完全转入100 mL容量瓶,用80%乙醇定容摇匀,得质量浓度为0.2 mg·mL-1的芦丁标准溶液。取5支 10 mL比色管,分别精密加入 1.0、2.0、3.0、4.0和5.0 mL芦丁标液,各加80%乙醇至5 mL,加入5%NaNO2溶液0.5 mL,摇匀,放置6 min,再加入10%Al(NO3)3溶液0.5 mL,摇匀,再放置6 min,加入4%NaOH溶液4 mL,摇匀,放置10 min,以不加黄酮提取液为空白对照,用1 cm比色皿,在7200型可见分光光度计 (500 nm)上测定吸光度A,用最小二乘法作线形回归曲线,得芦丁质量浓度C(mg)与吸光度A的关系式为:C=0.650 3 A+0.010 32,其线性范围为0~1.0 mg,相关系数0.999 7。
测定波长的选择[8]。取芦丁标准品和样品按《中国药典》2005年版一部中芦丁测定方法显色后做全波长扫描,结果显示在500 nm处有吸收,故确定500 nm为测定波长。
1.2.2 广玉兰叶中总黄酮化合物的提取和测定
准确称取几份样品叶的干燥粉末0.500 0 g,加入一定量的乙醇溶液,分别用微波、索氏醇提等方法提取,经过滤或离心分离后,收集提取液,定容到50 mL,精密吸取黄酮提取液1.0 mL于10 mL比色管中,按1.2.1节测定总黄酮类含量的方法,在500 nm下测吸光度值[9]。代入回归方程,求出提取液中黄酮类化合物含量,同时做3次平行实验,按下式计算总黄酮含量 (%):C×V×10-3×100/所用原料重量。
式中:C为回归方程计算所得值;V为提取液总体积 (即定容体积);所用原料重量单位g。
微波提取法:准确称取几份样品叶的干燥粉末0.500 0 g至锥形瓶中,分别对不同的提取微波功率 (144、288、464、648和 800 W)、提取时间(2、3、4、5、6和 7 min)、提取剂浓度 (20%、30%、40%、50%、60%、70%、80%和 90%)、料液比 (1∶10、1∶20、1∶30、1∶40、1∶50、1∶60)等条件做单因素平行实验。
表1结果表明:0.500 0 g样品叶的干燥粉末置于锥形瓶中,加入体积分数70%的乙醇25 mL,密闭放入微波炉中,648 W火力下处理1 min,冷却,过滤,洗涤残渣,滤液并入容量瓶,以体积分数为70%的乙醇定容到50 mL即得黄酮提取液,在此条件下,广玉兰叶中黄酮化合物的含量最高,为2.15%。

表1 微波提取法和索氏回流提取法的效率比较
索氏回流提取法:准确称取几份样品叶的干燥粉末0.500 0 g至锥形瓶中,分别对不同的提取温度 (40℃、50℃、60℃、70℃、80℃和90℃)、提取时间 (15、30、45、60、90、120、150和180 min)、提取剂浓度 (20%、30%、40%、50%、60% 和 70%)、料液比(1∶10、1∶20、1∶30、1∶40、1∶50、1∶60)等条件做单因素平行实验。
结果 (表1)表明:0.500 0 g样品叶的干燥粉末置索氏提取器中,用石油醚脱脂挥干,再用体积分数为50%乙醇20 mL在80℃下抽提2.5 h,提取液浓缩、干燥,然后用体积分数为50%乙醇溶解,并定容至50 mL即得黄酮提取液,在此条件下,广玉兰叶中黄酮化合物的含量最高,为1.63%。
比较发现,微波法提取液的最高吸光度是索氏回流法的1.32倍,而且速度快、设备简单。为此,选用微波法提取样品的总黄酮。
广玉兰花中总黄酮化合物的提取和含量测定方法同上,实验结果也相似,索氏回流法和微波法所得黄酮分别为5.47%和6.92%。
1.2.3 广玉兰花、叶总黄酮微波正交提取
根据1.2.2单因素平行试验的结果,采用正交试验设计,应用L9(34)正交表,对提取剂、微波功率、提取时间、提取剂用量4因子在3个水平进行优选 (表2)。结果采用直观分析和方差分析。
1.2.4 广玉兰花、叶总黄酮含量的测定与比较
以正交优先的最佳条件提取总黄酮,分别按1.2.2方法进行黄酮含量测定并比较广玉兰花、叶中总黄酮含量的相对大小。
1.2.5 回收率实验
取5个10 mL比色管,在已知黄酮含量的广玉兰叶和广玉兰花提取液中分别加入0.2 mg·mL-1芦丁对照品溶液 1.00、2.00、3.00、4.00、5.00 mL样液,分别测定黄酮含量,根据所得的总黄酮含量减去加入的标量,再除以样品所含的总黄酮量算出回收率。
2 结果与分析
2.1 广玉兰花、叶总黄酮微波正交提取
各试验号根据具体给定的提取条件所得的提取液,用相应提取剂分别定容于50 mL容量瓶中,根据样品测定方法进行测定并计算黄酮含量。
结果 (表2)表明,广玉兰花叶总黄酮的微波正交试验结果非常相似,在正交试验的4个因子中,以提取剂对提取率的影响最大;由极差数据K可见,各因子对提取率的影响依次为提取剂>微波功率>提取料液比>提取时间。综合分析正交试验结果,确定最佳工艺条件为 A2B2C3D1,即提取剂用70%乙醇溶液,料液比1∶40(g·mL-1),提取时间50 s,微波功率为800 W。这与1.2.2中微波法单因素平行实验结果不完全一致,可能是微波功率、提取料液比、提取时间3个影响因子之间存在交互作用。但最佳提取剂均为70%乙醇,此与实验数据的方差分析结果一致,因为因子A为显著性因子 (叶 F=22.860 0*,花 F=36.667 9*),其它因子为不显著因子。
2.2 广玉兰的花、叶总黄酮含量测定与比较

表2 不同处理组合的黄酮含量
以正交优先的最佳条件提取总黄酮,按1.2.2方法进行黄酮含量测定,重复3次,得出广玉兰花的平均总黄酮含量为6.92%、叶为2.15%,与原试验结果基本一致。
2.3 回收率
从表3、表4可知,5个回收率实验结果的平均值为99.75% ~100.39%,RSD小于2%,说明微波法回收率高。所以,微波法是提取和测定广玉兰叶、花总黄酮的最佳方法。
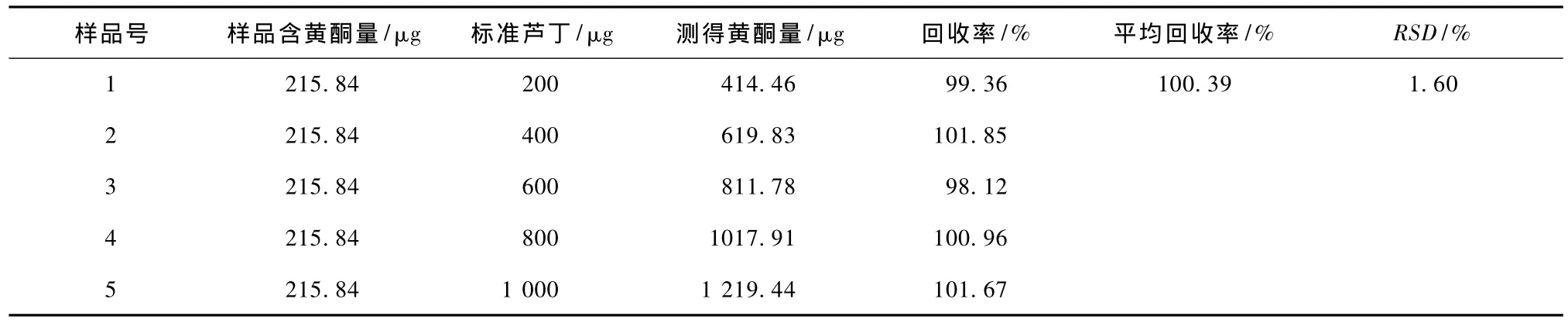
表3 广玉兰叶的回收率

表4 广玉兰花的回收率
3 小结与讨论
采用微波法提取广玉兰叶和花的总黄酮,速度快、收率高、设备简单,提取效果明显优于传统索氏回流提取法。最佳提取条件为1∶40(g·mL-1)的70%乙醇水溶液,微波功率800 W,提取时间50 s。
广玉兰叶、花中总黄酮含量较高。这与不同部位影响黄酮在植物体内合成、转化、降解的诸多因素有关[10-11]。花的总黄酮含量高于叶片,而广玉兰叶花资源丰富,具有潜在的研究与开发价值。
[1] 陈兴荣,魏春红.荷花玉兰化学成分研究 [J].中药材,2000,23(3):159.
[2] 全国中草药汇编编写组.全国中草药汇编 (上册) [M].北京:人民卫生出版社,1975:39.
[3] 郑虎占.中药现代研究与应用第三卷 [M].北京:学苑出版社,1998:2403.
[4] 王琪,李洪玲.木兰属植物花蕾总黄酮含量测定及提取工艺研究 [J].现代中药研究与实践,2003,17(2):32-33.
[5] 蒋新龙,余启洪,施永清.广玉兰花总黄酮的提取工艺研究 [J].浙江农业科学,2007(1):40-43.
[6] 张斌,蒋立科,王红梅.广玉兰叶总黄酮的提取工艺研究[J].化学与生物工程,2009,26(5):32-34.
[7] 王自军,边丽,齐誉.淡竹叶中总黄酮的微波提取与含量测定 [J].现代食品科技,2005(1):91-93.
[8] 张熊禄.微波法从柑桔皮中提取类黄酮 [J].食品科学,2005,26(3):119-121.
[9] 林敏,吴冬青,范彦康,等.微波对提取万寿菊花中黄酮类化合物的影响 [J].湖州师范学院学报,2005,27(2):61-63.
[10] Angus M ,Wendy A P,Lincoln T.Regulation of auxin transport by aminopeptidases and endogenous flavonoids [J].Planta,2000,211(3):315-324.
[11] Carolyn E L,Jane E L,John R L W.Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars [J].J Sci Food Agric,1996,71:313-320.
