尿毒症脑病大鼠脑组织多巴胺、5-羟色胺含量变化及发病机制的探讨
2010-05-30刘丽秋时红娟王延萍
董 晖,刘丽秋,时红娟,王延萍
(青岛大学医学院附属医院,山东青岛266003)
急慢性肾功能衰竭患者出现中枢神经系统症状和体征称为尿毒症脑病,常出现于透析前,临床上较为常见。因临床表现复杂,且缺乏特异性,较难正确诊断,因此常将肾脏病导致的精神神经症状笼统的称为尿毒症脑病。我们用顺铂建立急性肾功能衰竭的动物模型,检测脑组织内多巴胺和5-羟色胺的含量变化及这种变化与脑病发生的相关性,为尿毒症脑病的发病机制提供新的研究方向之一。
1 材料与方法
1.1 实验动物与模型制备 成年健康雌性Wister大鼠36只,雌雄各半,体重 200±20 g,由青岛市动物中心提供。笼养(2只/笼),自由饮食。所有动物适应环境1周后,随机选12只作为正常对照组,其余24只作为模型组,实验主要观察大鼠下列指标:①应激反应:捏住大鼠尾根将其提出笼外,前肢置于笼盖上,可见大鼠搔爬笼盖,奋力反抗,继而用冰玻璃棒以相同力度敲击大鼠额头,可见大鼠即刻出现回避反应,继而试探玻璃棒,定为应激反应阳性,以上证明大鼠反应灵活;否则为应激反应阴性,大鼠反应迟钝。②呼吸频率:成年健康大鼠静息状态下呼吸65-110次/分,超过150次/分是呼吸过速,低于40次/分是呼吸过缓。③意识状态:嗜睡、意识模糊、昏睡、昏迷为异常。④进食状况,正常大鼠每24小时进食约5-8次,增多或减少均为异常。⑤四肢活动情况:大鼠活动自如为正常,出现肢体无力,甚至不能自主爬行或肢体出现不规律的快速抖动、触摸其肢体能感知肌肉快速震颤为异常。实验中根据以上五点作为尿毒症组和尿毒症脑病分组标准。实验第2、3天对24只模型组大鼠予腹腔内注射顺铂每日10 mg/kg,对照组注射相同容积的生理盐水。实验中观察各鼠上述指标七天,将造模成功后的应激反应阳性,进食减少,呼吸改变、神志和四肢活动情况改变轻的大鼠共12只归为尿毒症组,将出现①呼吸过速或过缓;②意识不清及拒绝进食;③自主爬行困难或出现四肢震颤三者之一者共12只归为尿毒症脑病组。用药途径、剂量和次数参照文献[1,2]。1.2 标本采集和处理 三组大鼠用8%水合氯醛(400 mg/kg)腹腔注射麻醉断头处死,断端收集足量血液(>2.5 ml)后迅速取出脑组织,离心取上清液置于-80℃冷冻保存待测。血样直接送检。
1.3 实验仪器和试剂 600-717-2645高效液相色谱仪:美国Waters公司;BP21117电子天平:美国Sartorius公司;微量加样器:德国Eppendoff公司;自动生化分析仪:美国Dupont公司;DIAX900电动匀浆机:德国Heidolph制造所;水平离心机:北京医用离心机厂;多巴胺 :美国Sigma公司;5-羟色胺:美国Sigma公司。
1.4 脑组织多巴胺、5-羟色胺浓度检测(高压液相色谱法)配制流动相和标准液,对样品预处理,用高效液相色谱仪进行色谱分析。将各标准品混合并稀释成6 个浓度梯度 ,即分别进样 0.5、1、2、4、8、16 μ g,检测并绘制标准曲线,求直线回归方程
多巴胺:Y=0.90X-0.24;5-羟色胺:Y=0.85X-0.16。
进样40 μ l,根据色谱峰面积从标准曲线上求出相应含量。
1.5 血肌酐的检测 新鲜血样3 000 rpm离心10分钟,取上清液,自动生化分析仪检测。
2 结果
2.1 各实验组血肌酐、脑组织多巴胺和5-羟色胺含量的比较见表1。
表1 各实验组血肌酐值、脑组织多巴胺和5-羟色胺含量(±s,n=12)
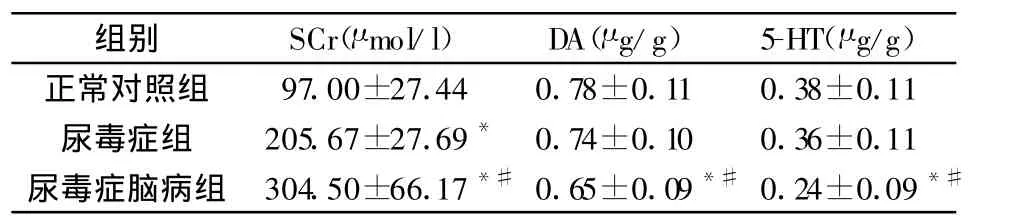
表1 各实验组血肌酐值、脑组织多巴胺和5-羟色胺含量(±s,n=12)
注:与对照组比较,*P<0.05;与尿毒症组比较,#P<0.05
正常对照组 97.00±27.44 0.78±0.11 0.38±0.11尿毒症组 205.67±27.69* 0.74±0.10 0.36±0.11尿毒症脑病组 304.50±66.17*#0.65±0.09*#0.24±0.09*#
2.2 大鼠脑组织内多巴胺、5-羟色胺含量与血肌酐值相关性尿毒症脑病组大鼠额叶皮质中的多巴胺含量与血肌酐值无线性相关(r=-0.347,P=0.269);尿毒症脑病组大鼠额叶皮质中的5-羟色胺含量与血肌酐值无线性相关(r=-0.277,P=0.383)。
3 讨论
多巴胺是哺乳动物大脑中主要的儿茶酚胺类神经递质,占所有脑内儿茶酚胺类神经递质含量的80%,它控制着运动、认知、情感、正性强化、摄食、内分泌调节等许多功能。许多疾病如精神分裂症,帕金森病都与多巴胺递质传递障碍有关[4]。急性肾功能衰竭动物模型实验发现血及脑组织中多巴胺的浓度、代谢及其与受体敏感性可能发生了改变。
我们的实验证实,急性肾功能衰竭大鼠饲养至出现明显的尿毒症脑病时,大脑皮质内多巴胺浓度较正常对照组和单纯急性肾功能衰竭组的多巴胺浓度明显降低,证明多巴胺可能参与了尿毒症脑病的发生。Ksiazek A[4]发现急慢性肾功能衰竭并发脑病时,大鼠额叶皮质及纹状体内DA、NE、E明显降低,认为神经递质可能参与了尿毒症脑病的发生,与我们的实验结果一致。另外一些动物实验也发现慢性肾功能衰竭终末期,脑组织中多巴胺的浓度降低[5]。此外有研究发现肾功能衰竭大鼠给予多巴胺合成的限速酶酪氨酸羟化酶抑制剂,多巴胺合成抑制效应较正常对照组明显减弱[6]。Ksiazek A[4]发现肾功能衰竭终末期的患者血中多巴胺β-羟化酶的活性降低。另外肾功能衰竭时体内氨基酸代谢异常,如谷氨酸、色氨酸、酪氨酸等,酪氨酸是多巴胺合成的前体,可能与多巴胺代谢异常有关[7]。
多巴胺最终通过与受体结合发挥生物学效应。受体密度或亲和力变化会影响正常生理功能。精神分裂症患者尸检及活体PET研究均显示,纹状体D2受体密度升高提示D2受体可能与精神分裂症的发病有关[8]。那么尿毒症患者发生精神分裂症是否也存在多巴胺受体异常,目前此方面的报道未见,仅有报道称胍基复合物可抑制NMDA受体,激活GABA受体[9]。我们发现,肾功能衰竭早期即血肌酐并不是很高时大脑额叶皮质和纹状体内多巴胺浓度未改变,未发生脑病;血肌酐明显升高,多巴胺浓度明显降低,出现脑病表现。可能与血肌酐升至某种程度,影响了多巴胺的代谢有关。但临床上有些患者肌酐值很高未发生脑病,而另一些患者肌酐相对并不高脑病症状却十分明显,我们考虑可能与肾功能恶化速度、程度及受体的敏感性有关。总之多巴胺可能参与了急性肾功能衰竭并发脑病的发生,但其具体的机制不明,尚待进一步的研究。
5-羟色胺5-HT亦是单胺类神经递质,但非儿茶酚胺类,5-HT具有重要的生理功能,参与中枢神经系统的神经传递,与其他神经递质一起,参与行为活动、情绪、食欲、体温调节平衡等。帕金森病、Alzheime病发现有5-HT神经元的退化。脑中5-HT增多可造成情感障碍,5-HT水平低下者有自杀念头。约40%的孤独症患者血5-HT升高。未经治疗的精神分裂症患者血5-HT增高,经精神抑制药治疗后降低。AI Banchaabouchi M等[10]报道肾切除急性肾功能衰竭10天后大鼠脑组织中5-羟色胺浓度降低。我们的实验发现肾功能衰竭初期脑组织中5-羟色胺含量无改变,出现脑病改变时含量明显降低,与我们的结果基本一致。另外,Siassi F等报道,慢性肾功能衰竭大鼠脑组织中色氨酸和5-羟色胺的浓度降低。Aguilera A等[11]针对慢性肾功能衰竭长期血液透析患者的厌食症提出了“色氨酸/5-羟色胺失调”假说。该假说认为脑组织中高的5-羟色胺水平和低的5-羟色胺/多巴胺比是长期血液透析患者厌食的可能原因。
总之,我们的实验显示①顺铂10 mg/kg连续两日腹腔注射可以成功造成大鼠急性肾功能衰竭动物模型。②急性肾功能衰竭未发生神经系统并发症时脑组织中多巴胺、5-羟色胺未发生量的变化,而急性肾功能衰竭并发神经系统症状时脑组织多巴胺、5-羟色胺的浓度则降低,因此多巴胺、5-羟色胺可能参与了尿毒症脑病的发生。③急性肾功能衰竭时血肌酐值越高即肾小球滤过率降低幅度越大,越容易并发神经系统症状。急性肾功能衰竭并发脑病,并非肌酐值越高,多巴胺、5-羟色胺浓度越低,脑组织中多巴胺、5-羟色胺变化与血肌酐值无线性相关性。尿毒症脑病的发生是多因素的结果,有待进一步研究。
[1]陈小波,廖履坦.L-精氨酸、甘氨酸对顺铂所致大鼠急性肾功能衰竭的保护作用[J].肾脏病与透析肾移植杂志,1997,6(2):153.
[2]蒋文华.神经解剖学[M].复旦大学出版社,2002.
[3]李 凡,舒斯云,包新民.多巴胺受体的结构和功能[J].中国神经科学杂志,2003,19(6):405.
[4]Ksiqzek A.Brain serotonin and catecholamine turnover in uremic rats[J].Nephron,1982,31:270.272.
[5]Naoto Adachi,Baiping Lei,Gautam Deshpande,et al.Uremia suppresses central dopaminergic metabolism and impairs motor activity in rats.Intensive Care Medicine[J].Springer-Verlag,2001,27(10):1655.
[6]Adachi N,Lei B,Deshpande G,et al.Uraemia suppresses central dopaminergic metabolism and impairs motor activity in rats[J].Intensive Care Med,2001,27(10):1655.
[7]侯 静,徐贵云.多巴胺受体和5-羟色胺受体遗传多态性与精神分裂症[J].中华精神科杂志,2000,33(3):188.
[8]De Deyn PP,D'Hooge R,Van Bogaert PP,et al.Endogenous guanidino compounds as uremic neurotoxins[J].Miner Electrolyte Metab,1996,22(1-3):115.
[9]Kaneda Y,Fujii A,Nagamine I.Platelet serotonin concentrations inmediacated schizophrenic patients[J].Prog Neuropsychopharmacol Biol Psychiatry,2001,25(5):983.
[10]Al Banchaabouchi M,Marescau B,D'Hooge R,et al.Consequences of renal mass reduction on amino acid and biogenic amine levels in nephrectomized mice[J].Amino Acids,2000,18(3):265.
[11]Aguilera A,Selgas R,Codoceo R,et al.Uremic anorexia:a consequence of persistently high brain serotonin levels[J].The tryptophan/serotonin disorder hypothesis Perit Dial Int,2000,20(6):810.
