松茸菌丝体的纯培养及其鉴定
2010-05-30张微思罗孝坤张丽英张利菁
张微思,罗孝坤,张丽英,张利菁,朱 萍
(中华全国供销合作总社昆明食用菌研究所,云南 昆明 650223)
松茸 (Tricholoma matsutake),学名松口蘑,别名有大花菌、松菌、剥皮菌等,在日本有 “蘑菇之王”之称,也是珍稀濒危的食用兼药用菌[1]。目前,云南松茸的发展和可持续利用形势不容乐观,科学家们正在研究松茸的半人工栽培和人工栽培方法以拯救这一珍贵食用菌,为民造福和创收[2]。松茸菌丝体的纯培养是进行松茸半人工栽培和人工栽培的前提条件[3,4]。由于松茸是活体共生菌,菌种的分离和培养十分困难,因此有必要对培养物进行鉴定,保证通过菌丝体纯培养得到的培养种与原种在种质上是一致的[5-7]。通过对云南4个不同地方的松茸进行组织分离,获得了斜面培养的母种及液体培养的扩繁种,并通过感官和分子鉴定,证明了所培养菌丝与原子实体的种质一致性,为松茸菌丝体的进一步发展及应用奠定了基础。
1 材料和方法
1.1 培养材料
原种来源于4个不同地点采集的松茸,见表1。
1.2 主要仪器
培养皿、接种针、离心机、水浴锅、电泳仪、电泳槽、PCR仪、紫外分光光度仪、紫外凝胶成像系统、各型号微量移液器、高压灭菌锅等。

表1 采集松茸子实体的4个样点
1.3 培养方法
1.3.1 菌丝体的培养
原种菌丝体的分离及培养,用PDA综合培养基+0.5%酵母膏斜面培养基及组织分离法进行培养[9,10]。将上述经斜面培养基培养成功的菌丝体接入到液体培养基中,进行菌丝体扩繁。
1.3.2 原种与培养种的ITS分子鉴定
松茸DNA的提取采用改良的CTAB法,溶液的配制参照Clark(1998)的方法。反应体系:总体积为20 μL,Mg2+2.5 mmol·L-1, Buffer1× , dNTP 0.3 mmol·L-1, 引 物0.25 mmol·L-1, 模板 1 ng·μL-1~80 ng·μL-1, Taq DNA 聚合酶 1 U。 扩增程序: 94℃ 5 min; 94℃ 30 s, 50℃~54℃ 45 s,72℃ 1 min,40个循环;72℃延伸7 min。所用到的引物的序列如下:ITS4(TCCTCCGCTTATTGATATGC),ITS5(GGAAGTAA AAGTCGTAACAAGG)。 扩增产物点入含 0.5 μg·mL-1溴化乙锭的 1.8%琼脂糖凝胶中, 以 DL2000 做Marker,用1×TAE缓冲液,DYY-33B型电泳槽,电压45 V·cm-1,电泳3 h,于紫外检测仪下观察并照相,目的片段用WATSON胶回收试剂盒回收并纯化DNA,用ABI DNA3700分析仪测序。获得的序列用NCBI的BLAST进行序列搜索,用DNAStar CLUSTALX等软件进行序列比较。
2 结果与分析
2.1 原种菌丝体
原种菌丝体的获得,见表2。

表2 斜面培养基上菌丝体的生长状况
由表2可以看出,取自4个地点的松茸子实体利用组织分离法,培养7 d~10 d后,组织块开始萌动,可见组织块的表面发白,长出白色的菌丝体,菌丝能紧贴着培养基生长,生长速度非常缓慢。因此,利用PDA综合培养基+0.5%酵母膏这种培养基能够较好地培养出实验所需的菌丝体。
2.2 菌丝的扩繁
菌丝的扩繁情况,见表3和图1。
由表3和图1可以看出,利用液体培养基配方可以较好地对松茸的菌丝体进行扩繁,且菌丝体生长良好。
2.3 ITS扩增
ITS扩增产物琼脂糖凝胶分析结果,见图2。
由图2可以看出,经PCR扩增后8个样品皆得到1条约650 bp左右的条带,而且条带清晰明亮无杂带。
2.4 4个原种与培养种的ITS序列比较

表3 松茸菌丝体在液体培养基中的生长过程
4个原种与培养种的ITS序列比较情况见图3。
由图3可得,PⅠ和PⅠ1的ITS测序结果基本相同。在670多个碱基中它们之间只存在5个碱基位点不同,并且出现变异的碱基主要处于序列末端。所以可以说培养种即是原种。PⅡ和PⅡ2的ITS测序结果完全相同,PⅢ和PⅢ1的ITS测序结果基本相同,PⅣ和PⅣ3的ITS测序结果基本相同,可以判定培养种即是原种。

图1 松茸菌丝体液体培养情况
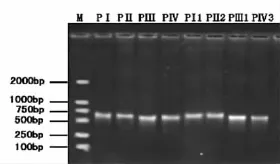
图2 ITS扩增产物琼脂糖凝胶图

图3 PⅠ和PⅠ1的ITS序列图
2.5 培养种和原种的ITS序列差异度比较
培养种和原种的ITS序列差异度比较情况见表4。

表4 原种与培养种的ITS序列差异度
从表4可以看出,PⅠ和PⅠ1序列差异度为0.003,相似度为 0.997;PⅡ和PⅡ2序列的差异度为0,相似度为 1;PⅢ和 PⅢ1序列的差异度为 0.002,相似度为0.998;PⅣ和 PⅣ3序列差异度为0.002,相似度为0.998。由于差异度<0.01,证明上述原种与培养种在分类上属于同一个种。
2.6 4个培养种和原种的进化树关系
4个培养种和原种的进化树关系见图4。

图4 原种和培养种的进化树图
由图4进化树可得,在4个原种中,PⅠ和PⅡ在进化树上处于一个分支,PⅢ和PⅣ的在进化树上处于另一个分支。同时也可看出原种与其相应的培养种在进化距离上是最近的,也即它们属于同一个种,和实验的预期结果相吻合。
3 讨论
实验通过对松茸菌丝体的获得、扩繁及其鉴定,证实了在合理控制实验条件下,可以进行松茸菌丝体液体扩繁,且扩繁后的菌丝体与原种依然保持种质的一致性,对利用液体培养出的培养物仍需要进行种质的鉴定。本文又采用了ITS分子鉴定的方法,对原种和培养种进行了遗传分子的鉴定,从分子水平上说明了其在遗传种质上的一致性,为今后的大规模培养奠定了基础。
[1]王永明.蕈中珍品-松茸[J].植物杂志,1999 (6):10.
[2]胡尚勤.松茸人工栽培技术的研究[J].食用菌,2002(2):27-28.
[3]傅伟杰,许广波.长白山区松口蘑分布及生态研究[J].食用菌学报,2004(6):46-50.
[4]阎伟.松茸研究的动态与展望[J].内蒙古林学院学报,2006,4(增刊):1-5.
[5]杨民和,杨新美,陈立国.松茸生态调查及培养的初步研究[J].江西农业大学学报,2005(1):21.
[6]刘培贵,袁明生,王向华,等.松茸群生物资源及其合理利用与保护[J].自然资源学报,1999,14(3):245-252.
[7]弓明钦.松茸的利用和可持续发展[D].中国云南香格里拉松茸交易会松茸产业发展论坛文集,2004.
[8]曾东方.珍稀共生食用菌松茸DNA指纹研究[J].园艺学报,2000,27(3):223-225.
[9]张亚平,张汉波,程立忠,等.松口蘑和假松口蘑ITS序列分析与比较[J].菌物学报,2005,24(1):48-52.
[10]李维国,赵永光.适于松茸生长的生态条件[J].微生物学杂志,2000, 20(3): 52-54.
