江苏省南京地区耐青霉素肺炎链球菌快速诊断方法初步探讨
2010-05-29丁晶晶张德平
丁晶晶,张德平
(南京大学医学院附属鼓楼医院呼吸科,江苏南京,210008)
肺炎链球菌是社区获得性肺炎(CAP)最主要的病原菌,此外,肺炎链球菌感染还可导致菌血症、脑膜炎、中耳炎、鼻窦炎等多种疾病。近几年来,耐青霉素肺炎链球菌的比例呈逐年上升趋势。迫切需要快速、可靠的诊断方法来指导耐药株感染的早期有效治疗。传统敏感性测定方法至少需要24 h,因此在严重感染中,常常需要先进行经验性治疗,广谱抗生素的频繁使用会进一步导致细菌耐药的产生。随着分子生物学技术的发展,PCR技术开始广泛应用于病原体的检测,但应用于药敏测定的相关报道比较少见。PCR方法具有快速、敏感、操作简单、重复性好、不依赖于活菌等优点,因此在本实验中,作者将PCR方法应用于肺炎链球菌青霉素耐药性的检测,以寻求最佳快速检测方法。
1 材料与方法
1.1 实验试剂和仪器
optochin纸片(OXOID,UK);MueLLer-Hinton培养基(OXOID,UK);哥伦比亚培养基(OXOID,UK);Taq聚合酶(TAKARA,Japan);HinfI内切酶(TAKARA,Japan);VIABANKTM菌种保存盒(MW&E,UK);细菌基因组DNA提取试剂盒(AXGEN,USA);高速冷冻离心机Z-303K(HERMLE,Germany);PCR扩增仪PTC-100TM(MJ Research Inc,USA);稳压稳流电泳仪3 000 Xi(Biorad,USA);捷达凝胶成像系统(江苏捷达科技发展有限公司);H.SWX-600BS数显电热恒温水浴箱(上海新苗医疗器械公司);所有PCR引物均由invitrogen公司合成提供。
1.2 菌株的采集、分离和鉴定
收集了2005年3月~2007年6月江苏省南京地区7所医院(南京军区南京总医院、南京市鼓楼医院,南京市儿童医院,江苏省人民医院,南京医科大学第二附属医院,东南大学附属中大医院,南京市第一医院)微生物室分离的肺炎链球菌菌株共180株,其中130株来自患者,50株来自健康体检者,其标本来源主要为痰、血、脑脊液、鼻咽拭子、中耳分泌物、眼分泌物、脓汁、气管抽吸物等。标本采集1 h内接种于哥伦比亚琼脂血平板,置5%CO2培养箱内37℃孵育,分离出的菌株用optochin纸片和胆汁溶菌试验鉴定为肺炎链球菌,菌株于VIABANKTM菌种保存管中-70℃冰冻保存。
1.3 青霉素敏感性检测
青霉素的最低抑菌浓度(MIC)测定按照美国临床和实验室标准协会(CLSI)(原美国国家临床实验室标准化委员会NCCLS)推荐的琼脂稀释法,采用含5%脱纤维羊血的M-H药敏培养基进行测定,37℃、5%CO2条件下孵育18~24 h后观察结果,标准菌株ATCC49619跟随全程作为质量控制。结果判定依据2004年NCCLS标准:MIC≤0.06 μ g/mL, 敏感;0.12 ~1.0 μ g/mL,中介;≥2.0 μ g/mL,耐药 。
1.4 细菌基因组DNA的提取
将肺炎链球菌接种于哥伦比亚血平板上,37℃、5%CO2孵育18 h,用灭菌双蒸水将2×109CFU细菌制成混悬液收集于2 mL无菌离心管中,基因组DNA的提取按照Axygen细菌基因组DNA提取试剂盒的说明进行,所得产物-20℃保存作为PCR反应的模板。随机选取10株菌株,将其细菌混悬液倍比(10倍)稀释后提取DNA,用于检测各PCR方法的敏感度。
1.5 PCR法扩增pbp1A 、pbp2B、pbp2X 基因
引物见表1,其中pbp1A的引物根据青霉素不敏感株(PNSSP)设计,pbp2B、pbp2X的引物根据青霉素敏感株(PSSP)设计[1],扩增体系如下:25ng DNA模板,1.5 mmol/L MgCL2,200 μ mol/L dNTP,1 U Taq 聚合酶,总反应体积为25 μ L。94℃预变性 5 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,循环30次后再延伸7 min。扩增产物经1.5%琼脂糖凝胶电泳,紫外光下成像。每批反应均含阴性对照和阳性对照且重复1次。
2 结 果
2.1 肺炎链球菌菌株来源
130株临床分离肺炎链球菌菌株分别来自以下标本:痰80.8%(105/130),血培养5.4%(7/130)、脑脊液1.5%(2/130)、中耳分泌物5.4%(7/130)、眼分泌物2.3%(3/130)、脓汁2.3%(3/130)、气管抽吸物2.3%(3/130)。这些标本主要从急性支气管肺炎(61.5%)、肺炎(20.8%)、菌血症(5.4%)、中耳炎(5.4%)、上呼吸道感染(3.1%)、结膜炎(2.3%)和脑膜炎(1.5%)病人中获取。患者平均年龄3岁(1个月~88岁),男性62.3%,42.3%的患者曾在入院前1周内使用过青霉素,70%在1年内使用过青霉素。健康定殖者年龄分布为18~40岁,没有人在1年内使用过青霉素。
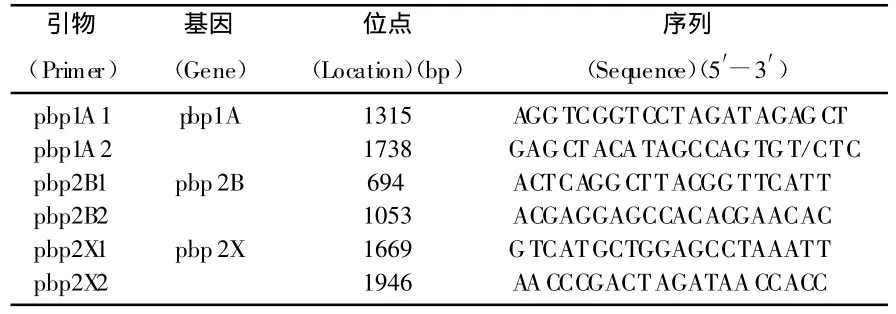
表1 PCR扩增引物序列
2.2 青霉素耐药情况
所有从健康体检者分离的定殖菌株均对青霉素敏感,而从临床患者分离的菌株中,青霉素的耐药率较高,为51.5%,见表2。由于大多数健康分离株来自儿童,作者将患者分为2组:儿童组(1个月~14岁),成人组(>14岁~88岁)。数据表明,2组在青霉素耐药水平上的差异有统计学意义,儿童组的耐药率(65.6%)显著高于成人组(P<0.01),且MIC50和MIC90均高于成人组。共有83株敏感株,30株中介株和67株耐药株被纳入下一步分析。
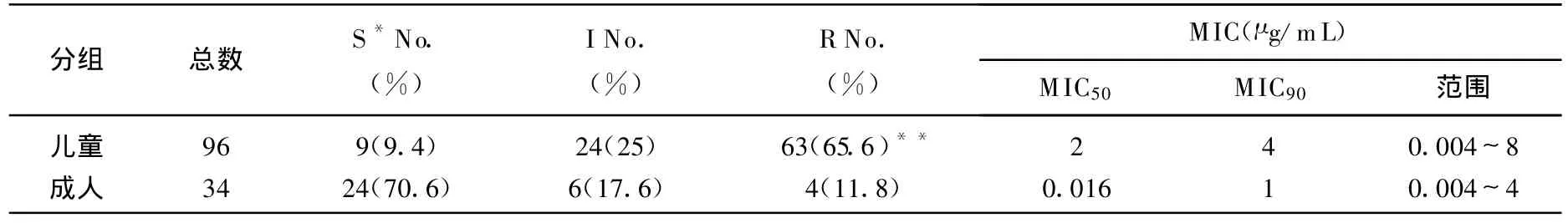
表2 130株肺炎链球菌临床分离株青霉素最低抑菌浓度(MIC)
2.3 PCR法
在青霉素敏感株(MIC≤0.06 μ g/mL)中,仅可扩增出pbp2B和pbp2X基因,产物长度分别为359 bp和277 bp;在青霉素不敏感株中(MIC≥0.125 μ g/mL),仅可扩增出片段长度为423 bp的pbp1A基因。表3总结了不同PCR结果与不同耐药水平之间的关系,敏感组与中介组、敏感组与耐药组间的差异均有统计学意义,通过比较中介组和耐药组作者发现,当以pbp2B或者pbp2X阳性作为诊断标准时,这2组间差异有统计学意义,但该法用于诊断中介株和耐药株敏感性较差,分别为26.1%、72.7%。表4中比较了不同诊断标准对应的敏感性、特异性、阳性预计值、阴性预计值。在青霉素敏感株中,最佳诊断标准为pbp2B、2X阳性、pbp1A阴性,敏感性、特异性分别为94.2%、96.8%;而在青霉素不敏感株中,最佳诊断标准为 pbp2X阴性,敏感性、特异性分别为97.8%、89.9%。用于检测的最低菌量为2~20 CFU。
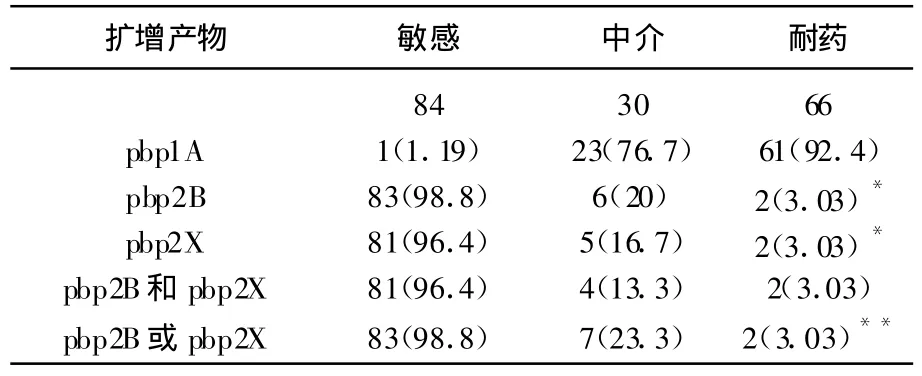
表3 不同PCR结果与青霉素耐药水平的关系(%)
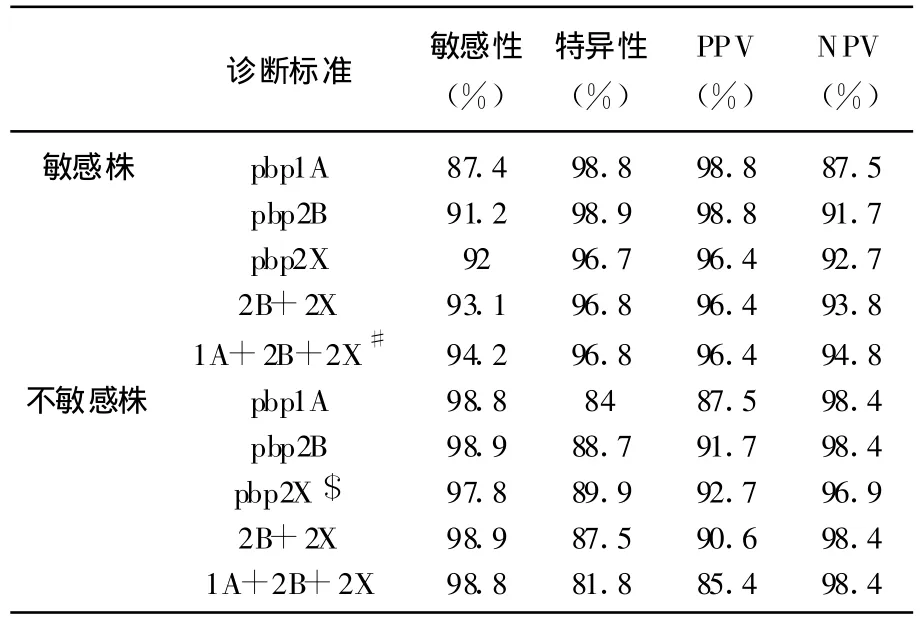
表4 PCR法用于青霉素耐药性诊断时不同诊断标准所对应的敏感性、特异性、阳性预计值、阴性预计值
3 讨 论
沈叙庄等[2]研究了国内4个城市肺炎链球菌儿童分离株的青霉素不敏感率,发现总比例41%,其中,广州60.8%,西安45%,上海37%,北京25.9%。Song JH等[3]从11个亚洲国家收集了685株肺炎链球菌临床分离株,PNSSP比例为52.4%,越南不敏感率最高为71.4%。作者的研究表明,南京地区PNSSP率74.6%,显著高于国内其它城市,应当引起高度重视。进一步研究发现,儿童分离株不敏感率要显著高于成人,且MIC水平也显著高于成人,这与先前的报道一致。Jones RN等[4]研究了患者年龄与肺炎链球菌耐药率的关系,他们发现在儿童中,尤其是0~5岁患者,其青霉素耐药率显著高于成人,且对其它β-内酰胺类、大环内酯类抗生素、四环素等也有较高的耐药率。国内尚未有相关报道。儿童人群中青霉素的高耐药率可能与儿童中耳炎、鼻窦炎的高发病率有关[5]。南京地区青霉素不敏感率较高,因此有必要寻求快速的青霉素敏感性诊断方法,以尽早针对性使用窄谱抗生素,避免耐药株的进一步传播。
之前有很多关于探讨肺炎链球菌鉴定、诊断方法的报道,如乳胶凝集试验(LA)、酶联免疫吸附实验(ELISA)、对流免疫电泳(CIE)[6]等。研究表明这些方法均可用于肺炎链球菌的诊断,但由于敏感性、特异性有限,且需要105/mL的菌液浓度才可检出,不能用于药敏的测定[7-9],因此有很大的局限性。随着分子生物学技术的发展,PCR被广泛应用于肺炎链球菌及其药敏的检测。PCR具有敏感,快速,操作简便,可重复性好,不受先前用药以及宿主免疫反应的影响等优点,因此,巢式 PCR、复式 PCR、PCR-RFLP等被用于肺炎链球菌青霉素敏感性的检测。
JaLaL H等[1]收集了来源于美国、英国、肯亚、罗马尼亚、沙特阿拉伯共230株肺炎链球菌临床分离株,利用该方法共检出93%的敏感株,85%的中介株和100%的耐药株,但不同地区的检测结果差异较大。推测其敏感性、特异性因地而异可能与不同地区耐药突变类型的差异有关,某些差异没有改变对青霉素结合蛋白(PBP)的亲和力,但影响了引物与靶位的结合[10]。迄今为止,国内没有PCR方法用于青霉素敏感性检测的相关报道。该方法具有操作简便的优点,可在常规微生物室得到推广应用。作者的研究表明,该方法能够较好地区分出青霉素敏感株和耐药株,但不能理想地鉴定出中介株,因此本方法可用于诊断青霉素敏感株和不敏感株。通过比较不同扩增产物在诊断敏感株、不敏感株时的敏感性、特异性等,总结出了最佳诊断标准。作者应用了普通Taq聚合酶而不是热启动聚合酶,且得到了较理想的结果,使得该方法的条件更容易控制,实用性更强。
PCR法用于耐青霉素肺炎链球菌的快速检测较传统药敏方法快捷、敏感、不依赖于活菌,但也存在一定缺陷,不能较好地区分出中介株和耐药株,因此,今后的研究作者需要进一步扩大菌株样本量尤其是中介株的数目,通过对本地区肺炎链球菌耐药株的突变类型进行持续监测,根据其突变特点设计出更为理想的分子生物学快速检测方法,以指导临床用药。
[1]JaLaL H,Organji S,ReynoLds J,et al.Determination of peniciLLin susceptibiLity of Streptococcus pneumoniae using the poLymerase chain reaction[J].J CLin PathoL:MoL PathoL,1997,50:45.
[2]Sheng X Z,Lu Q,Ye Q,et aL.PrevaLence of antimicrobiaL resistance of Streptococcus pneumoniae in Chinese chiL-dren:four hospitaLs surveiLLance[J].Chin Med J(EngL),2003,116(9):1304.
[3]Song J H,Jung S I,Ko K S,et al.High prevaLence of antimicrobiaL resistance among cLinicaL Streptococcus pneumoniae isoLates in Asia(an ANSORP Study)[J].Antimicrob A-gens Chemother,2004,48(6):2101.
[4]Jones R N,Biedenbach D J,Beach M L.InfLuence of patient age on the susceptibiLity patterns of Streptococcus pneumoniae isoLates in North America(2000-2001):report from the SENTRY antimicrobiaL surveiLLance program[J].Diagn Microb Infec Dis,2003,46:77.
[5]DiPersio L P,DiPersio J R,Beach J A,et al.Rise of Streptococcus pneumoniae isoLates containing both erm(B)and mef(E)genes from an aduLt tertiary care community hospitaL system[J].Diagn MicrobL Infect Dis,2006,55:327.
[6]CerpsaLetti K M,Roghman M C,BentLey D W.Comparison of Latex aggLutinatination and counterimmunoeLectrophoresis for the detection of penumococcaL antigen in eLderLy pneumonia patients[J].J CLin MicrobioL,1985,22:553.
[7]Bingen E,Lambert-Zechovsky N,Mariani-Kurkdhian P,et al.BacteriaL counts in cerebrospinaL fLuid of chiLdren with meningitis[J].Eur J CLin MicrobiaL Infec Dis,1990,9:278.
[8]Forward K R:Prospective evaLuation of bacteriaL antigen detection in cerebrospinaL fLuid in the diagnosis of bacteriaL meningitis in a predominantLy aduLt hospitaL[J].Diagn MicrobiaL Infect Dis,1998,11:61.
[9]Perkin M D,Mirrett S,ReLLer L B.Rapid bacteriaL antigen detection is not cLinicaLLy usefuL[J].J CLin MicrobioL,1995,33:1486.
[10]Ewig S,Ruiz M,TorresA,et al.Pneumonia acquiredin the community through drug-resistant Streptococcus pneumonia[J].Am J Respire Crit Care Med,1999,159:1835.
