X射线对体外培养乳鼠心肌细胞损伤的初步实验研究
2010-05-25张三典
周 锋 张三典
(江苏省江阴市中医院检验科,214400)(江苏苏州大学附属第一医院,215000)
近年来,放射诱发的心脏操作性病变日益增多,逐渐成为影响放射治疗疗效的重要因素之一。研究表明:人类心脏受照小部分,心肌细胞可发生凋亡[1]。有学者认为,尽管辐射诱发细胞损伤无论在体内或体外均不是细胞杀伤的主要模式,但射线诱发的细胞损伤在体内仍有一定作用[2]。细胞损伤在心脏的生理、病理发展过程中起着重要作用,被认为是心脏由代偿性变化向病理性变化发展的细胞学基础。由于心肌细胞的损伤,从而诱发了多种心血管系统疾病及临床综合症的发生发展。国内外许多文献报道了放射与心肌细胞损伤的相关性研究,为进一步研究放射对心肌细胞的影响,本文利用体外培养乳鼠心肌细胞为实验模型,通过不同放射剂量 X射线照射心肌细胞,利用全自动生化分析仪定量测定心肌细胞培养上清液中的乳酸脱氢酶的含量变化,来评价放射诱发心肌细胞损伤程度,并从细胞形态学的改变进一步评价 X射线对心肌细胞的损伤,从而为探讨 X射线对心脏损伤及其防护提供新的实验依据。
1 材料和方法
1.1 实验动物 选用出生 1天~ 3天的 Sp raque-Daw ley乳鼠,由苏州大学医学院实验动物中心提供。
1.2 主要试剂 乳酸脱氢酶(LDH)试剂盒由日本一化公司提供;吖啶橙(AO)、碘化丙啶(PI)试剂盒均为 Sigma公司产品。
1.3 仪器
1.3.1 Heraeus二氧化碳培养箱 BB16/BB5060型:美国 HERAEUS公司。
1.3.2 KD-2 6MV直线加速器:德国西门子公司。
1.3.3 OLYM PUS2700全自动血生化分析仪:日本 OLYM PUS公司。
1.3.4 Leica TCSSP2激光扫描共聚焦显微镜系统M RC-1024型:Bio-Rad公司。
1.4 方法
1.4.1 心肌细胞培养 出生 1天~ 3天的乳鼠(雌雄兼用),参照 Sadoshima[3]等介绍的方法。常规以碘酒、酒精消毒,剪开胸腔,无菌条件取出心脏,放入无钙镁 PBS溶液中,剪去心房及主动脉,将心室组织剪成 1mm~3mm碎片后,用 0.25%胰酶 37℃水浴消化 20min,收集细胞,打匀后吸出上层,反复 5次~ 6次。混悬液 2000r/min,离心 10min。弃上清液后用 DM EM洗涤,混悬液 2000r/min,离心 10min,弃上清液,加 DMEM培养液(含 20%小牛血清 )制成细胞悬液,置于培养瓶中培养,待细胞贴壁后,用差速贴壁法,于 5%CO2,37℃细胞培养箱中,孵育90min,由于纤维细胞较心肌细胞更易于贴壁,用此法可使大部分纤维细胞贴壁[4],取富含心肌细胞的培养液。转移至另一培养瓶中继续培养。
按此法培养的心肌细胞,于培养后 24h即可见部分细胞收缩,更换含 15%小牛血清的 DMEM培养液继续培养,每 3天换培养液 1次,取第 4天的细胞进行实验研究。
1.4.2 心肌细胞的 X射线照射 取对数生长期的心肌细胞,将贴壁心肌细胞消化制成细胞悬液,用DMEM培养基将细胞调至 3×105/m l,根据实验设计平均分为 6组 (每组 4瓶),继续培养 3天后,分别置入 5m l离心管,封管并标明组别,至西门子 KD-2直线加速器下放射,采用 6MV-X线垂直照射,放射野面积 10cm×10cm大小,射野源皮距 100cm,剂量率输出 DT200cGy/m in,分别以 10Gy、20Gy、30Gy、40Gy和 50Gy作用心肌细胞。正常心肌细胞对照组不照射。
1.4.3 照射后细胞培养上清液中乳酸脱氢酶(LDH)含量的检测 将上述各实验组带回实验室继续培养,对照组换无血清培养基,分别在换液后第24h收集各组心肌细胞上清液,用全自动生化分析仪测定心肌细胞培养上清液中乳酸脱氢酶的含量。
1.4.4 激光扫描共聚焦显微镜观察放射后心肌细胞损伤 根据上述心肌细胞培养上清液中乳酸脱氢酶含量的测定结果,选用 DT40Gy X射线组作为心肌细胞形态学改变模型,并设正常心肌细胞对照组,观察第 24小时后心肌细胞损伤的形态学改变。实验步骤如下:(1)各组细胞分别置入放有盖玻片的 24孔培养板中,放入 37℃,5%CO2培养箱培养 24h,待细胞爬片。 (2)吸去培养液,用 PBS液洗涤 2次,加入 1m l PBS;(3)分别加入终浓度为 5μg/m l吖啶橙(AO)和终浓度为 10μg/m l碘化丙啶(PI)孵育爬片细胞;(4)放入 37℃温箱 30min染色;(5)取出爬有心肌细胞的盖玻片反置于载波片上,至激光扫描共聚焦显微镜下观察细胞并判断。
2 结果
2.1 经 DT40Gy辐射剂量照射心肌细胞后第 24小时,用(AO/PI)双染色法在激光扫描共聚焦显微镜下可观察到典型的心肌细胞损伤的形态学改变(如核固缩、核碎裂、胞内空泡形成)。
2.2 不同放射剂量的 X射线对培养上清液中心肌细胞 LDH释放量不同 心肌细胞有较高的辐射抗性,在单次大剂量放射 10Gy~ 30Gy时,乳鼠心肌细胞培养上清液中 LDH释放量虽随放射剂量的增大而增加,但 LDH释放量变化不明显(P> 0.05);当放射剂量≥40Gy时,心肌细胞培养上清液中 LDH释放量显著增加,统计学显示有意义(P<0.05)。见附表。
3 讨论
近年来随着肿瘤放化疗综合治疗的广泛应用和临床疗效的提高,某些肿瘤患者的生存期明显延长,一些胸部肿瘤接受放疗而引发的心脏放射损伤变得较为常见,且日益引起人们的重视[5]。国内外流行病学调查和动物实验证明,放射对心脏有直接的损伤作用。随着分子生物学向放射医学领域的渗透,人们对辐射引起细胞损伤的认识达到了一个新的高度。但目前对放射诱发心脏损伤机制还并不十分清楚。尽管在体内乳酸脱氢酶主要存在于骨骼肌中,其次才是心脏,然而在离体培养心肌细胞内,LDH的活性却反映了心肌细胞内糖酵解产能和氧化磷酸化产能系统的功能状态[6]。乳酸脱氢酶(LDH)是心肌细胞的胞浆酶。在正常情况下,LDH存在于细胞内,当心肌细胞受到损伤后,细胞膜通透性增加,胞内大量LDH漏出至细胞间隙和体液,而心肌细胞损伤后酶从胞浆中漏出与细胞膜的功能受损有关。故心肌细胞培养基中乳酸脱氢酶含量,可作为评价心肌细胞损伤程度的指标之一。
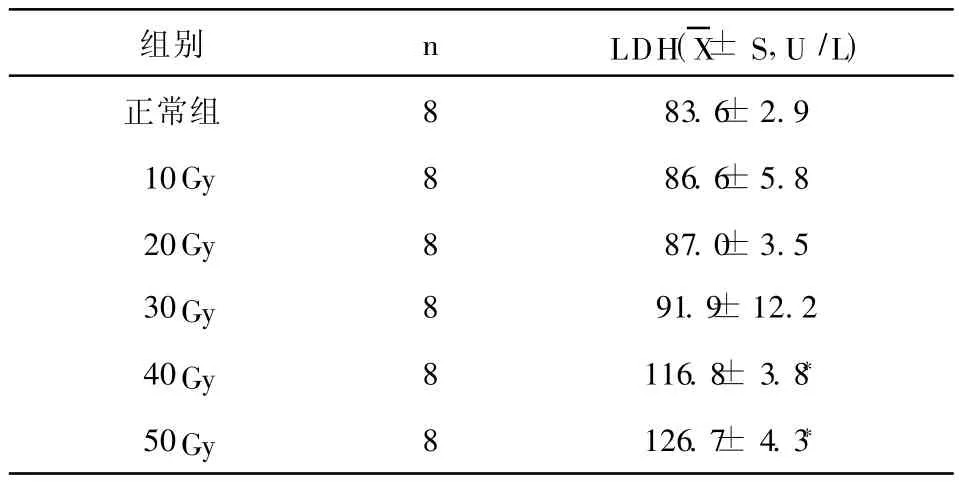
附表 不同放射剂量下培养上清液中心肌细胞LDH释放量
本实验结果显示,心肌细胞有较高的辐射抗性,在单次大剂量放射 10Gy~30Gy时,乳鼠心肌细胞培养上清液中 LDH释放量虽随放射剂量的增大而增加 (重复 2次),但 LDH释放量变化不明显 (P>0.05);当放射剂量≥40Gy时,心肌细胞培养上清液中 LDH释放量显著增加(重复 2次),统计学显示有意义(P<0.05)。这提示我们放射线对心肌细胞有直接损伤作用。
AO[7]为一种活性染料,对活细胞及死细胞均能染色,PI[8]只对失去膜完整性的细胞染色。在共聚焦显微镜下,细胞核 DNA为黄色或黄绿色均匀荧光,细胞质和核仁的 RNA为桔黄或桔红色荧光。细胞受损伤时,细胞核和细胞质内可见致密浓染的黄绿色,甚或黄绿色碎片。细胞坏死时,细胞质内黄绿色或桔黄色荧光减弱或消失。细胞损伤早期,细胞膜结构尚完整,阳离子染料 PI无法进入细胞内。细胞损伤晚期胞膜结构被破坏,PI可以进入细胞内使核染色质着红色。因此,同时使用这两种荧光染料对细胞染色时,仅有 AO着色的为早期损伤细胞,仅有 PI着色的为坏死细胞,两种染料双阴性者为正常活细胞,双阳性者为继发性坏死细胞。故早期损伤细胞呈致密浓染的黄绿色,由于染色质凝聚及核裂解,细胞核中常有桔红色斑点。晚期损伤细胞可被 AO染成致密浓染的黄绿色,甚至可见黄绿色碎片,其细胞核也常呈损伤的特征性变化。
本实验结果发现,经 DT40Gy放射剂量照射心肌细胞后第 24小时,培养乳鼠心肌细胞发生明显的细胞损伤的形态学改变(如脱核、核碎裂、胞质空泡形成等)。
对放射诱导心肌细胞死亡的机制,一般认为,放射线导致的细胞死亡是通过放射线的间接作用生成活性氧等有害基因而形成的。放射通过“直接作用”和“间接作用”产生大量自由基而杀伤细胞[9]。辐射诱发细胞损伤不但与细胞的辐射敏感性有关[10],而且与细胞类型也有很大关系,辐射敏感细胞就比辐射抗性细胞易发生损伤。另外,细胞损伤与生物体的生理节律也有关,即细胞周期各时相对射线引发的细胞损伤敏感性也不同。
由于实验条件及时间所限,未能分别从放射后不同时间点跟踪检测心肌细胞培养基中乳酸脱氢酶含量,从而更好地评价放射与心肌细胞损伤的关系,这还有待进一步研究。
1 ColucciWS.Apoptosis in the heart[J].N Engl JM ed,1996,335:1224~1226.
2 胡野.凌志强.单小云.等.主编.细胞凋亡的分子医学(第一版)[M].北京:军事医学科学出版社.2002,438~ 448.
3 Sadoshima J,Jahn L,Takahashi T,et al.M olecular characterization of the stretch-inducedadaptation of cultu red cardiac cells[J].Biol Chem,1992,267:10551~ 10560.
4 Polinger IS.Separation of cell types in embryonic heart cultu re[J].Exp Cell Res,1970,63:78~ 82.
5 Gag liardi G,Lax I,Rutqvist LE.Partial irradiation of the heart[J].Sem in Radiat Oncol,2001,11:224~ 233.
6 文琛.曹庆淑.马惠敏.等.脱氢酶在心肌细胞的定位及缺血后的变化,解剖学杂志 .1994,17(6):514~ 518.
7 M ichel A H,Frank T,Zbigniew D,Exp.Cell Res.,1992,201,184~ 191.
8 Douglas JE E,Angela H,Diane JH,Christos P,Cancer Res.,1996,56,2273~ 2276.
9 Mac lellan WR,Schneider MD,Prog ramm ed cell death in cardiovascular biology and disease[J].Cir Res,1997,81(1):137~ 144.
10 Ruizde A Inodovar JM,Nunez M I,M c M illan T J,et al.Initial radiation-induced DNA damage in human tumor cell lines:a correlation w ith in trinsic cellular radiosensitivity[J].Br JCancer,1994,69(3):457~ 462.
