乙脑病毒prME蛋白与鼠GM-CSF编码基因的融合构建与表达
2010-05-25翟永贞周言马力冯国和
翟永贞,周言,马力,冯国和
(中国医科大学 附属盛京医院感染科,沈阳 110004)
流行性乙型脑炎 (Japanese encephalitis,JE)DNA疫苗的免疫效果已经得到实验证实,编码流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)各种结构蛋白或非结构蛋白基因重组子能够提供不同程度的保护性免疫,免于JEV病毒攻击[1];通过比较上述重组质粒在分别免疫动物后所产生的中和抗体效价与保护性免疫效果,发现将前膜(prM)蛋白与包膜(E)蛋白编码基因联合构建于同一表达载体所产生的免疫效果明显优于单纯含E蛋白编码基因重组子[2]。然而同现有JE灭活或减毒活疫苗免疫效果比较,DNA疫苗诱导的中和抗体产生时间、抗体效价增长速度[3]、效价绝对值还达不到预期标准[4]。JEDNA疫苗增强效应的研究已越来越受到人们的重视。
粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony-stimulating factor,GM-CSF) 编码基因已经被应运于JE DNA疫苗增强效应的研究,研究证实GM-CSF编码基因重组子能够增加抗JEV总抗体以及中和抗体效价,提高免疫动物生存率[5]。目前国内外尚未研究报道有关JEDNA疫苗与GM-CSF编码基因的融合构建与表达。本项研究构建JEV prME蛋白与BALB/c鼠GM-CSF编码基因真核重组表达载体,以脂质体法转染中华仓鼠卵巢(Chinese hamster ovary,CHO)细胞并建立融合蛋白稳定表达株,为JEDNA疫苗增强效应的深入研究提供实验依据。
1 材料与方法方法部分要删减
1.1 质粒、细胞及主要试剂
含JEV prME蛋白编码基因重组质粒被命名为pJME,由感染科实验室构建[6],所选真核表达载体为pcDNA3,在BamH I与EcoR I酶切位点间插有JEV prME蛋白编码基因。原核表达载体pMD19-T simple[Code No.D104C]购自Takara公司,用于BALB/c鼠GM-CSF编码基因测序。真核表达载体pcDNA3.1(+)购自 Invitrogen公司,用于 JEV prME蛋白与GM-CSF编码基因的融合构建。CHO细胞购自中国科学研究院上海细胞库,生长于37℃,5%CO2及含 10%胎牛血清(fatal calf serum,FCS)的 Dulbecos modified eagle medium(D-MEM)中,脂质体(Lipofectamine2000)购自Invitrogen公司,分别用于转染实验中受体细胞及转染试剂。大肠杆菌JM109与DH5α,限制性内切酶EcoRI、BamH I以及Not I等均购自Takara公司,用于重组质粒构建、转化及酶切鉴定。新霉素类似物(G418)购自GiBCO公司,用于CHO细胞抗性克隆株的筛选。山羊抗鼠GMCSF购自Santa公司,辣根酶标记兔抗山羊IgG购自北京中山公司,电致化学发光(electrogenerated chemiluminescence,ECL) 检测试剂购自 Pierce公司,用于重组质粒转染后Western-blot分析。
1.2 BALB/c鼠GM-CSF编码基因的重组构建
从BALB/c鼠脾脏获取细胞总RNA,采用套式-RT-PCR法扩增GM-CSFCDS区域序列(426 bp)。反转 录 引 物 :5′-CAGGCACAAAAGCAGCAGTC-3′;PCR外引物:上游引物为5′-CAGAGAGAAAGGCTAAGGTC-3′,下游引物为上述反转录引物;PCR内引物:上游引物为 5′-GAATTCGGTGGAGGCGGTTCAGGTGGAGGTGGTTCAGGAGGAGGTGGATC GATGTGGCTGCAGAATTTAC-3′,下游引物为 5′-GCGGCCGCTCATTTTTGGCCTGGTTTTTTG-3′,用于PCR内引物的上游引物和下游引物的5’端分别引入EcoRI和Not I酶切位点,划线部分为由15个氨基酸组成的Gly-Linker。使用DNA片断纯化试剂盒(Takara,product No.DV807) 与 DNA A 尾试剂盒(Takara,product No.D404)分别对扩增的DNA片段进行纯化及“A”处理,使用琼脂糖凝胶DNA纯化试剂盒(Takara,product No.DV805)进行切胶回收DNA,按照DNA连接试剂盒(Takara,product No.D6023)说明书要求,后者与pMD19-Tsimple连接构建重组子pMD-GM-CSF,转化大肠埃希菌JM109。质粒小剂量提取试剂盒(Takara,product No.DV801A)提取重组质粒并经EcoRI/Not I进行酶切鉴定,采用ABIPRSMTM310Genetic Analyzer(Pekin-Elmer/Applied)及引物Bca BESTPrimer M13-47对重组质粒进行测序分析。将测序正确的目的基因经EcoR I/Not I双酶切并亚克隆到真核表达载体pcDNA3.1(+),将此重组子命名为pGM-CSF。
1.3 JEV prME蛋白与BALB/c鼠GM-CSF编码基因的融合构建
使用限制性内切酶BamH I/EcoR I对质粒pGM-CSF、pJME进行双酶切,将获取的JEV prME蛋白编码基因亚克隆至pGM-CSF的BamH I/EcoRI酶切位点之间,含有JEV prME蛋白与BALB/c鼠GM-CSF编码基因的重组子被命名为pJME/GMCSF。转化pJME/GM-CSF于大肠杆菌DH5α并经筛选后,分别经BamH I/EcoRI,BamH I/Not I酶切以及1%琼脂糖凝胶电泳鉴定。
1.4 pJME/GM-CSF转染及CHO细胞抗性克隆株筛选
确定本实验最佳G418浓度筛选:将常规培养的CHO细胞(1 000个/mL)加入24孔板(0.7 mL/每孔)孵育,6 h后每孔分别加入不同浓度的G418,依次为 600 mg/L,650 mg/L,700 mg/L,750 mg/L,800 mg/L,850 mg/L,900 mg/L,每种浓度设 3 个孔,余下3孔为正常细胞对照。培养11d后确定能杀死所有细胞的最低G418浓度作为本实验的最佳筛选浓度,即为800 mg/L。脂质体法转染pJME/GM-CSF于CHO 细胞[6],24 h 后将转染细胞按 1∶10传代,48 h后更换为含800 mg/L G418的D-MEM进行筛选,7 d后将G418浓度降为400 mg/L维持培养。
1.5 Western-blot分析
参照参考文献[7]并加以改进,收集pJME/GMCSF转染的CHO细胞,用细胞裂解液破碎细胞后收集总蛋白,12%SDS-PAGE凝胶电泳完毕后电转移至PVDF膜上,用含5%脱脂奶粉的TBST封闭1 h,加入山羊抗鼠GM-CSF多克隆抗体(1∶200稀释),4℃过夜,TBST洗涤10 min×3次,加入HRP标记的兔抗山羊的二抗(1∶50 000稀释),室温2 h,TBST洗涤10 min×3次,加入ECL试剂,显影、定影。方法部分内容太细,常规方法写明名称就可,不用详细介绍步骤。尽量节省版面。
2 结果
2.1 pJME/GM-CSF的重组构建
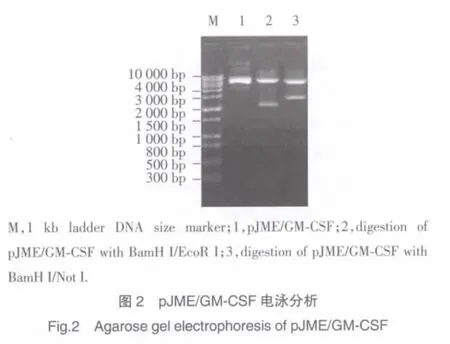
套式-RT-PCR法获得的GM-CSF编码基因经测序分析与发表的GM-CSFCDS区域序列相符合。将处理后的GM-CSF基因插入真核表达载体pcDNA3.1(+)EcoR I/Not I酶切位点,构建重组子pGM-CSF(图1)。pJME中JEV prME蛋白编码基因插入pGMCSF BamH I/EcoR I酶切位点,构建重组子pJME/GM-CSF(图 1,图 2 lane1)。pJME/GM-CSF 经 BamH I/EcoR I酶切释出插入子与prME蛋白编码基因片段(2 001 bp)大小相符(图 2 lane2),pJME/GM-CSF经BamH I/Not I酶切释出的插入子片段约为2 472 bp(图 2 lane3),为鼠 GM-CSF与 JEV prME蛋白编码基因大小之和。
2.2 G418筛选过程中pJME/GM-CSF转染的CHO细胞抗性克隆株的演变
G418最适筛选浓度为800 mg/L。将转染pJME/GM-CSF的CHO细胞加压筛选(800 mg/L G418)7 d,培养板中可见小细胞团簇形成,G418浓度减半(400 mg/L)维持培养26 d,普通光镜检查显示小细胞团簇逐步增大,细胞团簇之间逐渐融合(图3)。

2.3 pJME/GM-CSF转染的CHO细胞的Wester blot分析
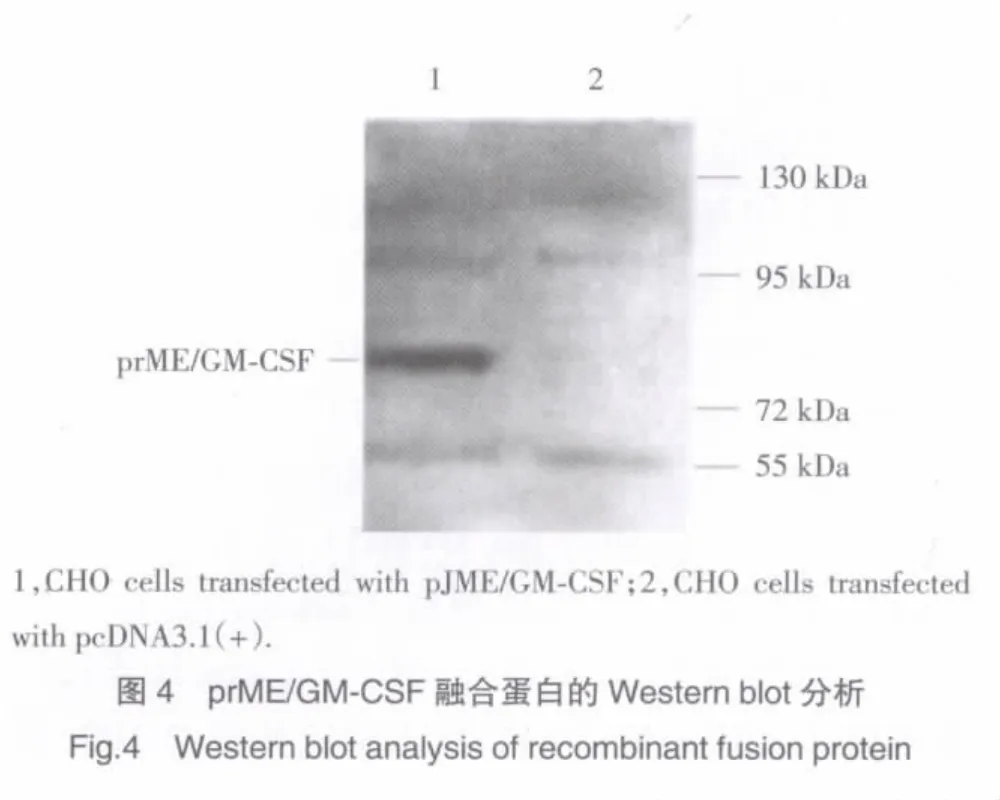
将pJME/GM-CSF转染的CHO细胞裂解并收集蛋白进行Western blot分析,在Mr为85×103区域内可见一特异性蛋白带,空载体转染的CHO细胞未见相应蛋白带(图4)。
3 讨论
许多研究表明,细胞因子基因佐剂对DNA疫苗所致的免疫应答有着重要的调节作用[8]。GM-CSF具有刺激树突状细胞分化与成熟、增强树突状细胞表面MHC以及共刺激分子表达等免疫促进功能,其编码基因被作为DNA免疫佐剂并用于许多感染性疾病和肿瘤性疾病DNA疫苗增强效应的研究[9]。通常采用三种方式将GM-CSF编码基因作为免疫佐剂用于DNA疫苗增强效应的研究,一种是将GMCSF编码基因与目的抗原基因构建于双顺反子真核表达载体;一种是分别将GM-CSF编码基因和目的基因构建于不同载体并共同注射动物模型,通过这种组合方式免疫,能够筛选出具有较强免疫效应的组合DNA疫苗;另一种是将GM-CSF编码基因和目的基因融合表达于同一载体,编码这种融合蛋白的DNA疫苗能够改善抗原特异性免疫应答和肿瘤性疾病的免疫治疗。
本实验将JEV prME蛋白编码基因与鼠GMCSF编码基因(2 001 bp、426 bp)以定向克隆的方法分别插至真核表达载体pcDNA3.1(+),构建重组子pJME/GM-CSF,后者经BamH I/EcoRI酶切释出的插入子与pJME经相同酶切释出插入子的分子量大小相一致(图2 lane2),从分子层面说明该重组子含有JEV prME蛋白编码基因,又经BamH I/Not I酶切释出的插入子分子量约为2 472 bp(图2 lane3),理论推算符合JEV prME蛋白编码基因与鼠GM-CSF编码基因的总和标准。DNA测序分析进一步明确了两个目的基因在真核表达载体中的正常连接,提示含JEV prME蛋白编码基因与鼠GM-CSF编码基因重组子pJME/GM-CSF构建成功。
将转染pJME/GM-CSF的CHO细胞加压筛选(800 mg/L G418)7 d后,继续以400 mg/L的G418维持培养,可见小细胞团簇逐步增大,细胞团簇之间逐渐融合(图3),说明pJME/GM-CSF转染的CHO细胞抗性克隆株逐步形成。进一步Western blot分析发现,pJME/GM-CSF转染的CHO细胞经裂解电泳后,在大于Mr约72×103以上区域内可检测到一特异性蛋白带,推算其Mr大小约85×103,进而明确了融合蛋白分子量,通过对融合蛋白氨基酸数目(824AA)的理论推算,所检测的融合蛋白分子量与理论计算相符合。本实验成功构建了JEV prME蛋白与鼠GM-CSF融合基因重组子,并建立CHO细胞稳定表达株,将为JEDNA疫苗增强效应等研究提供实验依据。
[1]Putnak R,Porter K,Schmaljohn C.DNA vaccinesfor flaviviruses[J].Adv.Virus Res,2003,61:445-468.
[2]Wu HH,Chen CT,Lin YL,et al.Sub-fragments of the envelope gene arehighly protectiveagainst the Japaneseencephalitisviruslethal infection in DNA priming-protein boosting immunization strategies[J].Vaccine,2004,22(5-6):753-800.
[3]Zhao Z,Wakia T,Yasui K.Inoculation of plasmidsencoding Japanese encephalitis virus-prM-Epritains with colloidal gold elicits a protectiveimmuneresponsein BALB/c mice[J].JVirol,2003,77(7):4248-4260.
[4]Ashok MS,Rangarajan PN.Protective efficacy of a plasmid DNA encoding Japanese encephalitis virus envelope protein fused to tissue plasminogen activator signal sequences:studies in a murine intracerebral viruschallenge model[J].Vaccine,2002,20(11-12):1563-1570.
[5]Bharati K,Appaiahgari MB,Vrati S.Effect of Cytokine-encoding plasmid delivery on immune response to Japanese encephalitis virus DNAvaccineinmice[J].Microbiol Immunol,2005,49(4):349-353.
[6]冯国和,赵桂珍,竹上勉,等.乙脑病毒prME与E蛋白编码基因重组构建的DNA免疫试验研究[J].中华微生物学和免疫学杂志,2002,22(5):505-509.
[7]Feng GH,Liu N,Zhou Y,et al.Immunologic analysis induced by DNA vaccine encoding E protein of Beijing-1 strain derived from Japaneseencephalitisvirus[J].Intervirology,2007,50(2):93-98.
[8]翟永贞,冯国和.流行性乙型脑炎DNA疫苗增强效应研究进展[J].国际儿科学杂志,2007,34(5):319-322.
[9]Wang J,Snider DP,Hewlett BR,et al.Transgenic expression of granulocyte-macrophage colony-stimulating factor induces the differentiation and activation of a novel dendritic cell population in the lung[J].Blood,2000,95(7):2337-2345.
