紫杉醇脂质体联合卡培他滨一线治疗晚期胃癌的临床观察
2010-05-22赵建国王建芳吴东平项晓军张凌熊建萍
赵建国,王建芳,吴东平,项晓军,张凌,熊建萍#
(1.浙江绍兴市人民医院放疗科,绍兴市 312000;2.南昌大学第一附属医院肿瘤科,南昌市 330006)
胃癌是全球常见的恶性肿瘤,发病率及死亡率分别居第4位和第2位;其中2/3发生在发展中国家,仅中国就占42%[1]。我国的胃癌患者确诊时大多数已属晚期,往往不能手术,化疗是晚期胃癌(AGC)主要的治疗手段之一[2]。ML17032研究显示,卡培他滨是治疗AGC的有效药物。紫杉醇治疗AGC患者也显示了良好的抗肿瘤活性,紫杉醇的联合方案有效率可达22%~65%,中位生存时间(MST)为6~14个月[3]。
紫杉醇水溶性小,在制剂过程中需用聚氧乙基蓖麻油和无水乙醇作为助溶剂,易产生过敏等严重不良反应。紫杉醇脂质体是用卵磷脂等将紫杉醇进行包裹,可提高药物的水溶性,从而减轻其毒副反应,特别是过敏反应的发生。2007年10月~2009年6月,笔者应用紫杉醇脂质体联合卡培他滨(PX方案)一线治疗34例AGC患者,疗效确切,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2007年10月~2009年6月南昌大学第一附属医院肿瘤科34例接受PX方案治疗的AGC患者的临床资料,均为远处转移、手术后复发和不能手术的患者,至少有1个可测量的病灶,所有病例均经病理学检查证实。其中,男性20例,女性14例;年龄32~72岁,中位年龄54岁;病理类型:低分化腺癌13例,中分化腺癌10例,黏液腺癌5例,管状腺癌4例,印戒细胞癌2例;原发部位:贲门6例,胃体10例,胃窦18例;转移部位:淋巴结转移22例,肝转移10例,肺转移4例,盆腔转移5例,骨转移3例。
1.2 治疗方法
1.2.1 化疗方案:紫杉醇脂质体(南京思科药业有限公司)175 mg·m-2加入5%葡萄糖注射液500 mL,ivgtt 3 h,第1天;卡培他滨(上海罗氏制药有限公司)2000 mg·m-2·d-1,分2次po,第1~14天。每3周重复。
1.2.2 预处理及对症治疗:使用紫杉醇脂质体前30 min,给予地塞米松(5 mg,iv)、苯海拉明(50 mg,im)、西咪替丁(300 mg,ivgtt)进行预处理。所有患者化疗前常规给予5-羟色胺3受体拮抗药预防呕吐反应。
1.3 观察指标
所有患者至少完成2个周期,每2个周期评价疗效。疗效评价参考实体瘤的疗效评价标准(RECIST标准),分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。总有效率(RR)根据CR与PR病例数之和计算。
毒性反应按美国癌症研究所常见毒性判定标准(NCI-CTC)(3.0版)抗癌药物毒性评价标准分为0~Ⅳ级。疾病进展时间(TTP)为自一线化疗开始至疾病进展时间。生存时间(OS)为自一线化疗开始至死亡或末次随访的时间。
1.4 随访
采用电话与信件方式进行随访,随访截止时间为2009年10月31日。
1.5 统计学方法
应用SPSS13.0软件进行统计,Kaplan-Meier法计算MST、中位疾病进展时间(mTTP),绘制相应曲线。
2 结果
2.1 一般情况
34例患者共接受162个周期的化疗,最少2周期,最长9周期,中位为5周期。14例患者因化疗毒性而延迟治疗,其中延迟时间小于7 d 11例,大于7 d 4例;3例患者因化疗毒性减少化疗药物剂量;无病例因毒性反应中止治疗;无治疗相关死亡。32例患者可评价疗效。中位随访时间为11.5个月,因联系电话和居住地变更失访2例(5.9%)。
2.2 疗效
32例可评价疗效的患者中,CR1例(3.1%),PR16例(50.0%),SD12例(37.5%),PD3例(9.4%),RR为53.1%。mTTP为 6.0个月(95%CI:5.43~6.57),34例 AGC 的 Kaplan-Meier疾病进展时间曲线见图1;MST为10.8个月(95%CI:9.59~12.01),34例AGC患者的Kaplan-Meier生存时间曲线见图2。
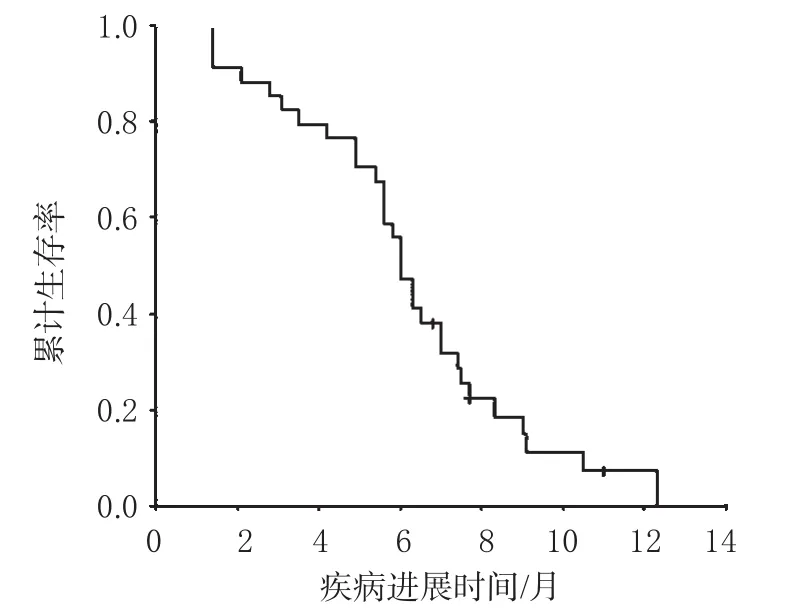
图1 34例AGC患者的Kaplan-Meier疾病进展时间曲线Fig 1 Time curves of disease procession in Kaplan-Meier analysis in 34 patients with advanced gastric cancer
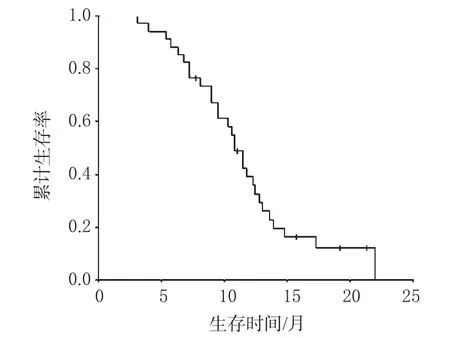
图2 34例AGC患者的Kaplan-Meier生存时间曲线Fig 2 Survival curves of 34 patients with advanced gastric cancer in Kaplan-Meier analysis
2.3 毒性反应
血液学毒性反应:白细胞减少、中性粒细胞减少、血小板减少及贫血总的发生率分别为61.8%、52.9%、11.8%、35.3%,其中Ⅲ/Ⅳ级白细胞减少、中性粒细胞减少及贫血的发生率分别为17.6%、20.6%、5.9%,未发生Ⅲ/Ⅳ级的血小板减少,未发生中性粒细胞缺乏伴发热。非血液学毒性较轻,多数为Ⅰ/Ⅱ级,Ⅲ/Ⅳ级发生率低,仅恶心/呕吐、腹泻、口腔黏膜炎及手足综合征等发生了Ⅲ/Ⅳ级毒性反应,发生率分别为8.8%、5.9%、2.9%、5.9%,PX方案治疗34例AGC患者的毒性反应见表1。
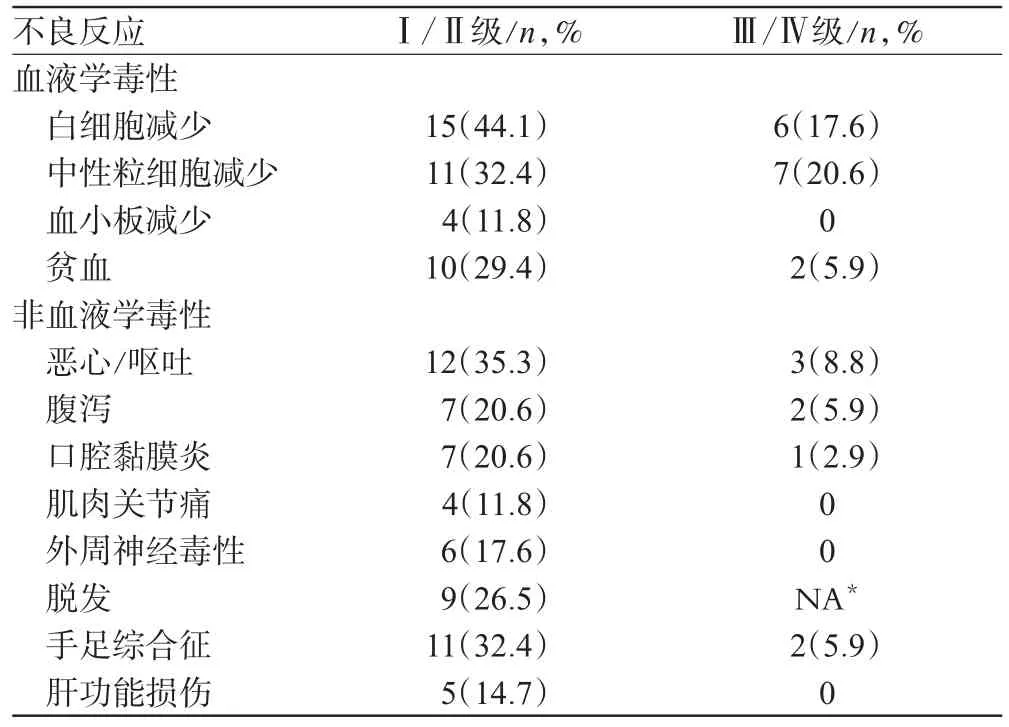
表1 PX方案治疗34例AGC患者的毒性反应Tab 1 Adverse reaction occurred in 34 advanced gastric cancer patients after treated with PX regimen
3 讨论
全身化疗可提高AGC患者的生活质量并延长生存期,但是AGC一线化疗尚无全球范围内的标准方案[4]。
紫杉醇类药物主要是通过抑制微管解聚使肿瘤细胞的有丝分裂终止,促使肿瘤细胞凋亡,最后导致肿瘤细胞死亡。在V325研究中,加用多西紫杉醇组成的DCF方案使AGC患者获得了生存获益,同时毒副反应发生率也明显增高,Ⅲ/Ⅳ级中性粒细胞减少发生率高达82%[5]。近年来,多项国外Ⅱ期临床研究显示,紫杉醇联合方案治疗AGC的RR可达22%~65%,MST为6~14个月[3];国内学者报道,紫杉醇联合方案的RR高达68%[6]。上述研究显示,紫杉醇联合方案的近期疗效和远期生存与多西紫杉醇联合方案相近,但前者的毒性反应发生率较低,提示紫杉醇替代多西紫杉醇组成联合方案是一种可选的改良方案。
卡培他滨是氟尿嘧啶类新一代口服药,因其在体内的三步激活过程,使其具有靶向作用,且毒副反应显著降低。在REAL-2研究中,与参照方案(ECF方案)相比,EOX组MST的延长具有统计学意义(P=0.02),认为卡培他滨可以替代氟尿嘧啶一线治疗AGC[7]。在ML17032[8]国际多中心Ⅲ期随机临床研究中,采用XP(卡培他滨+顺铂)方案与FP方案治疗AGC进行非劣性对比研究,结果显示在mTTP、MST等方面XP方案并不劣于FP,研究者认为XP方案是FP有效的替代方案。
由于紫杉醇水溶性小,在制剂过程中需用聚氧乙基蓖麻油和无水乙醇作为助溶剂,因此临床使用传统紫杉醇易出现因混合溶媒引起的过敏反应,即使使用预处理方案仍然有少数患者会出现危及生命的超过敏反应症状。紫杉醇脂质体是将难溶于水的紫杉醇包封在新型药物载体——脂质体磷脂双分子层中,用卵磷脂等将紫杉醇进行包裹,提高药物的水溶性,从而减轻其毒副反应,特别是过敏反应的发生[9]。
在Kang HJ等的Ⅱ期临床研究中,采用紫杉醇联合卡培他滨治疗45例初治AGC患者,RR为48.9%,mTTP为5.6个月,MST为11.3个月[10]。伍小平等[11]采用紫杉醇联合卡培他滨治疗31例AGC患者,RR为51.6%,其中CR3.2%,PR48.4%;mTTP为5.3个月,MST为11.4个月。本研究的近期有效率及远期生存时间均与上述文献报道相仿。
在Kang HJ等[10]的研究中,Ⅲ/Ⅳ级血液学毒性主要为中性粒细胞减少,其发生率为46.5%,Ⅲ/Ⅳ级贫血较少见,发生率为7%,未发生Ⅲ/Ⅳ级血小板减少;Ⅲ/Ⅳ级非血液学毒性主要表现为手足综合征、关节痛、乏力,其发生率分别为9.3%、9.3%、4.7%。国内学者的报道[11],紫杉醇联合卡培他滨方案的血液学毒性发生率为54.8%,恶心/呕吐为48.4%,腹泻为45.2%,黏膜炎为25.8%,手足综合征为51.6%,脱发为93.6%,肌肉关节痛为32.2%。本研究的血液学毒性与上述文献报道相近,脱发、肌肉关节痛等非血液学毒性低于传统紫杉醇相关文献报道的发生率,且使用紫杉醇脂质体无需预处理,可减少激素使用量,更适合于化疗耐受性较差及不宜大量使用激素的患者。
虽然本研究为回顾性分析,缺乏随机对照组,样本量较小,尚不能得出明确优劣性结论,但是本研究显示紫杉醇脂质体联合卡培他滨一线治疗AGC的疗效确切,不良反应轻,耐受性好,尤其适合于化疗耐受性较差及不宜大量使用激素的AGC患者。因此,值得进行进一步随机对照研究。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74.
[2]赵建国,熊建萍,项晓军,等.表柔吡星联合奥沙利铂、氟尿嘧啶一线治疗晚期胃癌的临床观察[J].癌症,2009,28(1):54.
[3]Eric VC,陈奕贵.晚期胃癌治疗:紫杉醇类药物应用新发现[J].癌症进展,2005,3(4):367.
[4]Zhao JG,Qiu F,Xiong JP,et al.A phaseⅡstudy of modified FOLFOX as first-line chemotherapy in elderly patients with advanced gastric cancer[J].Anticancer Drugs,2009,20(4):281.
[5]Van Cutsem E,Moiseyenko VM,Tjulandin S,et al.PhaseⅢstudy of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer:a report of the V325 Study Group[J].J Clin Oncol,2006,24(31):4991.
[6]周宁宁,周中梅,刘茂珍,等.紫杉醇和5-氟尿嘧啶/醛氢叶酸双周疗法治疗晚期胃癌的初步报告[J].癌症,2003,22(8):867.
[7]Cunningham D,Starling N,Rao S,et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl J Med,2008,358(1):36.
[8]Kang YK,Kang WK,Shin DB,et al.Capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer:a randomised phase Ⅲ noninferiority trial[J].Ann Oncol,2009,20(4):666.
[9]Straubinger RM,Arnold RD,Zhou R,et al.Antivascular and antitumor activities of liposome-associated drugs[J].Anticancer Res,2004,24(2A):397.
[10]Kang HJ,Chang HM,Kim TW,et al.A phaseⅡstudy of paclitaxel and capecitabine as a first-line combination chemotherapy for advanced gastric cancer[J].Br J Cancer,2008,98(2):316.
[11]伍小平,庄英帜,姜 浩,等.紫杉醇联合希罗达治疗晚期胃癌31例[J].世界华人消化杂志,2007,15(26):2844.
