十字花科植物中主要硫代葡萄糖苷合成与调节基因的研究进展
2010-05-21杨丽梅方智远刘玉梅张扬勇孙培田
程 坤 杨丽梅 方智远 刘玉梅 庄 木 张扬勇 孙培田
(中国农业科学院蔬菜花卉研究所,北京 100081)
硫代葡萄糖苷(Glucosinolates,GS,简称硫苷)又称芥子油苷,是一种含氮、硫的重要植物次生代谢产物,主要存在于十字花科植物中,如白菜、甘蓝、油菜、芥菜、花椰菜、芜菁、萝卜等,并且所有的十字花科植物都能合成硫苷(廖小军 等,1999;Halkier & Gershenzon,2006)。
硫苷都具有相同的基本结构,包括含糖基团、硫酸盐基团和可变的非糖侧链(R)各一个。根据R的不同,可将其分成脂肪族(Aliphatic)、芳香族(Aromatic)和吲哚族(Indolyl)三类(Mithen,2001;李鲜 等,2006)。硫苷一般贮存于植物细胞液泡中,而硫代葡萄糖苷酶(通常称芥子酶)则位于特定的蛋白体中,在正常情况下,两者是分离的,相对稳定。当植物组织受到机械损伤或者昆虫侵害时,细胞的代谢区隔被破坏,硫苷与芥子酶相遇而发生水解反应,生成异硫氰酸盐(Isothiocyanates)、硫氰酸脂(Thiocyanates)和腈类(Nitriles)等降解产物(汪俏梅和曹家树,2001;郑建仙,2005)。硫苷与这些降解产物具有多种生物学功能,如参与植物防卫反应、刺激昆虫取食、预防癌症发生、赋予植物特殊风味等(陈亚洲和阎秀峰,2007;申树芳 等,2009),因而硫苷引起了植物学、医学、畜牧学、食品科学等众多领域学者的关注。近年来,随着在模式植物拟南芥上研究的深入,人们已经确定了硫苷生物合成的大部分中间产物,而硫苷的主要合成基因和调节基因也得到了证实,比如MYB、MAM、CYP79/CYP83、AOP等基因家族都在硫苷合成的不同阶段发挥着重要的调控作用(汪俏梅和曹家树,2001;钟海秀 等,2007)。
1 十字花科植物中硫代葡萄糖苷的生物学功能
硫苷在十字花科植物的生活周期中起着重要的作用,但它在生物学上是相对惰性的,有时要靠它的降解产物异硫氰酸盐等来发挥生理功效。硫苷及其降解产物能参与植物的防卫反应,起抗虫、抗病等作用。硫苷及其降解产物对昆虫有毒,它们通过减少昆虫体内总氧气的吸入和CO2的呼出,抑制了糖酵解-克雷布斯循环,从而改变昆虫的新陈代谢能力,导致昆虫生长缓慢甚至死亡(Pracros et al.,1992;陈亚洲和阎秀峰,2007)。另一方面,硫苷及其降解产物在害虫与植物的识别中发挥作用,一些挥发性的异硫氰酸盐可作为摄食或产卵的刺激物吸引十字花科植物害虫。异硫氰酸盐对多种病原体、细菌、真菌都具有毒害作用,比如吲哚类硫苷及其降解产物与十字花科植物中危害最大的真菌性病害根肿病的发育有关(Ludwig-Müller et al.,1999;汪俏梅和曹家树,2001)。异硫氰酸盐具有抗癌功能,通过双重机制来特异性地调节肿瘤细胞的代谢,即选择性使阶段Ⅰ酶失活(例如细胞色素P450酶)和诱导阶段Ⅱ酶(例如苯醌还原酶和谷胱甘肽转移酶)的表达,阻断肿瘤细胞产生的代谢途径,抑制癌细胞的分裂和生长(Fahey et al.,1998;郑建仙,2005)。异硫氰酸盐还能使十字花科蔬菜产生不同的特殊风味,如白菜类的清鲜味、萝卜的辛辣味等(黄界颍和马友华,2003;徐东辉,2007)。硫苷及其降解产物能调节十字花科植物的生长素代谢,平衡体内的硫元素,缓解硫素胁迫,保证植物正常生长发育,这些生物学功能对植物、动物和人类都具有生物学和营养学的重要意义(黄界颍和马友华,2003;郑建仙,2005)。
2 十字花科植物中硫代葡萄糖苷主要合成与调节基因
由于硫苷具有独特的生物学功能,人们对硫苷的合成途径进行了大量的研究。硫苷生物合成模式大致可分为三个阶段(图1):氨基酸侧链的延长、硫苷核心结构的形成和葡萄糖配基侧链的二次修饰(李娟和朱祝军,2005;Hirai et al.,2007)。随着模式植物拟南芥基因组的序列测定和功能解析,通过体内标记技术,人们对硫苷的生物合成途径有了较为深入的了解。研究发现,所有的硫苷都是由氨基酸合成而来,脂肪族硫苷来源于甲硫氨酸,芳香族硫苷来源于苯丙氨酸,吲哚族硫苷来源于色氨酸。油菜(Brassica napus L.)的杂交选育试验证明,植物硫苷的含量受上代基因型的影响,硫苷含量高的植株其子代含量也高,这说明硫苷的有无与含量的高低是由基因来控制的,目前在硫苷合成的三个阶段中,相关的主要合成和调节基因已得到了验证,分别是由MAM、CYP79/CYP83、AOP等合成基因家族起决定作用(郑建仙,2005;周荣汉和段金廒,2005),而转录因子MYB基因家族在硫苷的生物合成过程中则起着调节上述基因的作用(Yan & Chen,2007)。
2.1 MYB基因家族
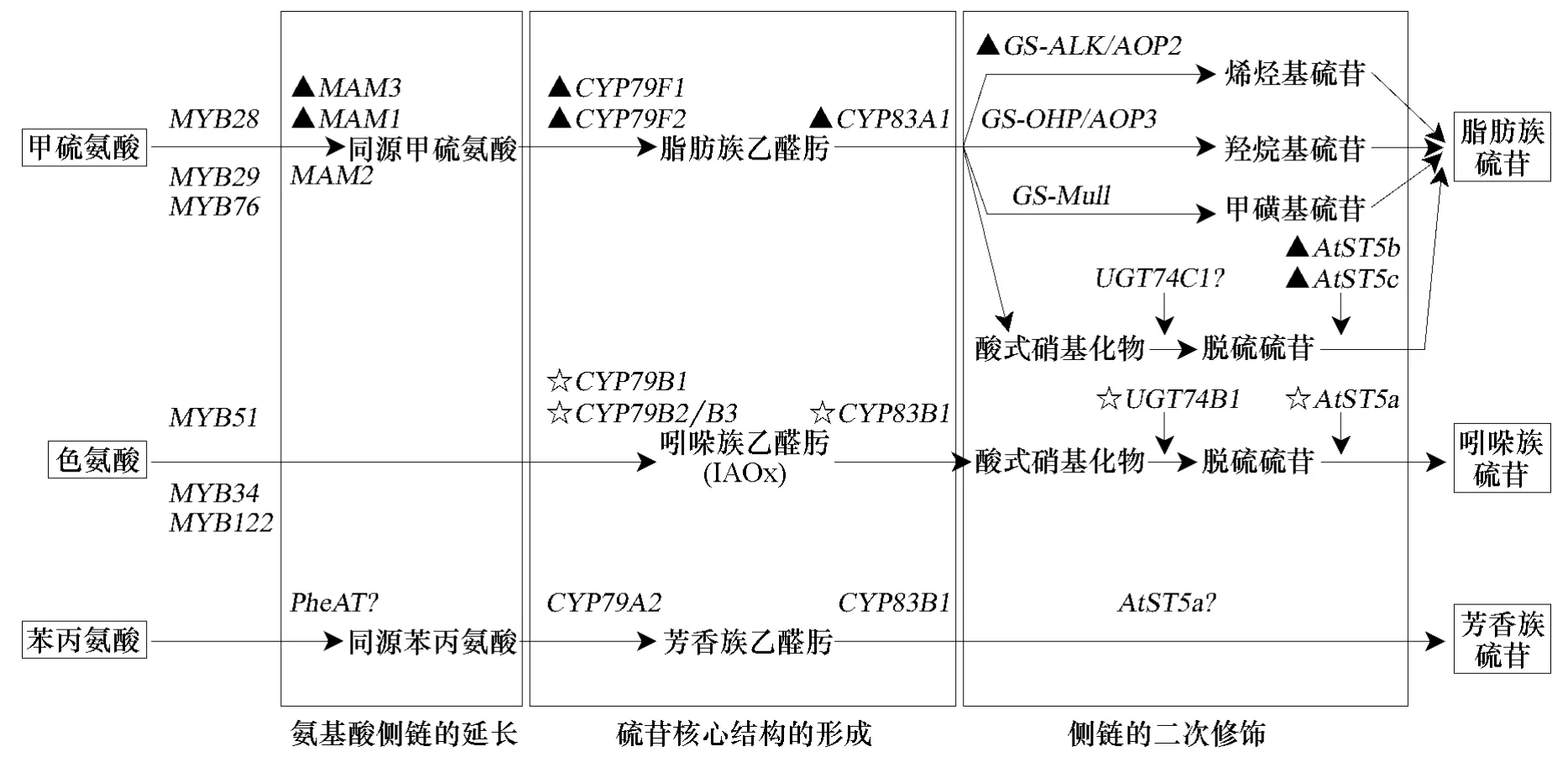
图1 硫代葡萄糖苷生物合成途径及主要合成与调节基因
MYB是一类转录因子基因,也是植物转录因子中最大的家族之一(Martin & Paz-Ares,1997),能在转录水平上通过调节与其合成相关基因的表达来调控硫苷的合成。其中,MYB28、MYB29和MYB76能够调控脂肪族硫苷的合成,MYB34、 MYB51和MYB122能够调节吲哚族硫苷的合成,它们经过激素或受伤诱导后的过量表达能够分别引起植株体内脂肪族硫苷和吲哚族硫苷的增加(Gigolashvili et al.,2007b;Hirai,2009)。MYB28基因是脂肪族硫苷合成的一个正调控因子,也是关键因子,调控从甲硫氨酸到脂肪族硫苷的通路,能够激活脂肪族硫苷合成途径的相关基因,包括 MAM1、MAM3、CYP79F1、CYP79F2、CYP83A1、AtST5b、AtST5c等,但不能影响吲哚族硫苷生物合成的基因,包括 CYP79B2、CYP79B3等。Gigolashvili等(2007b)利用拟南芥MYB28过表达和敲除该基因的植株证明了植物体内硫苷积累量的升高或降低与MYB28的转录正相关。该基因也是脂肪族硫苷合成时本底水平调节所必须的,它的表达能够被机械刺激非常迅速地诱导,可引起脂肪族硫苷水平的升高。MYB28基因能够调控 AOP2基因,但是不能调控 AOP3基因(Gigolashvili et al.,2007a;Hirai et al.,2007)。MYB29在茉莉酸甲酯介导的脂肪族硫苷生物合成过程中起附带作用。MYB51基因能够被机械刺激(如触摸或受伤)诱导后过量表达,但是 MYB34基因不具备此特性。MYB51基因的过表达能够调控吲哚族硫苷生物合成途径中的基因,如 CYP79B2、CYP79B3、CYP83B1、UTG74B1、AtST5a等,引起植物体内吲哚族硫苷的增加(Gigolashvili et al.,2007a;Gigolashvili,2009)。
2.2 MAM基因家族
甲硫烷基化苹果酸合成酶(Methylthioalkylmalate synthase)基因(MAM)家族是控制甲硫氨酸起源的脂肪族硫苷侧链延长的一类主要合成基因(Kroymann et al.,2001,2003;Textor et al.,2007)。这些年来,在芸薹属栽培种和拟南芥中都已鉴定出控制甲硫氨酸侧链延长的GS-elong位点(Magrath et al.,1994;Mithen & Campos,1996)。在拟南芥 Landsberg erecta 生态型与 Columbia生态型的重组自交系中,从 GS-elong位点的 QTL图谱鉴别出 2个基因 MAM1和 MAM2(de Quiros et al.,2000;Wittstock & Halkier,2002),其中MAM1基因是控制甲硫氨酸起源的脂肪族硫苷侧链延长的主要基因,它调控甲硫氨酸侧链延长过程中的第1和第2个缩合反应,能够编码甲硫烷基化苹果酸合成酶,催化甲硫氨酸链的 1~2个亚甲基由单同源甲硫氨酸延长为双同源甲硫氨酸,从而形成带有3~4个碳侧链的脂肪族硫苷(Kroymann et al.,2001),来自拟南芥Columbia生态型的MAM1基因有上述功能,然而来自Landsberg erecta生态型的MAM1基因却没有表现此活性,这也解释了拟南芥不同生态型间硫苷结构的差异性(Wittstock & Halkier,2002)。MAM2基因仅能催化甲硫氨酸侧链延长的第1个缩合反应,形成同源甲硫氨酸(Kroymann et al.,2003)。另外,在拟南芥两个生态型Cvi×Ler群体中,通过QTL图谱鉴定出的MAM3基因能催化甲硫氨酸侧链延伸的全部6个循环并使得甲硫氨酸生成短侧链和长侧链(Textor et al.,2007)。
2.3 CYP79/CYP83基因家族
目前,硫苷核心结构形成过程中的中间化合物已被确定,主要包括N-羟基氨基酸、乙醛肟、硫代肟基酸和脱硫硫苷,都是形成硫苷的前体。研究发现,多功能酶细胞色素 P450(CYP450)能够催化氨基酸转化为乙醛肟,这一反应是硫苷合成过程中的关键步骤(Hull et al.,2000;钟海秀 等,2007;Zang et al.,2008)。在模式植物拟南芥中已成功鉴定出细胞色素 P450的同族物CYP79,其中CYP79家族7个有功能的同族体中也已有5个在拟南芥的硫苷合成中得到确认,它们都能催化氨基酸形成乙醛肟,而乙醛肟是形成硫苷的前体。不同的同族体具有不同的底物专一性,其中 CYP79A2催化的底物是苯丙氨酸,能形成芳香族乙醛肟,CYP79B2和 CYP79B3能够催化色氨酸转变为 3-吲哚-乙醛肟(Indole-3-acetaldoxime,IAOx),CYP79F1和 CYP79F2催化甲硫氨酸衍生物侧链的延长,控制脂肪族乙醛肟合成。另外细胞色素 P450家族中的 CYP83A1和CYP83B1都与乙醛肟代谢酶有关,都能将乙醛肟转变成硫苷,但是CYP83A1仅对脂肪族乙醛肟具有高亲和性,而 CYP83B1对吲哚族乙醛肟和芳香族乙醛肟都具有高亲和性。总之,已经证实CYP家族的同族物在三类硫苷的合成中都对乙醛肟的形成有作用(Du et al.,1995;Rosa et al.,1997;Mikkelsen et al.,2002;钟海秀 等,2007)。另外,CYP同族体的鉴定也为硫苷结构的代谢提供了重要工具(Mikkelsen et al.,2002)。同时,既然硫苷是源于氨基酸的含氮和含硫的葡萄糖苷,笔者预期其生物合成途径与初生代谢途径密切相关。当氮或硫代谢受影响时,硫苷代谢也会受到影响(Hirai et al.,2007;Schonhof et al.,2007a,2007b),当 CYP79F1或 CYP79F2突变或共抑制后,甲硫氨酸底物会富集到很高的水平(Hansen et al.,2001),这说明由甲硫氨酸到硫苷的合成途径中,CYP家族的基因起到了重要作用。
2.4 AOP基因家族
硫苷侧链的二次修饰一般被认为是硫苷合成过程中的最后一步,包含了羟化、甲基化、氧化和去饱和等,这是导致硫苷种类较为丰富的原因(汪俏梅和曹家树,2001;Grubb & Abel,2006)。在硫苷的二次修饰过程中,要受到基因位点 AOP(2-Oxoglutarate-Dependent Dioxygenases)基因家族的调控,在这个位点上含有 3个等位基因,即 GS-ALK、GS-OHP和GS-Null(GS-ALK和GS-OHP为紧密连锁位点,可统称为GS-AOP),其中GS-ALK调控烯烃侧链的产生,GS-OHP控制羟烷基侧链的合成,GS-Null控制甲酰基侧链的形成(Kliebenstein,et al.,2001;Wittstock & Halkier,2002)。有人利用拟南芥 Columbia-Landsberg生态型和 Landsberg erecta-Cape Verde Island生态型的重组自交系,对紧密连接的GS-ALK和GS-OHP位点图谱鉴定出 3个候选基因 AOP1、AOP2和 AOP3,它们都编码依赖于 2-含氧戊二酸加氧酶。其中,AOP2起主要作用,能催化 3-甲基亚磺酰丙基和 4-甲基亚磺酰丁基硫苷转化为相应的烯烃基硫苷;AOP3能催化形成羟烷基硫苷;而AOP1被认为是AOP2和AOP3起源的祖先基因,其功能还有待进一步鉴定(Rosa et al.,1997;Kliebenstein,et al.,2001;Wittstock & Halkier,2002)。
此外,UGT74C1(UDP-glucosyl transferase 74C1,葡糖基转移酶)、AtST5b和 AtST5c(Desulfoglucosinolate sulfotransferase,脱硫硫苷磺基转移酶)等基因在脂肪族硫苷合成的二次修饰阶段也起了一定的调控作用,UGT74B1、AtST5a等基因调控了酸式硝基化物(aci-Nitro compound)到脱硫硫苷(Desulfoglucosinolates)以及吲哚族硫苷的生物合成。在芳香族硫苷合成途径中的PheAT(Phenylalanine aminotransferase,苯丙氨酸转氨酶)基因,推测与合成同源苯丙氨酸有关,而AtST5a基因也可能在二次修饰中起调控作用,但UGT74C1、PheAT以及AtST5a等基因的功能还有待进一步验证(Gigolashvili et al.,2007b;Hirai et al.,2007)。
3 硫代葡萄糖苷合成的调控基因在十字花科植物育种上的应用前景
近几年来,随着对硫苷一系列生物功能认识的深入,硫苷又重新成为研究的热点,比如硫苷及其降解产物能够改变昆虫的新陈代谢而导致昆虫生长缓慢甚至死亡,抵抗广食性昆虫的为害。但是硫苷又能吸引寡食性昆虫摄食或者产卵,这是因为寡食性昆虫体内有一种硫酸脂酶(Sulfatase),能够减少异硫氰酸盐的形成量,从而导致寡食性昆虫对硫苷有了一定的适应性。通过用小菜蛾对白菜进行抗虫性鉴定,发现高抗材料硫苷含量较少,感虫材料含量普遍较高。但也有研究发现,硫苷含量在较低水平时,对寡食性昆虫一般不具抗性;但当含量超过一定浓度时,对寡食性昆虫也会有抑制作用。目前在国际上有关十字花科植物硫苷合成调控基因的研究取得了很大进展,例如从拟南芥中克隆出来的MYB28基因过表达的植物,体内脂肪族硫苷的含量会升高,植物受昆虫侵害的程度会减轻,因此可以将MYB28基因转入植物体内,以此来提高植物的抗虫性。拟南芥MAM1突变体因4-甲基亚磺酰丁基硫苷含量低于野生型,非致病镰刀菌对植株的易感性增强,由此利用改变硫苷某种组分的方式可以增强植物的抗病性。另外,增加脂肪族硫苷侧链的长度,能够减少甲虫对植物的损伤,所以通过产生CYP79F1的无效突变体来改变硫苷的侧链长度,增强十字花科植物的抗虫能力。而AOP等位基因的多样性表达也能影响硫苷的抗虫性,可以通过基因工程来人为修饰硫苷的结构达到目的。一旦在基因水平上能够人为操纵硫苷的合成,那么也将有助于人类研制对抗癌症的药物。但目前存在的问题是硫苷的合成代谢要受到多个不同层次的影响,比如受少数遗传位点、不同发育进程、环境因子、基因的转录和翻译以及代谢产物等多水平的调控,并且也与其他的许多代谢通路存在相互关系,所以要比先前预期的复杂得多。虽然目前对硫苷合成代谢的研究已取得了一定进展,但仍然存在许多悬而未决的问题,还有许多调控硫苷合成的基因并不完全清楚。随着科学研究的不断深入,在未来的研究工作中可以利用遗传学、蛋白质组学、代谢组学、基因工程等手段来进一步探索研究参与硫苷合成的相关调控基因,以期在基因水平上能够人为操纵硫苷的生物合成,最终培育出抗病性好、抗虫性广和具有保健功能(如增加抗癌效应)的十字花科作物新品种。
陈亚洲,阎秀峰.2007.芥子油苷在植物-生物环境关系中的作用.生态学报,27(6):2584-2593.
黄界颍,马友华.2003.油菜硫甙特征功能及其测定方法.植物生理学通讯,39(5):496-500.
李娟,朱祝军.2005.植物中硫代葡萄糖苷生物代谢的分子机制.细胞生物学杂志,27(5):519-524.
李鲜,陈昆松,张明方.2006.十字花科植物中硫代葡萄糖苷的研究进展.园艺学报,33(3):675-679.
廖小军,胡小松,辛力.1999.食品和饲料中硫代葡萄糖苷及其降解产物.食品科学,(12):19-21.
申树芳,张英锋,马子川.2009.西兰花中硫代葡萄糖苷的抗癌药理.化学教学,(7):64-65.
汪俏梅,曹家树.2001.芥子油苷研究进展及其在蔬菜育种上的应用前景.园艺学报,28(s):669-675.
徐东辉.2007.白菜类作物硫代葡萄糖甙及一些主要代谢组分的遗传分析〔博士论文〕.北京:中国农业科学院.
钟海秀,陈亚州,阎秀峰.2007.植物芥子油苷代谢及其转移.生物技术通报,(3):44-48.
郑建仙.2005.植物活性成分开发.北京:中国轻工业出版社:1-6.
周荣汉,段金廒.2005.植物化学分类学.上海:上海科学技术出版社:78-83.
de Quiros H C,Magrath R,McCallum D,Kroymann J,Schnabelrauch D,Mitchell-Olds T,Mithen R.2000.α-Keto acid elongation and glucosinolate biosynthesis in Arabidopsis thaliana.Theoretical and Applied Genetics,101:429-437.
Du L,Lykkesfeldt J,Olsen C E.1995.Involvement of cytochrome P450in oxime production in glucosinolate biosynthesis as demonstrated by an in vitro microsomal enzyme system isolated from jasmonic acid-induced seedlings of Sinapis alba L.Proceedings of the National Academy of Sciences of the United States of America,92:12505-12509.
Fahey J W,Stephenson K K,Talalay P.1998.Glucosinolates,Myrosinase,and Isothiocyanates:three reasons for eating Brassica vegetables.ACS Symposium Series,701:16-22.
Gigolashvili T,Berger B,Mock H P,M ü ller C,Weisshaar B,F lü gge U I.2007a.The transcription factor HIG1/MYB51 regulates indolic glucosinolate biosynthesis in Arabidopsis thaliana.The Plant Journal,50:886-901.
Gigolashvili T,Yatusevich R,Berger B,M ü ller C,Flugge U I.2007b.The R2R3-MYB transcription factor HAG1/MYB28 is a regulator of methionine-derived glucosinolate biosynthesis in Arabidopsis thaliana.The Plant Journal,51:247-261.
Gigolashvili T,Berger B,F lü gge U I.2009.Specific and coordinated control of indolic and aliphatic glucosinolate biosynthesis by R2R3-MYB transcription factors in Arabidopsis thaliana.Phytochemistry Reviews,1(8):3-13.
Grubb C D,Abel S.2006.Glucosinolate metabolism and its control.Trends in Plant Science,11(2):89-100.
Halkier B A,Gershenzon J.2006.Biology and biochemistry of glucosinolates.Annual Review of Plant Biology,57:303-333.
Hansen C H,Wittstock U,Olsen C E,Hick A J,Pickett J A,Halkier B A.2001.Cytochrome P450CYP79F1 from Arabidopsis catalyzes the conversion of dihomomethionine and trihomomethionine to the corresponding aldoximes in the biosynthesis of aliphatic glucosinolates.The Journal of Biological Chemistry,276:11078-11085.
Hirai M Y,Sugiyama K,Sawada Y,Tohge T,Obayashi T,Suzuki A, Araki R, Sakurai N, Suzuki H, Aokik, Goda H, Nishizawa O I, Shibata D,Saito K.2007.Omics-based identification of Arabidopsis Myb transcription factors regulating aliphatic glucosinolate biosynthesis.Proceedings of the National Academy of Sciences of the United States of America,104:6478-6483.
Hirai M Y.2009.A robust omics-based approach for the identification of glucosinolate biosynthetic genes.Phytochemistry Reviews,8(1):15-23.
Hull A K,Vij R,Celenza J L.2000.Arabidopsis cytochrome P450s that catalyze the first step of tryptophan-dependent indole-3-acetic acid biosynthesis.Proceedings of the National Academy of Sciences of the United States of America,97(5):2379-2384.
Kliebenstein D J,Lambrix V M,Reichelt M,Gershnzon J,Mitchell-Olds T.2001.Gene duplication and the diversification of secondary metabolism:side chain modification of glucosinolates in Arabidopsis thaliana.The Plant Cell,13:681-693.
Kroymann J,Textor S,Tokuhisa J G,Falk K L,Bartram S,Gershenzon J,Mitchell-Olds T.2001.A gene controlling variation in Arabidopsis glucosinolate composition is part of the methionine chain elongation pathway.Plant Physiology,127:1077-1088.
Kroymann J,Donnerhacke S,Schnabelrauch D,Mitchell-Olds T.2003.Evolutionary dynamics of an Arabidopsis insect resistance quantitative trait locus.Proceedings of the National Academy of Sciences of the United States of America,100:14587-14592.
Ludwig-M ü ller J,Ruppel M,Cohen J D,Epstein E,Kiddle G,Bennett R,Pieper K.1999.Indole glucosinolate and auxin biosynthesis in Arabidopsis thaliana(L.)Heynh.glucosinolate mutants and the development of clubroot disease.Planta,208(3):409-419.
Magrath R,Bano F,Morgner M,Parkin I,Sharpe A,Lister C,Dean C,Turner J,Lydiate D,Mithen R.1994.Genetics of aliphatic glucosinolates.I.Side chain elongation in Brassica napus and Arabidopsis thaliana.Heredity,72:290-299.
Martin C,Paz-Ares J.1997.MYB transcription factors in plants.Trends in Genetics,13(2):67-73.
Mithen R.2001.Glucosinolates-biochemistry,genetics and biological activity.Plant Growth Regulation,34:91-103.
Mithen R,Campos H.1996.Genetic variation of aliphatic glucosinolates in Arabidopsis thaliana and prospects for map based gene cloning.Entomologia Experimentalis et Applicata,80:202-205.
Mikkelsen M D,Petersen B L,Olsen C E,Halkier B A.2002.Biosynthesis and metabolic engineering of glucosinolates.Amino Acids,22(3):279-295.
Pracros P,Moreau R,Gourdoux L.1992.Metabolic alterations induced by ingested glucosinolates in yellow mealworm larvae(Tenebrio molitor L.).Animal Biology,1:77-83.
Rosa E A S,Heaney R K,Fenwick G R,Portas C A M.1997.Glucosinolate in crops plants.Horticulture Reviews,19:99-215.
Schonhof I,Klaring H P,Krumbein A,Schreiner M.2007a.Interaction between atmospheric CO2and glucosinolates in broccoli.Journal of Chemical Ecology,33:105-114.
Schonhof I,Blankenburg D,Muller S,Krumbein A.2007b.Sulfur and nitrogen supply in Xuence growth,product appearance,and glucosinolate concentration of broccoli.Journal of Plant Nutrition and Soil Science,170:65-72.
Textor S,de Kraker J W,Hause B,Gershenzon J,Tokuhisa J G.2007.MAM3 catalyzes the formation of all aliphatic glucosinolate chain lengths in Arabidopsis.Plant Physiology,144:60-71.
Wittstock U,Halkier B A.2002.Glucosinolate research in the Arabidopsis era.Trends in Plant Science,7:263-270.
Yan X,Chen S.2007.Regulation of plant glucosinolate metabolism.Planta,226:1343-1352.
Zang Y X,Kim J H,Park Y D,Kim D H,Hong S B.2008.Metabolic engineering of aliphatic glucosinolates in Chinese cabbage plants expressing Arabidopsis MAM1,CYP79F1,and CYP83A1.BMB Reports,41(6):472-478.
