经皮穴位电刺激对跑台运动大鼠血浆氨基酸及中缝背核细胞外液5-HT含量的影响
2010-05-12方剑乔梁宜汪存信邵晓梅马桂芝李海燕
方剑乔 梁宜 汪存信 邵晓梅 马桂芝 李海燕
浙江中医药大学第三临床医学院(杭州 310053)
经皮穴位电刺激(transcutanous electrical acupoint timulation,TEAS)是一种新型的针灸疗法,集诸多优势于一体[1]。以往多项研究表明TEAS具有良好的抗运动性疲劳效应[1-3],然而关于其抗运动性疲劳的机理研究目前主要集中于外周机制研究,对深层次的中枢机制研究不多。
5-羟色胺(serotonin,5-HT)是导致运动性中枢疲劳的关键递质。色氨酸(tryptophan,TRP)是脑内5-HT合成的前体物质,但只有游离色氨酸(free tryptophan,f-TRP)才能与血浆支链氨基酸(branched-chain amino acids,BCAA)竞争载体穿越血脑屏障,脑内5-HT含量取决于血浆f-TRP/BCAA比值高低[4]。中缝背核(dorsal raphe nucleus,DRN)是中缝核群主要成员之一,是中枢神经系统5-羟色胺能神经元胞体最多的核团之一。Hong[5]和Min[6]等研究发现跑台运动使疲劳大鼠DRN内 5-HT阳性细胞数显著增加。事实上,阳性细胞和脑匀浆仅反映细胞内5-HT含量变化,而不能正确反映细胞外(突触间隙)5-HT含量变化。故本实验观察了运动大鼠血浆f-TRP水平、TRP游离度和f-TRP/BCAA比值的变化;并结合在体微透析采样技术,观察运动大鼠DRN细胞外液5-HT水平动态变化以及TEAS对其的干预。
1 材料与方法
1.1 实验对象
清洁级SD(Sprangue-Dawley)大鼠20只,雄性,体重300±10g,由浙江中医药大学实验动物中心提供,饲养期间给予啮齿类动物标准颗粒饲料及自由饮水。
1.2 实验仪器与试剂
微透析采样系统(日本Eicom公司),高效液相色谱仪(美国Agilent公司),电化学检测器(美国ESA公司),PURELAB UHQ超纯水机(美国ELGA公司),LH202H韩氏穴位神经刺激仪(北京华卫产业开发公司),SLY-RTML六通道动物跑台(北京硕林苑科技有限公司),大鼠脑立体定位仪(上海奥尔科特生物科技有限公司)。微透析探针(膜长 2mm;OD:0.5mm;Cutoff:18KD)由浙江大学生物医学工程与仪器科学学院张恒义教授提供。
L-色氨酸(L-TRP)、L-缬氨酸(L-VAL)、L-异亮氨酸(L-ILE)、L-亮氨酸(L-LEU)、2,4-二硝基氯苯(CDNB)、5-羟色胺硫酸肌酐盐(5-HT)、1-辛烷磺酸钠、三乙胺TEA)、四乙酸乙二胺(EDTA)均购自Sigma公司;NaH2PO4·H2O购自MERCK公司。
1.3 立体定位手术与微透析
将大鼠适应性喂养3天后,参照大鼠脑定位图谱[7],行DRN立体定位手术:大鼠未禁食,用2%戊巴比妥钠溶液(60mg/kg)经腹腔注射麻醉;调节大鼠脑立体定位仪门齿钩刻度低于水平面3.3mm;通过两侧耳棒和门齿钩固定大鼠头部,剪开头皮剥离骨膜,充分暴露颅骨前囟以及人字缝。DRN外导管定位坐标:AP:-7.8mm(from Bregma)、ML:+3.0mm(from midline)、DV:+5.8mm(from dura,30°),并用螺丝钉和牙科水泥固定。术后大鼠分笼单独饲养,修复7天。其中2只大鼠苏醒后出现颅内大出血死亡。
术后第7天,将微透析探针植入脑内,用过滤脱气的1×Ringer’s 液(147mM NaCl、4mM KCl、2.3mM CaCl2、1.0mM MgCl2)以 1μl/min的流速进行灌流,平衡2h后,开始收集基础透析液3管,每管间隔30min,每个采集管中均加入5μl 0.1M醋酸以防止神经递质的降解。微透析液置-80℃保存。微透析探针体外回收率低于8%的探针,则弃用。
1.4 造模、分组与治疗
实验大鼠随机分为运动组和TEAS组,所有大鼠于术后第2d后,进行连续3d适应性跑台运动:以10m/min的速度运动15min,1次/d。TEAS组大鼠术后第2d开始接受TEAS治疗:取穴为右侧足三里,与同侧小腿下1/3处前外侧缘非穴位,治疗参数为2Hz、5mA、30min,1次/d,共6次(最后1次治疗在跑台运动后即刻,与微透析采样同步进行)。运动组则给予与TEAS组大鼠相同的固定、跑台运动及微透析采样处理。
于术后第7d进行微透析采样和急性跑台运动。采集完基础透析液后,将大鼠与自由活动装置分离(探针仍保留)后,实验大鼠进行急性跑台运动:先以10m/min的速度运动10min,在随后4min内将跑速调至24m/min并持续运动1h,坡度为0,其间给予毛刷刺激以确保大鼠持续运动。运动结束将大鼠重新与自由活动装置连接,并采集微透析液直至运动后5h。其中1只大鼠在跑台运动中探针被撞弯,无法行微透析采样,故予以剔除。
1.5 核团定位准确性检验
DRN微透析结束(即运动后5h)时,大鼠用戊巴比妥钠过量麻醉后经升主动脉弓灌注前固定后,取全脑置4%多聚甲醛溶液固定24h,梯度脱水后行冰冻切片(30μm),用 Nissle(焦油紫)染色,观察微透析探针 DRN定位准确性。其中剔除DRN定位不准者5只。
1.6 指标测定
1.6.1 记录毛刷刺激频次
为了维持实验大鼠完成1h跑台运动,运动中在大鼠尾部给予毛刷刺激;记录每分钟实施的毛刷刺激次,用以观察实验大鼠的运动主动性及其体能状态。
1.6.2 血浆f-TRP、T-TRP含量测定
血浆提取:DRN微透析结束(即运动后5h)时,大鼠用过量2%戊巴比妥钠腹腔麻醉,经腹主静脉采血3ml,1%肝素钠(50μl)抗凝,3000r/min离心 15min后取上清。
样品前处理:取500μl血浆2份,分别加入 0.36g硫酸铵和等体积5%HClO4溶液,涡旋混匀0.5~1min,室温静置10min,10000r/m低温离心15min。分取上清液,前者为f-TRP,后者为 T-TRP,经 0.22μm滤膜过滤,置-80℃保存以待检测。
血浆TRP含量检测采用HPLC-UV法[8],色谱条件:色谱柱:ZORBAX Eclipse XDB-C18(Agilent公司)ODSC18柱(4.6mm×150mm,5μm 颗粒);流动相:乙腈-水溶液(8:92,V/V),用冰醋酸调pH为3.4;流速:1ml/min;柱温:25℃;检测波长:215nm;进样量:20μl。
1.6.3 血浆BCAA含量测定
于运动后5h,取血浆检测。血浆采用赵剑虹[9]报道的方法进行柱前衍生处理,经0.22μm滤膜过滤后进样;血浆 BCAA含量检测采用 HPLC-UV法,参考赵氏[11]方法进行改进。色谱柱:同上;流动相:乙酸-乙酸钠缓冲液(pH5.2)-乙腈,梯度洗脱:0min(80:20)—20min(70:30)—25min(40:60);流速:1ml/min;柱温:35℃;检测波长:360nm;进样量:20μl。
1.6.4 DRN细胞外液5-HT含量测定
于运动前、运动后即刻及运动后 1h、2h、3h、4h、5h时,检测DRN细胞外液中5-HT含量。采用HPLC-ECD法[10],色谱柱:MD-150(ESA 公司)ODS-C18柱(3.2mm×150mm,3μm 颗 粒); 流 动 相 :75mM NaH2PO4·H2O、1.7mM 1-辛 烷 磺 酸 钠 、100μl/LTEA、25μM EDTA、10%乙腈;流速:0.6ml/min;柱温:32℃;电化学检测器参数:E1:-150mV;E2:+220mV;EGC:+270mV;钯为参比电极;Full Scale/Range:10nA;进样量:20μl。
1.7 统计学分析
2 结果
2.1 运动中毛刷刺激频次
如表1所示,运动组大鼠在1h持续跑台运动中毛刷刺激频次显著多于TEAS组(P<0.05)。
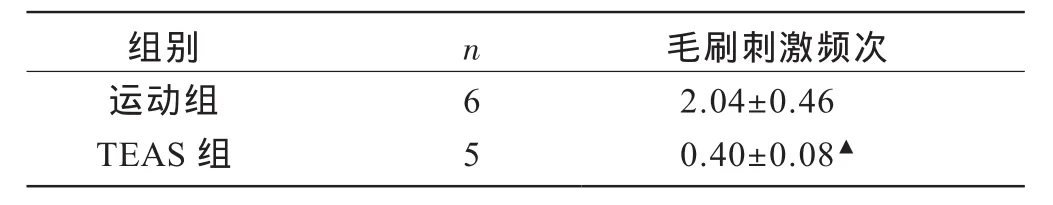
表1 两组大鼠运动中毛刷刺激频次比较(次/min)
2.2 血浆f-TRP、T-TRP含量及f-TRP/T-TRP比值
表2显示,TEAS组血浆T-TRP含量与运动组无明显差异(P>0.05),但TEAS组血浆f-TRP含量和f-TRP/T-TRP比值显著低于运动组(均P<0.01)。

表2 两组大鼠血浆f-TRP、T-TRP含量及f-TRP/T-TRP比值比较
2.3 血浆BCAA含量及f-TRP/BCAA比值
由表3可见,两组大鼠血浆BCAA及其组成氨基酸L-VAL、L-ILE、L-LEU 含量比较均无显著差异(P>0.05),而TEAS组血浆f-TRP/BCAA比值显著低于运动组(P<0.05)。
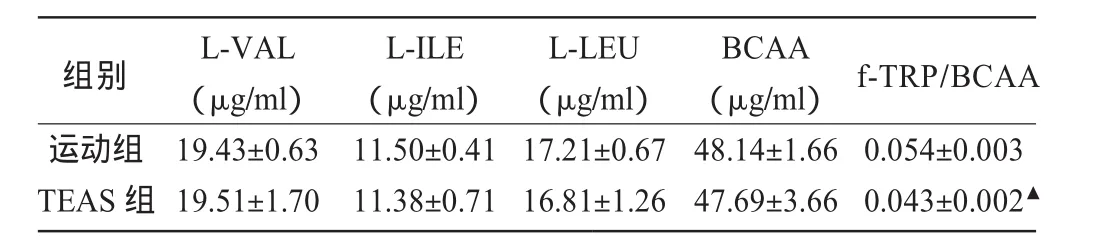
表3 两组大鼠血浆BCAA含量及f-TRP/BCAA比值比较
2.4 DRN细胞外液5-HT水平
运动前,运动组和TEAS组大鼠DRN细胞外液中的基础5-HT水平分别为 36.97±6.49、53.19±12.49(pg/20μl),两组间比较无差异(P>0.05)。1h运动中,DRN 细胞外液中5-HT含量的动态变化如图1所示,运动组大鼠DRN细胞外液5-HT水平运动后即刻显著升高(P<0.05),随后呈下降趋势,运动后1h时显著降低(P<0.05);持续降低2h后,运动后3、4h时又有回升,显著高于运动后2h时(P<0.05)。TEAS组运动后DRN细胞外液中5-HT水平与基础值相当,但均低于同期运动组,在运动后4h开始有较明显下降,运动后5h时明显低于运动组,有统计学意义(P<0.05)。
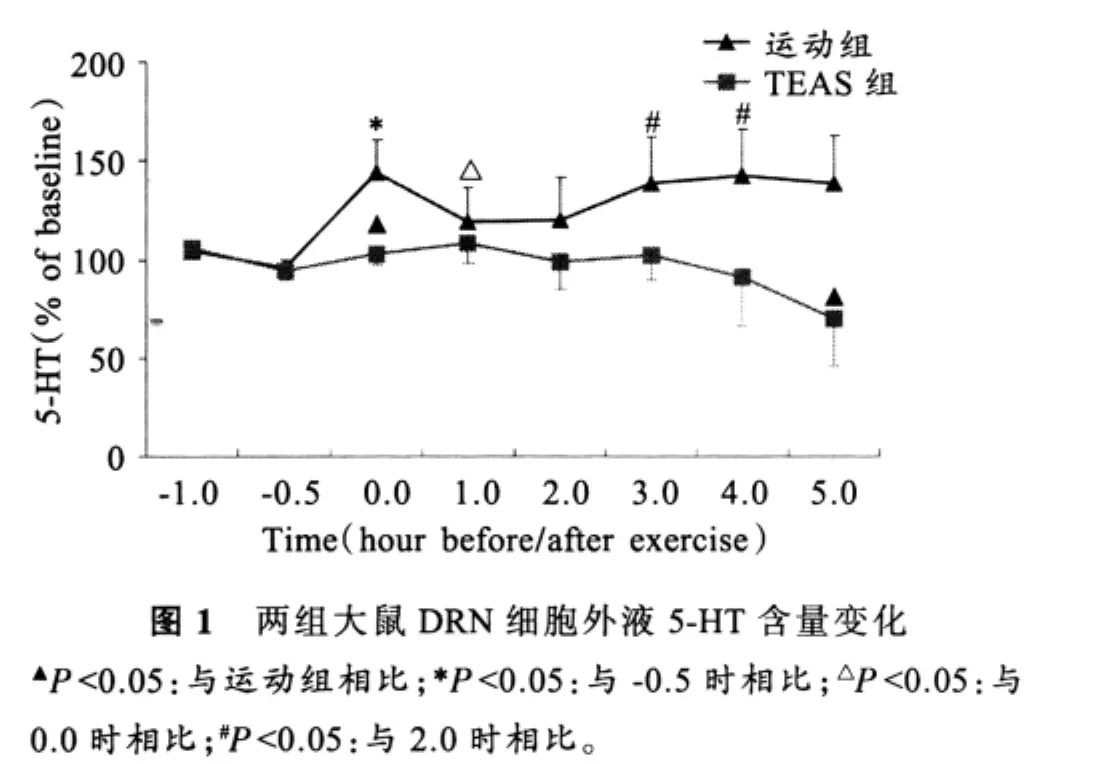
3 讨论
运动性疲劳属于中医“虚劳”、“劳倦”、“劳伤”等范畴,虽在中医经典理论未有明确的论述,但对于与现代疲劳论述相关的由形体过用产生的“劳、伤、虚、损”的相关记载却颇为详尽。“疲劳”一词始见于《金匮要略》,书中明确地把疲劳引起的证候与“虚劳病”作为同类进行论述;关于运动性疲劳的病因,《素问》载有“生病起于过用”一说,《素问·宣明五气篇》则明确指出“久视伤血,久卧伤气,久坐伤肉,久立伤骨,久行伤筋”。经皮穴位电刺激(TEAS)是一种将经皮神经电刺激和穴位特异性相结合的新型针灸疗法,具有无创性、刺激定量化、不受体位限制、应用范围广等优点。足三里穴属多气多血之经足阳明胃经之合穴,又为胃之下合穴,一贯被历代医家视为补虚培元、强壮保健要穴。本实验中,我们观察到TEAS足三里穴后可显著减少大鼠运动中使用毛刷刺激频次,表明TEAS足三里穴能明显改善实验大鼠体能状态,提高其运动主动性。
运动性疲劳的发生机制主要包括存在于大脑的中枢机制和肌肉的外周机制两个方面。越来越多的证据表明运动性疲劳与中枢神经系统有着更密切的关系,因而认为运动造成中枢疲劳[11]。Newsholme首次提出中枢性疲劳假说,认为长时间运动增加脑内5-羟色胺能活性导致运动性疲劳从而影响运动能力的恢复。多项实验研究亦表明持续运动可引起多个脑区 5-HT含量的升高[12,13]。5-HT激动剂和拮抗剂的应用,更进一步证实5-HT与运动性疲劳之间的因果关系[14,15]。TRP是5-HT合成的前体物质,外周仅f-TRP与BCAA竞争载体穿透血脑屏障,运动可促使外周血中f-TRP/BCAA比值升高,进而脑内TRP含量增加,最终中枢神经细胞合成的5-HT亦相应增多,中枢疲劳继之而来[16]。因此,血浆f-TRP而不是T-TRP被认为是运动中决定脑TRP摄入率的重要因素。
实验中,我们观察到TEAS组大鼠血浆T-TRP水平与运动组比较无显著差异,但血浆f-TRP含量则显著降低;进一步计算血浆f-TRP/T-TRP比值以观察血浆TRP的游离程度,发现经过TEAS治疗,跑台运动大鼠血浆TRP游离率显著降低。此外,两组血浆BCAA水平无显著变化,这可能与采血时间在运动后5h时,在运动中消耗的BCAA可能在休息后得到恢复有关。血浆f-TRP/BCAA比值结果显示,TEAS组显著低于运动组,表明TEAS可有效抑制血浆f-TRP穿越血脑屏障进入脑内。王芳等[17]也观察到运动后血浆f-TRP/BCAA比值显著升高,与本实验结果相符。以上实验结果提示TEAS足三里穴后可明显降低血浆TRP游离率,减少f-TRP穿透血脑屏障,进而间接地抑制脑内5-HT的生成。
本实验采用微透析检测DRN中5-HT含量动态变化发现,运动大鼠DRN细胞外液5-HT水平分别在运动后即刻和运动后3h时呈上升趋势。Gomez-Merino等[18,19]也观察到跑台运动大鼠海马细胞外液5-HT水平从运动后即刻的 123.7±6.4%增至休息 1h时的 133.9±6.4%;皮层和海马细胞外液5-HT水平在运动90min后显著升高,并在休息30min后达到最高,提示大鼠运动后脑内5-HT水平可能存在持续性升高。本实验中,TEAS组大鼠各时段DRN内5-HT水平均低于运动组,并呈逐渐下降趋势,提示TEAS足三里穴可下调DRN细胞外液5-HT水平,并有可能参与运动性疲劳的恢复。Lee等[20]采用免疫组化技术,发现电针足三里穴可有效抑制跑台运动大鼠DRN内5-HT合成增加,由此推断针灸足三里穴不但干预DRN内神经元胞内5-HT合成,还可影响释放至胞外5-HT水平的高低。综上所述,TEAS足三里通过降低血浆-TRP含量、减少其向中枢的转运,从而间接地降低了脑内5-HT合成,延缓运动性疲劳的发生,进而促使运动能力提高。
4 总结
TEAS足三里穴能明显改善实验大鼠运动的主动性和体能状态,其提高运动能力的效应可能是通过降低血浆TRP游离度和f-TRP转运入脑,进而减少脑内5-HT合成实现的。
[1]梁宜,方剑乔,汪存信,等.经皮穴位电刺激对力竭运动大鼠血浆超氧化物歧化酶和丙二醛的影响.针刺研究,2008,33(2):120-123.
[2]吴立红,方剑乔,邵晓梅.经皮穴位电刺激足三里对抗大鼠运动性疲劳.中国临床康复,2005,9(40):114-117.
[3]梁宜,方剑乔,邵晓梅,等.经皮穴位电刺激足三里穴对跑台运动大鼠自由基代谢的影响.中国中医药科技,2008,15(4):251-252.
[4]梁宜,方剑乔.5-羟色胺系统与运动中枢疲劳.中国康复医学杂志,2008,23(2):176-178.
[5]Hong JA,Chung SH,Lee JS,et al.Effects of Paeonia radix on 5-hydroxytryptamine synthesis and tryptophan hydroxylase expression in the dorsal raphe of exercised rats.Biol Pharm Bull,2003,26(2):166-169.
[6]Min YK,Chung SH,Lee JS,et al.Red ginseng inhibits exercise-induced increase in 5-hydroxytryptamine synthesis and tryptophan hydroxylase expression in dorsal raphe of rats.J Pharmacol Sci,2003,93:218-221.
[7]Paxinos G,Waston C.The rat brain in stereotaxic coordinates.4th ed.California:Academic Press,1998.51.
[8]文江平,唐爱国.高效液相色谱法快速测定血清中的芳香族氨基酸.色谱,2003,21(2):154-157.
[9]赵剑虹,杨柳桦,李永新,等.柱前衍生-高效液相色谱法测定大熊猫血清中18种游离氨基酸.分析试验室,2007,26(11):15-19.
[10]Singer S,Rossi S,Verzosa S,et al.Nicotine-induced changes in neurotransmitter level in brain areas associated with cognitive function.Neurochem Res,2004,29(9):1779-1792.
[11]张婧,熊正英.运动中枢疲劳的生物学机制.体育学刊,2003,10(5):42-44.
[12]Caperuto EC,dos Santos RV,Mello MT,et al.Effect of endurance training on hypothalamic serotonin concentration and performance.Clin Exp Pharmacol Physiol,2009,36(2):189-91.
[13]Gomez-Merino D,Béquet F,Berthelot M,et al.Site-dependent effects of an acute intensive exercise on extracellular 5-HT and 5-HIAA levels in rat brain.Neurosci Lett,2001,301(2):143-146.
[14]Bailey SP,Davis JM,Ahlborn EN.Serotonergic agonists and antagonists affect endurance performance in the rat.Int J Sports Med,1993,14(6):330-333.
[15]Dwyer D,Browning J.Endurance training in Wistar rats decreases receptor sensitivity to a serotonin agonist.Acta Physiol Scand,2000,170(3):211-216.
[16]Davis JM,Alderson NL,Welsh RS.Serotonin and central nervous system fatigue:nutitional considerations.Am J Clin Nutr,2000,72(suppl):573S-578S.
[17]王芳,史丽萍,马佐英,等.养肝柔筋方对运动性中枢疲劳大鼠血、脑游离色氨酸和脑5-羟色胺含量的影响.天津中医药大学学报,2006,25(4):222-224.
[18]Gomez-Merino D,Béquet F,Berthelot M,et al.Site-dependent effects of an acute intensive exercise on extracellular 5-HT and 5-HIAA levels in rat brain.Neurosci Lett,2001,301(2):143-146.
[19]Gomez-Merino D,Béquet F,Berthelot M,et al.Evidence that the branched-chain amino acid L-valine prevents exercise-induced release of 5-HT in rat hippocampus.Int J Sports Med,2001,22(5):317-22.
[20]Lee SH,Chung SH,Lee JS,et al.Effects of acupuncture on the 5-hydroxytryptamine synthesis and tryptophan hydroxylase expression in the dorsal raphe of exercised rats.Neurosci Lett,2002,332(1):17-20.
