一次大强度运动后大鼠骨骼肌收缩蛋白降解和26S蛋白酶体活性的变化
2010-05-12朱荣马延超许寿生王瑞元
朱荣 马延超 许寿生 王瑞元
1温州医学院(浙江 温州 325035) 2洛阳师范学院 3北京体育大学
我们实验室的前期研究证实:大负荷运动后骨骼肌收缩蛋白(actin、myosin)、细胞内骨架蛋白(desmin、titin、nebulin)、膜骨架蛋白(dystrophin、integrin)含量减少,超微结构改变(表现为Z线扭曲、模糊、肌丝排列紊乱等),肌力减弱,发现这与蛋白质的溶酶体、calpain降解途径活性增强有关[1-3],而细胞内蛋白质降解主要途径——泛素蛋白酶体途径的变化如何呢?国内外研究不多。本实验通过观察大鼠一次大强度运动后腓肠肌3-MH含量、26S蛋白酶体活性及其亚基C2 mRNA表达的变化,初步探讨泛素蛋白酶体途径在运动骨骼肌蛋白质降解的作用。
1 材料与方法
1.1 动作与分组
雄性 SPF级 Sprague-Dawley大鼠 36只,8周龄,体重190g~220g,购于北京维通利华实验动物技术有限公司,随机分为6组:安静对照组、运动0.5小时组、运动1小时组、运动1小时后1小时组、运动1小时后2小时组、运动1小时后6小时组,每组6只。
动物实验经北京体育大学实验动物福利伦理审查委员会同意,并严格按照北京体育大学动物实验室规定执行。屏障环境饲养,温度23±2℃,相对湿度65±5%,昼夜交替时间为12/12小时。每笼4只,自由饮食与饮水。
1.2 运动形式
大鼠购进后安静饲养3天,以适应新环境,然后跑台运动适应 3天(第 1天 10m/min×10min,第 2天 10m/min×15min,第 3 天 15m/min×15min),休息 1 天,分别进行0.5小时、1小时大强度运动(25m/min,5%坡度,相当于75%VO2max)[4,5]。
1.3 取材
各组大鼠按规定时间点称重,用2%戊巴比妥钠0.25ml/100g)腹腔注射麻醉[6],腹主动脉取血后,迅速分离大鼠右后肢肌肉,取等量的红、白腓肠肌,用锡纸包好,投入液氮中保存。取材完毕后将标本转移至-80℃冰箱保存,备用。
1.4 指标测试
1.4.1 骨骼肌 3-MH 含量检测[7,8]
腓肠肌的处理:称取约50mg肌组织,加入含500μl高氯酸(3.0%)的离心管内,高速匀浆,然后4℃下14000g离心25min,提取上清液,用于高效液相技术检测3-MH含量。
柱前衍生:取50μl上清液至离心管内,加入0.2mM硼酸钠125μl,旋涡振荡,缓慢加入乙睛(含荧光胺1.6g/L)125μl,混匀,静置 5min,加入 70%高氯酸 18μl,盖紧离心管,80℃水浴1小时。冷却至室温,加入3M NaOH含 0.5M MOPS)50μl,使标本液 pH在 6.0左右,即上机分离、检测。
色谱条件:流动相采用10mM磷酸钠缓冲液(含30%乙腈,pH7.5),等度洗脱,流速1.0ml/min,进样量25μl,经 Zorbarx SB-C18 柱(4.6×150mm,5μm,柱温为常温)分离,荧光分光光度计检测,激发365nm,发射460nm。
色谱分离:3-MH的出峰时间约为5.9分钟。
标准曲线:配制3-MH标准液(Sigma公司)的浓度分别为 2.5、5.0、7.5、10.0、15.0、20.0μmol/ml,按样品处理方法进行测定。利用3-MH标准品的不同浓度(C,μmol/ml)与各自对应的面积(S)建立回归方程。
1.4.2 26S蛋白酶体活性测试
参考 Ventrucci G[9]和 Combaret L[10]的方法,并做改动。
胞浆蛋白提取:取腓肠肌约100mg,加入0.5ml匀浆缓冲液[50mM Tris-HCl(pH7.5)、10mM ATP、10mM Mg-Cl2、1mM DTT、20μM PMSF、250mM sucrose、10%glycrol、proteases inhibitors cocktail(1pellet/50ml)],高 速 匀浆,然后4℃下15000g离心15分钟,取上清,检测组织蛋白浓度和酶活性。
分析缓冲液配制:50mM Tris(pH7.5),5mM MgCl2,1mM DTT。
26S蛋白酶体活性检测:在黑色专用96孔荧光检测板加入各种试剂(见表1)。用POLARstar Galaxy Microplate Reader(BMG公司)仪器进行检测:激发波长380 nm,发射波长460nm,温度设为37℃,每 5分钟读一次,连续检测1小时,所测读数以每个样品蛋白含量纠正。

表1 26S蛋白酶体活性检测反应体系
1.4.3 26S蛋白酶体C2亚基mRNA表达
用Trizol(invitrogen公司)提取骨骼肌总 RNA,其中加入RNase inhibitor抑制RNA降解,DNaseⅠ消除基因组 DNA,以保证 RNA纯度。取 1μl总 RNA,经 ND-100 Spectrophotometer(Nano Drop公司)紫外分光光度计测定RNA纯度和浓度。
采用TOYOBO公司的试剂盒进行反转录。反应体系为 5×RT buffer 4μl,dNTP (10mM)2μl,Oligo(dT)1μl,Reverse Tra Ace 1μl,RNase inhibitor 1μl,1μg 总RNA,加 DEPC-treated water至 20μl。反应程序为 42℃ 30min,85℃ 5min,4℃ 5min,-20℃保存待用。
由北京赛百盛基因技术有限公司合成引物,上游引物 5’-AAA GCA AGG CTC AGC GAC AG-3’,下游引物 5’-GGC GAG ATA CGG GAA GTG GT-3’(GenBank M29859),长度 236bp。
采用TOYOBO公司提供的SYBR Green Realtime PCR MasterMix试剂盒在TQTM5实时荧光定量仪(Bio-Rad公司)进行实时荧光定量PCR反应。反应体系为 cDNA 0.5μl、上下游引物各为 0.5μl、ddH2O 8.5μl、SYBR Green Mix 10μl,总体积为 20μl。反应程序为94℃ 240s,(94℃ 20s,62℃ 20s,72℃ 10s) 重复 45 次。以3-磷酸甘油醛脱氢酶(GAPDH)为内参,每份样品重复三次,采用相对 CT值定量分析(2-△△CT)。公式如下:△△CT=△CT处理样品-△CT未处理样品,其中,△CT=CT测试指标-CT内参。
1.5 统计学分析
数据用统计学软件SPSS 13.0分析处理,进行单因素方差(One-Way ANOVA)分析,结果用平均值±标准差表示,方差齐时用LSD方法,方差不齐时用Tamhane’s方法,P<0.05为显著性差异,P<0.01为非常显著性差异。
2 结果
测试结果(表2)显示:(1)运动后即刻腓肠肌3-MH含量增加(P<0.01),其中运动0.5小时值最高,为安静水平的3倍(P<0.01),运动后逐渐恢复至安静水平,但运动后6小时又升高,达到安静时的2.3倍(P<0.01)。(2)运动0.5小时即刻,26S蛋白酶体活性升高,是安静时的1.3倍(P<0.05),运动1小时即刻和恢复期活性下降至约安静水平,运动后6小时活性又升高至安静时的1.3倍(P<0.05)。(3)26S蛋白酶体的C2亚基mRNA在运动即刻以及运动后1、2小时表达都低于安静时,并在运动1小时即刻具有显著性(P<0.05),运动后6小时表达突然升高到安静时的2.3倍(P<0.01)。
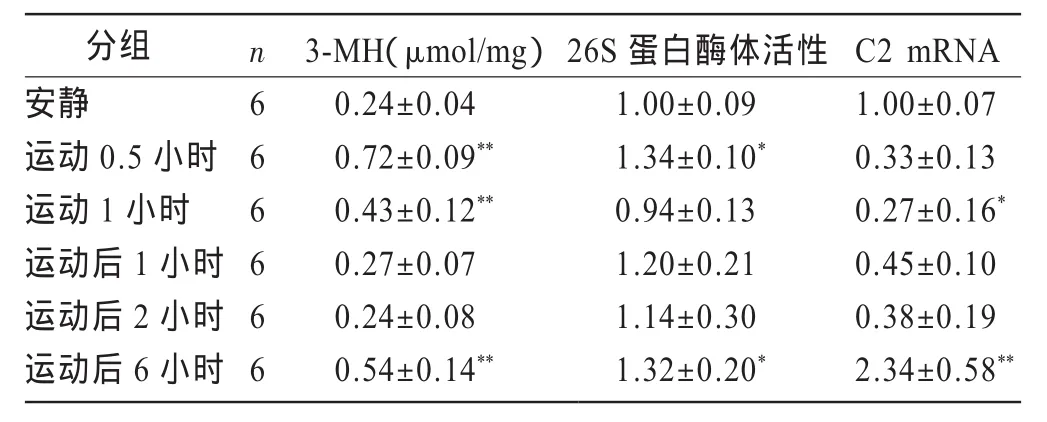
表2 大强度运动前后大鼠腓肠肌3-MH含量、26S蛋白酶体活性及C2亚基mRNA表达变化
3 讨论
3-甲基组氨酸(3-MH)存在于骨骼肌、心肌的肌动蛋白(actin)和肌凝蛋白(myosin)中[11],是组氨酸形成组氨酰tRNA后发生甲基化的产物。3-MH一旦从多肽上降解下来便不能作为tRNA的底物合成新肽链,也不会再被分解[12]。检测3-MH含量可以间接反映肌纤维收缩蛋白的降解。大部分人体和动物实验采用尿3-MH含量进行评价,但尿3-MH含量部分还来源于机体其它器官,而测量肌肉3-MH含量可以真实反映骨骼肌收缩蛋白降解的变化。本研究检测了运动后骨骼肌3-MH含量变化,这样的研究还未见报道。我们采用的25m/min跑台速度、5%坡度运动对于大鼠来说相当于75%VO2max的运动强度,运动 1小时后,接近疲劳,与 Hollander等[5]的动物实验一致。本实验结果显示,运动后即刻腓肠肌3-MH含量较安静时显著升高,其中运动0.5小时后即刻3-MH含量比运动1小时多,运动后6小时又非常显著高于安静水平,提示运动中肌肉收缩蛋白降解增加,随着运动时间延长,降解增加的程度减少,在运动后短时间内降至安静水平,但运动后6小时收缩蛋白降解又增加,这可能与肌纤维结构改变、运动能力降低有联系,但很遗憾我们没有观察超微结构变化。
有研究表明,肌肉蛋白质降解可以通过四种途径来完成,即溶酶体途径、calpain途径、caspase途径和泛素蛋白酶体途径[13]。泛素蛋白酶体途径被认为负责细胞内80~90%的蛋白质周转,包括 actin 和 myosin[14],在肌纤维蛋白降解中具有重要作用。泛素蛋白酶体途径由多种组分构成,即泛素、负责蛋白质泛素化的酶(泛素活化酶、泛素结合酶、泛素连接酶、E4、去泛素化酶)以及26S蛋白酶体。首先,负责泛素化的酶将多个泛素分子与底物蛋白结合,从而标记底物蛋白,然后被26S蛋白酶体识别和降解,途径中任一组分上调都会加强蛋白质的降解。负责降解蛋白质的26S蛋白酶体是一个巨大的胞浆蛋白酶复合物,含多个亚基,由20S蛋白酶体和多种调节复合物(如19S调节复合体)组成,具有多种蛋白酶活性,如类糜蛋白酶活性、类胰蛋白酶活性、谷氨酰水解酶活性、支链氨基酸肽酶活性和中性氨基酸切割活性等,其中类糜蛋白酶位点对多肽的切割是降解26S蛋白酶体降解蛋白质的限速步骤[15]。本研究利用能产生荧光的肽底物——Suc-LLVY-AMC分析腓肠肌26S蛋白酶体类糜蛋白酶活性。结果发现运动0.5小时活性升高,随后降低,运动后6小时又升高,与肌肉3-MH含量变化近一致,提示运动引起的26S蛋白酶体活性的升高可能加强了收缩蛋白的降解。在治疗肌萎缩或因疾病引起的肌消耗症时,常用抑制蛋白酶体活性的药物[16],但不清楚它是否能减缓大强度引起的蛋白大量降解。不过,国外学者Kee等[17]发现,经过5天训练的大鼠与不训练大鼠都进行一次急性跑台运动后,前者蛋白酶体活性比后者低,认为运动适应可减小肌肉泛素蛋白酶体途径对运动应激的反应,有利于蛋白质合成。
有趣的是,我们发现26S蛋白酶体C2亚基mRNA表达不完全和其活性变化一致,在运动后即刻和短时间子恢复期内mRNA含量较安静水平减少,而运动后6小时非常显著增加至安静时2.3倍。其实,26S蛋白酶体活性不仅受亚基含量影响,还受亚基组装与激活的控制,其基因调控比途径其它组分基因更受严密[18]。在剧烈运动初期,26S蛋白酶体活性提高,一方面可以加快降解错误折叠、氧化损伤等蛋白,以保证细胞正常代谢;另一方面加快一些调节蛋白的降解,改变信号通路调节细胞功能以适应运动应激。但是,过度增强的活性可能会对细胞造成伤害[19],因此,运动后短时间内 C2亚基基因表达的降低,可能是调控26S蛋白酶体活性的一种方式,以免活性过度升高。所以我们发现由于亚基基因表达持续低下,使得26S蛋白酶体活性在运动0.5小时升高后开始降低,一直到运动后6小时C2基因表达才又明显升高,而此时的蛋白酶体活性也明显增强。这可能是由于细胞外因素变化,如糖皮质激素、TNF-α、IL-1、IL-6等激活细胞内某些信号通路[20-22],提高了基因的表达,加强了蛋白酶体组装,使蛋白酶体活性增强。运动后蛋白酶体活性的升高,可以加强氨基酸周转,为物质的合成提供能量(禁食的时候)以及为促进运动后蛋白质的重塑提供基础[23,24]。
4 总结
大强度运动后即刻和运动后6小时大鼠腓肠肌收缩蛋白降解增加,可能是26S蛋白酶体活性升高所致,其中26S蛋白酶体C2亚基mRNA表达调控着运动对其活性的影响。
[1]袁建琴,王瑞元,李肃反.离心运动对对大鼠骨骼肌结蛋白分布和表达的影响——对骨骼肌损伤机制的研究.体育科学,2005,25(6):63-66.
[2]周越.离心运动对骨骼肌细胞膜骨架蛋白含量的影响.北京:北京体育大学博士学位论文,2005.20-31.
[3]李俊平.低氧、低氧运动对骨骼肌Titin和Nebulin的影响机理.北京:北京体育大学博士学位论文,2007.68-69.
[4]Brooks GA,White TP.Determination of metabolic and heart rate responses of rats to treadmill exercise.J Appl Physiol,1978,45:1009-1015.
[5]Hollander J,Fiebig R,Gore M,et al.Superoxide dismutase gene expression is activated by a single bout of exercise in rat skeletal muscle.Pflügers Arch,2001,442(3):426-434.
[6]孙靖.实验动物学基础.北京:北京科学技术出版社,2005.182.
[7]申传安,柴家科,廖杰,等.高效液相色谱-荧光检测法测定大鼠骨骼肌组织内微量三甲基组氨酸.军医进修学院学报,2003,24(2):120-122.
[8]Kadowaki M,Harada N,Takahashi S,et al.Differential regulation of the degradation of myofibrillar and total proteins in skeletal muscle of rats:effects of streptozotocin-induced diabetes,dietary protein and starvation.J Nutr,1989,119:471-477.
[9]Ventrucci G,Mello MAR,Gomes-Marcondes MCC.Proteasome activity is altered in skeletal muscle tissue of tumour-bearing rats fed a leucine-rich diet.Endocrine-Related Cancer,2004,11:887-895.
[10]Combaret L,Dardevet D,Rieu I,et al.A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle.J Physiol,2005,569(2):489-499.
[11]Trayer IP,Harris CI,Perry SV.3-Methyl histidine and adult and foetalforms of skeletalmusclemyosin.Nature,1968,217(5127):452-453.
[12]Young VR,Alexis SD,Suren Baliga BS,et al.Metabolism of Administered 3-Methylhistidine.Lack of muscle transfer ribonucleic acid charging and quantitative excretion as 3-methylhistidine and its N-acety derivative.J Biol Chem,1972,247(11):3592-3600.
[13]Attaix D,Ventadour S,Codran A,et al.The ubiquitin-proteasome system and skeletal muscle wasting.Essays Biochem,2005,41:173-186.
[14]Ventadour S,Attaix D.Mechanisms of skeletal muscle atrophy.Curr Opin Rheumatol,2006,18(6):631-635.
[15]Ferrell K,Wilkinson CR,Dubiel W,et al.Regulatory subunit interactions of the 26S proteasome,a complex problem.Trends Biochem Sci,2000,25(2):83-88.
[16]Tawa Jr NE,Odessey R,Goldberg AL.Inhibitors of the proteasome reduce the accelerated proteolysis in atrophying rat skeletal muscles.J Clin Invest,1997,100(1):197-203.
[17]Kee AJ,Taylor AJ,Carlsson AR,et al.IGF-1 has no effect on postexercise suppression of the ubiquitin-proteasome system in rat skeletal muscle.J Appl Physiol,2002,92(6):2277-2284.
[18]Kostek MC,Chen YW,Cuthbertson DJ,et al.Gene expression responses over 24h to lengthening and shortening contractions in human muscle:major changes in CSRP3,MUSTN1,SIX1,and FBXO32.Physiol Genomics,2007,31:42-52.
[19]Coux O,Tanaka K,Goldberg AL.Structure and functions of the 20S and 26S proteasomes.Annu Rev Biochem,1996,65:801-847.
[20]Petersen AMW,Pedersen BK.The anti-inflammatory effect of exercise.J Appl Physiol,2005,98:1154-1162.
[21]Garcia-Martinez C,Agell N,Llovera M,et al.Tumour necrosis factor-alpha increases the ubiquitinization of rat skeletal muscle proteins.FEBS Lett,1993,323(3):211-214.
[22]Tomiya A,Aizawa T,Nagatomi R,et al.Myofibers Express IL-6 After Eccentric Exercise.Am J Sports Med,2004,32(2):503-508.
[23]Ordway GA,Neufer PD,Chin ER,et al.Chronic contractile activity upregulates the proteasome system in rabbit skeletal muscle.J Appl Physiol,2000,88(3):1134-1141.
[24]Radak Z,Naito H,Kaneko T,et al.Exercise training decreases DNA damage and increases DNA repair and resistance against oxidative stress of proteins in aged rat skeletal muscle.Pflügers Arch,2002,445(2):273-278.
