微生物菌剂酶制剂化肥不同配比对秸秆还田后土壤酶活性的影响*
2010-05-07解媛媛张社奇郭星亮
解媛媛,谷 洁,高 华,张社奇,夏 雪,刘 磊,郭星亮
(1.西北农林科技大学理学院,陕西 杨陵 712100;2.西北农林科技大学 资源环境学院,陕西 杨陵 712100)
随着农村经济的发展和农村能源问题的解决,秸秆不再作为燃料,在收割季节秸秆被露天焚烧的现象日益突出,不仅污染环境,危害人们的身体健康,而且烟雾弥漫,影响交通安全。秸秆还田是秸秆利用的一种重要方式,可以增加土壤有机质含量,为土壤微生物提供养分。
土壤酶主要来源于土壤微生物、土壤动物、植物根系和植物残体,它是土壤有机体的代谢动力,在土壤生态系统的物质循环和能量转化中起着非常重要的作用[1]。由于土壤酶活性与土壤的理化性质、土壤类型等密切相关,并参与了土壤体系中一切生物化学反应过程,因此土壤酶学特征可以作为一种潜在的指标体系指示有关土壤质量及其相关指标[2]。近年来,我国在化肥对土壤酶活性的影响、土壤理化性质与土壤酶活性的关系等方面进行了一系列的研究[3-5],但利用微生物菌剂、酶制剂、化肥不同配比并结合作物生育期对秸秆还田后土壤酶活性影响的研究较少。
研究不同施肥条件下土壤酶活性的变化可以从本质上揭示秸秆腐解、土壤性质变化的生物过程。采用田间试验方法在陕西眉县小麦-玉米一年二熟制度下,以秸秆与微生物菌剂、酶制剂、化肥不同配比为试验处理,不同土壤酶活性为测定指标,以期为合理利用秸秆资源以及培肥地力提供科学依据。
1 材料与方法
1.1 试验设计
1.1.1 试验区概况 试验于2008年在陕西省眉县横渠农场实验站进行。试验所在地属于大陆性季风半湿润温暖气候带,2008年年平均降水量为609.5 mm,主要集中于 7-9月。该地年平均气温为12.9℃,年平均日照为2 015.2 h,光照热量充足,种植制度为夏玉米/冬小麦。
1.1.2 试验材料 试验用玉米品种为中单2号,于2008年6月18日播种,2008年10月5日收获。供试土壤为土,试验前耕层土壤(0-20 cm)主要理化性状为:有机质含量14.06 g/kg、有机碳8.16 g/kg、全氮 0.63 g/kg、全磷0.34 g/kg、全钾16.53 g/kg、速效氮25.91 mg/kg、速效磷 12.84 mg/kg、速效钾82.50 mg/kg、土壤pH为7.65。还田的秸秆为该农田上季产生的小麦秸秆,其养分含量为:全氮3.21 g/kg、全磷0.45 g/kg、全钾 22.3 g/kg。所用微生物菌剂为腐解菌剂,由课题组研制。酶制剂由陕西省酶工程研究所研制。
1.1.3 试验方案 试验共设6个处理,3次重复,随机排列,每个小区面积为9 m×30 m。秸秆和肥料均在播种前一次性施入。小麦秸秆切碎成3~5 cm小段后全量还田,播种前均匀散施于土壤表面,肥料按各处理量撒在地表,之后翻耕。条播机播种。试验处理方案见表1。为了避免农药对土壤酶活性的影响,玉米生长期内采用人工除草,未使用任何除草剂和杀虫剂。
1.2 试验方法
1.2.1 样品的采集和预处理 试验土样采集时间从2008年6月到2008年10月,采用随机采样法,每个小区随机取6点0-20 cm耕层土壤,剔除石砾和植物残根等杂物,混合制样,过2 mm筛后捡去可见有机物,一部分放入4℃冰箱内保存,并立即对其进行土壤酶活性的测定。其余土样风干后分别过2 mm、1 mm和0.25 mm筛,用于测定土壤有机质、速效氮、速效磷等理化性质。

表1 试验处理方案 kg/hm2
1.2.2 测试项目与方法 土壤蔗糖酶用3,5二硝基水扬酸比色法测定[6],即在样品中加入8%的蔗糖溶液后于37℃培养24 h,蔗糖在酶促作用下水解为葡萄糖,测定葡萄糖生成量以表征蔗糖酶的活性,活性单位用mg glucose/(g◦24 h)表示。土壤脲酶用靛酚比色法测定[6],即在样品中加入10%的尿素溶液后于37℃培24 h,使尿素在脲酶的作用下水解为氨,测定氨量以表示其活性,单位用mg NH3-N/(g◦24 h)表示。土壤碱性磷酸酶活性用磷酸苯二钠比色法测定[6],即在样品中加入0.5%磷酸苯二钠溶液和适当的缓冲液,摇匀后于37℃培养24 h,磷酸苯二钠在磷酸酶作用下水解为酚,利用2,6-二溴苯醌绿酰亚胺比色法测定酚的生成量以表征碱性磷酸酶活性,活性单位用mg phenol/(g◦24 h)表示。土壤多酚氧化酶活性用没食子素比色法测定[6],即在样品中加入邻苯三酚后,于30℃培养2 h,使邻苯三酚在多酚氧化酶作用下氧化成紫色没食子素,测定没食子素含量以表征多酚氧化酶活性,单位为mg gallicin/(g◦2 h)。
土壤基本化学性状采用常规分析法测定[7]。其中,土壤pH值用pH计测定;有机质用重铬酸钾容量法(外加热法)测定;全氮用半微量凯氏法;全磷用高氯酸-硫酸-钼锑抗比色法;全钾用火焰光度计法;速效氮、速效磷分别采用碱解扩散法和Olsen法测定[8]。
1.3 数据处理
采用Excel(V2003)及SPSS(V12.0)进行数据处理,并利用Duncan新复极差法进行多重比较。
2 结果和讨论
2.1 土壤酶活性的变化
土壤中进行的生物化学反应属于酶促反应,它是在土壤微环境中发生的[8],环境中的因子可以影响土壤酶活性的大小。Zantua[9]等人研究表明,在一定范围内,底物浓度增加,酶促反应增强。秸秆还田使土壤中的有机物质含量增加,作为酶促反应底物的有机质量的增加会影响土壤酶活性的大小。
2.1.1 土壤蔗糖酶活性的变化 蔗糖酶是广泛存在于土壤中的一种重要的酶,它对增加土壤中易溶性营养物质起着重要作用[9]。土壤中的蔗糖酶活性可以反映土壤中碳元素的转化,是表征土壤生物活性的一种重要的水解酶。它可以将土壤中的蔗糖分解为有利于微生物吸收利用的单糖。Hoffman等人曾提出用蔗糖酶活性作为评价土壤肥力的指标[10]。土壤蔗糖酶活性的动态变化情况从表2可以看出,整个玉米生育期内,不同处理蔗糖酶活性变化趋势不同。秸秆还田(CK)处理的蔗糖酶活性最大值34.15 mg出现在成熟期,秸秆还田+常规施肥(SF)、秸秆还田+常规施肥+增施氮肥(SFN)及秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理蔗糖酶活性最大值出现在灌浆期,秸秆还田+常规施肥+增施氮肥+酶制剂(SFN+E)处理蔗糖酶活性最大值出现在抽雄期,秸秆还田+常规施肥+增施氮肥+腐解菌剂(SFN+D)处理蔗糖酶活性最大值出现在拔节期,除了秸秆还田(CK)及秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理外,其余处理在各生育期其蔗糖酶活性均高于播种前。
除成熟期外,其余各施肥处理的蔗糖酶活性均高于CK处理,高约11.55%~472.13%,其中尤以灌浆期的SFN+E+D处理对蔗糖酶活性增加效果最显著,值为58.30 mg为CK处理拔节期10.19 mg的4.7倍,原因是灌浆期酶制剂和腐解菌剂使得秸秆腐解,为蔗糖酶提供了酶促底物。秸秆还田+常规施肥+增施氮肥+腐解菌剂(SFN+D)及秸秆还田+常规施肥+增施氮肥+酶制剂(SFN+E)处理对于蔗糖酶活性也有着很好的提高作用,这些处理的蔗糖酶活性显著高于其他的处理1.05%~358.78%,表明施用酶制剂和腐解菌剂有助于增强土壤蔗糖酶活性。

表2 不同施肥处理蔗糖酶活性的动态变化mg glucose/(g◦24 h)
在玉米生育期内,各施肥处理的蔗糖酶活性在抽雄期及灌浆期升高,成熟期降低,这是因为抽雄期及灌浆期玉米生长活动旺盛,玉米植株根系分泌土壤中的酶量增加,使得蔗糖酶活性上升[11]。随着玉米的成熟,根系活动减弱,蔗糖酶酶活性也有所下降。各生育期蔗糖酶活性大小顺序为SFN+E+D>SFN+D>SFN+E>SFN>SF>CK处理,表明土壤养分水平越高,土壤蔗糖酶活性越高。
2.1.2 土壤脲酶活性的变化 脲酶在土壤酶系研究中是比较深入的,其酶促反应产物氨是植物氮源之一,其活性反映土壤有机态氮向有效态氮的转化能力和土壤无机氮的供应能力[12]。还有研究表明,脲酶活性随底物浓度的增高而增强[13]。
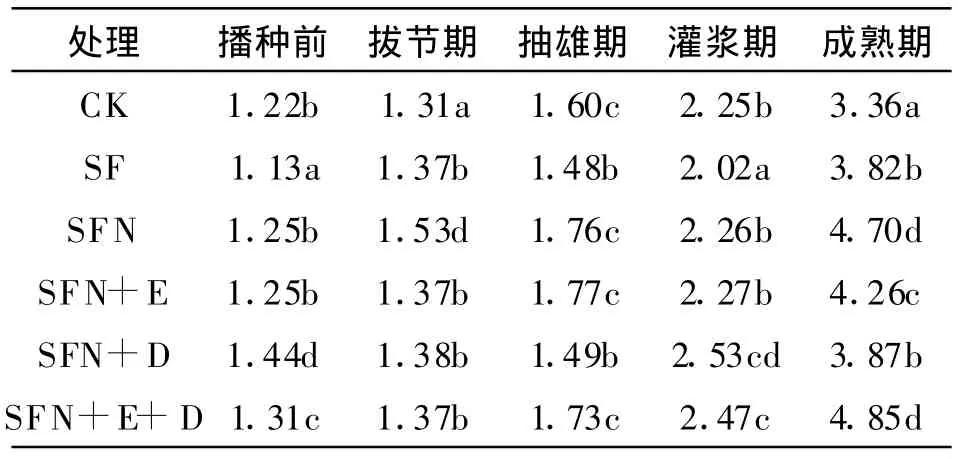
表3 不同施肥处理脲酶活性的动态变化mg NH3-N/(g◦24 h)
从表3可以看出,整个玉米生育期各处理脲酶活性呈现极强的规律性,即自抽雄期后脲酶活性逐渐升高,至灌浆期后脲酶活性持续上升,成熟期呈现最大值,这与孙瑞莲等[5]研究结果相一致。各处理成熟期土壤脲酶活性均显著高于播种前,约提高168.75%~308.69%,尤其是秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理其脲酶活性为4.85 mg是秸秆还田(CK)处理播种前1.22 mg的3倍,是秸秆还田+常规施肥+增施氮肥(SFN)处理播种前的3.2倍。
玉米各生育期中以处理SF播种前的脲酶活性最低,值为1.13 mg。各施肥处理均能明显提高土壤脲酶活性,其中以秸秆还田+常规施肥+增施氮肥+酶制剂(SFN+E)处理效果尤为显著,其次为秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理。这是由于酶制剂本身不仅带有丰富的微生物和酶,而且化肥中的无机氮调节了土壤中的碳氮比,为微生物的活动和酶活性的提高创造了良好的条件,同时合理增施N也可增强脲酶活性,这与前人的研究结果相一致[14-15]。
整体上,玉米各生育期中以CK处理的脲酶活性最低,这是因为CK处理单是秸秆,造成土壤C/N比升高,有效氮下降,以至于脲酶活性降低,说明单施秸秆处理不利于秸秆腐解。基本上各生育期脲酶活性大小顺序为SFN+E+D、SFN+D、SFN+E、SFN>SF、CK处理。
2.1.3 土壤碱性磷酸酶活性的变化 磷酸酶参与土壤磷素循环,加速有机磷的水解,使固定的磷得到释放,提高土壤有效磷的含量。通常按磷酸酶的最适土壤酸碱度将其分为酸性磷酸酶(pH 4-5)、中性磷酸酶(pH 6-7)和碱性磷酸酶(pH 8-10)。由于供试土壤为中性偏碱(pH=7.65),故选择碱性磷酸酶作为本试验土壤磷循环的主要指标[16]。

表4 不同施肥处理碱性磷酸酶活性的动态变化mg phenol/(g◦24h)
从表4可以看出,碱性磷酸酶性质稳定,整个玉米生育期内各处理碱性磷酸酶活性变化幅度较小,且变化趋势基本相同。整个玉米生育期内各处理碱性磷酸酶活性变化趋势均是在拔节期出现一个活性高峰,随后抽雄期有所下降,继而灌浆期出现第二个活性高峰,成熟期又明显下降。玉米各生育期中以CK处理的碱性磷酸酶活性最低,各施肥处理均能明显提高土壤碱性磷酸酶活性,提高了4.78%~153.29%,尤其是秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理灌浆期其碱性磷酸酶活性为3.85 mg是秸秆还田(CK)处理播种前1.52 mg的1.5倍。这是由于秸秆经堆腐后,各种物质被分解成小分子化合物及腐殖质和生长素类物质等,极大地促进了微生物的生长,增加了分泌到土壤中的酶含量,同时微生物菌剂以及酶制剂的加入也改善了土壤的理化性质,最终表现为土壤碱性磷酸酶活性的明显升高。
秸秆还田(CK)、秸秆还田+常规施肥+增施氮肥(SFN)、秸秆还田+常规施肥+增施氮肥+酶制剂(SFN+E)及秸秆还田+常规施肥+增施氮肥+腐解菌剂(SFN+D)处理的碱性磷酸酶活性最大值均出现在拔节期,秸秆还田+常规施肥(SF)及秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理的碱性磷酸酶活性最大值出现在灌浆期,这是因为秸秆还田提供了大量底物以及玉米的根系活动的增强,土壤微生物活性逐渐增强,在拔节期酶活性升高。随后抽雄期迅速下降可能与碱性磷酸酶活性与土壤微生物量磷的再矿化、秸秆中含磷有机物的分解有关[17]。灌浆期玉米根系活动的增强以及小麦秸秆的腐解,各个处理的酶活性又迅速上升,随着玉米的成熟,根系活动减弱,碱性磷酸酶活性在成熟期也有所下降。
基本上各生育期碱性磷酸酶活性大小顺序为SFN+E+D>SFN+D>SFN+E、SFN 、SF>CK处理,这表明了微生物菌剂、酶制剂与化肥配施可明显的提高土壤碱性磷酸酶的活性,同时在有机物质分解过程中产生分子量不同的有机酸,具有改善土壤磷素营养状况功能。
2.1.4 土壤多酚氧化酶活性的变化 多酚氧化酶能使土壤中酚类物质氧化生成醌,促进土壤腐殖质的合成,可见土壤多酚氧化酶可促进土壤有机碳的累积,改善土壤结构状况和其它物理性状[18]。
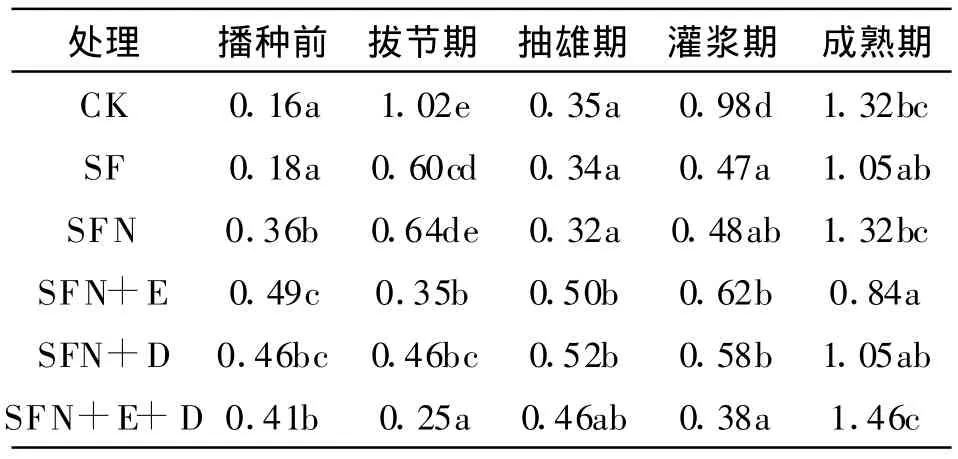
表5 不同施肥处理多酚氧化酶活性的动态变化mg gallicin/(g◦2h)
从表5可以看出,整个玉米生育期内各处理多酚氧化酶变化幅度较大,但变化趋势基本相同。整个玉米生育期内各处理多酚氧化酶活性变化趋势均是自拔节期出现一个活性高峰,随后抽雄期有所下降,至灌浆期各处理多酚氧化酶活性有所升高,成熟期呈现最大值。这是因为玉米根系归还土壤的有机物质增加,为土壤微生物添加了新的碳源,最终引起土壤多酚氧化酶的增强,这表明了微生物菌剂、酶制剂与化肥配施可以不同程度地提高土壤多酚氧化酶活性。
在整个玉米生育期内,成熟期的秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理多酚氧化酶活性达到最大值1.46 mg,是播种前秸秆还田(CK)处理0.16 mg的8.1倍,是播种前秸秆还田+常规施肥(SF)处理0.18 mg的7.1倍,是播种前秸秆还田+常规施肥+增施氮肥(SFN)处理0.36 mg的3倍。在玉米抽雄期,施加微生物菌剂、酶制剂的处理(SFN+E、SFN+D、SFN+E+D)比其他处理的多酚氧化酶活性提高了31.43%~62.5%。这是因为微生物菌剂与酶制剂的施加加速了秸秆的腐解并且提供了反应底物,极大地促进了微生物的生长,因此这些处理的多酚氧化酶活性显著高于其他处理。
成熟期的SFN+E、SFN+D<SFN处理,这可能因为碳氮比例不够协调和有机物质的分解,影响了土壤空气的氧分压和氧化还原电位,从而造成了土壤多酚氧化酶活性的差异。基本上各生育期多酚氧化酶活性大小顺序为SFN+E+D、SFN+D、SFN+E>SFN>CK>SF处理。
2.2 土壤酶与土壤主要养分因子的相关性分析
土壤酶是一个非常复杂的体系,不仅与土壤环境的各种因子有着密不可分的关系,不同种类的酶系之间也存在着复杂的关系。
从表6可看出,脲酶和碱性磷酸酶之间以及蔗糖酶和碱性磷酸酶之间存在极显著正相关,而多酚氧化酶与其它所有酶类都达不到显著相关,这与邱莉萍[19]、耿玉清[20]等人的研究是相同的。土壤脲酶、蔗糖酶和碱性磷酸酶在进行酶促反应时,不仅具有自身的专一特性,同时三者之间存在着一些共性。而这些有共性关系的土壤酶类,其总体活性在某种程度上反映着土壤肥力水平的高低[21]。由此可得出,脲酶、蔗糖酶和碱性磷酸酶的总体活性可以用来衡量土壤的肥力水平。
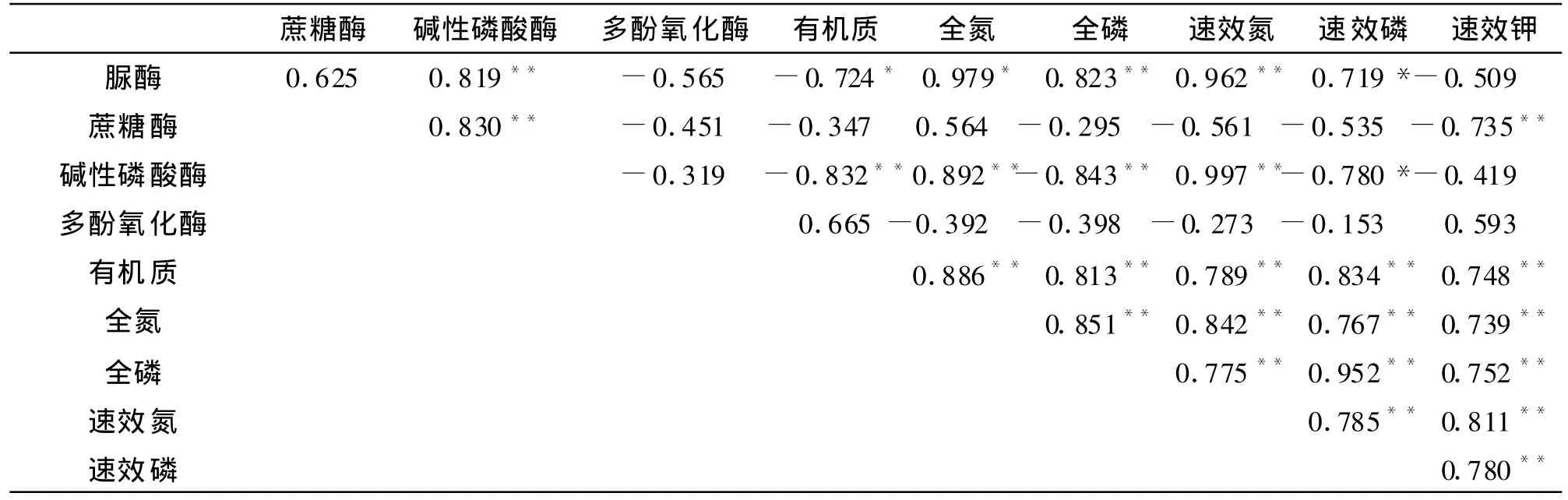
表6 土壤酶活性与土壤养分含量之间的相关性
Hopkins研究[22]表明,土壤肥力水平在很大程度上受制于土壤酶的影响,与土壤酶活性之间存在非常密切的相关关系。为此,对土壤酶与土壤主要养分因子之间作了相关分析。分析结果表明(表6),有机质、全氮、全磷、速效氮、速效磷与脲酶、碱性磷酸酶活性呈显著或极显著相关,蔗糖酶与速效钾呈显著负相关,而多酚氧化酶与这些养分因子相关性均不显著。这一结果进一步确定了可以用土壤脲酶、蔗糖酶和碱性磷酸酶的活性来作为评价土壤肥力的指标。
3 结论
(1)微生物菌剂、酶制剂与化肥配施可以明显的提高土壤中蔗糖酶、脲酶、碱性磷酸酶和多酚氧化酶的活性,其中秸秆还田+常规施肥+增施氮肥+酶制剂+腐解菌剂(SFN+E+D)处理效果尤为显著,针对塿土而言,这种施肥方式可以为作物稳产高产创造良好的土壤生物化学环境。
(2)在玉米整个生育期内,土壤酶活性随着玉米生长的动态变化存在差异。土壤蔗糖酶活性在抽雄期及灌浆期升高,成熟期降低;土壤脲酶活性呈现极强的规律性,即自抽雄期后脲酶活性逐渐升高,至灌浆期后脲酶活性持续上升,成熟期呈现最大值;土壤碱性磷酸酶在玉米拔节期及灌浆期出现两个活性高峰;而土壤多酚氧化酶是自拔节期出现一个活性高峰,随后抽雄期有所下降,但灌浆期后活性有所升高,成熟期呈现最大值。
(3)土壤酶活性之间呈现规律性变化:土壤蔗糖酶和碱性磷酸酶的峰值均出现在玉米灌浆期;而土壤脲酶和多酚氧化酶的峰值均出现在玉米成熟期;大多情况下,土壤酶活性高于播种前。这表明了作物的生长发育与土壤酶活性关系密切。
(4)土壤酶与土壤养分因子之间具有明显相关性,土壤酶活性的高低可以反映土壤养分转化的强弱,揭示出了土壤蔗糖酶、脲酶和碱性磷酸酶活性可以用来作为评价土壤肥力水平的综合指标。
[1] 周礼恺,张志明,曹承绵.土壤酶活性的总体在评价土壤肥力水平中作用[J].土壤学报,1983,20(4):413-417.
[2] Apsimonhm.Ammonium emissions and their role in acid deposition[J].Atmospheric Environment,1987,21:1939-1945.
[3] 袁玲,杨邦俊,郑兰君,等.长期施肥对土壤酶活性和氮磷养分的影响[J].植物营养与肥料学报,1997,3(4):300-306.
[4] 任祖淦,陈玉水,唐福钦,等.有机无机肥料配施对土壤微生物和酶活性的影响[J].植物营养与肥料学报,1996,2(3):279-283.
[5] 孙瑞莲,赵秉强,朱鲁生,等.长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用[J].植物营养与肥料学报,2003,9(4):406-410.
[6] 关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
[7] 中国科学院南京土壤研究所.土壤理化分析[M].上海:上海科学技术出版社,1981:62-142.
[8] Tarafdar J C,M eena S,Kathju S.Influence of straw size on activity and biomass of soil microorganisms during decomposition[J].Eur.J.Soil Biol,2001(37):157-160.
[9] Zantua M I,Dumenil L C,Bremner J M.Relationships between soil urease activity and other soil properties[J].Soil Sci.Soc.Am.J.,1977,41:350-352.
[10] 杜伟文,欧阳中万.土壤酶研究进展[J].湖南林业科技,2005,32(5):76-80.
[11] 陈华癸,樊庆笙.微生物学[M].北京:农业出版社,1980.
[12] 蒋和,翁文钰,林增泉.施肥十年后的水稻土微生物学特性和酶活性的研究[J].土壤通报,1990,21(6):265-268.
[13] Castaldi P,Garau G,Melis P.Maturity assessment of compost from municipal solid waste through the study of enzyme activities and water-soluble fractions[J].Waste Management,2008,28:534-540.
[14] Bandick A K,Dick R,Field P.management effects on soil enzyme activities[J].Soil Biol Biochem,1999,31:1471-1479.
[15] Powlson D S,Brookes P C,Christensen B T.Measurement of soil microbial biomass provides an early indication of changes in total organic matter due to straw incorporation[J].Soil Biology&Biochemistry,1987,19:159-164.
[16] 赵兰坡.土壤磷酸酶活性测定方法的探讨[J].土壤通报,1986(3):138-141.
[17] Mersi W,Schinner F.An improved and accurate method for determining the dehydrogenase activity of soils with iodonitrotetrazolium chloride[J].Biology and Fertility of Soils,1991,11:216-220.
[18] 周礼恺.土壤酶学[M].北京:科学出版社,1987:229-230.
[19] 邱莉萍,刘军,和文祥,等.长期培肥对土壤酶活性的影响[J].干旱地区农业研究,2003,21(4):44-47.
[20] 耿玉清,白翠霞,赵铁蕊,等.北京八达岭地区土壤酶活性及其与土壤肥力的关系[J].北京林业大学学报,2006,28(5):7-11.
[21] Disk R P.Soil enzyme activities as integrative indicators of soil health[M]//Pnkrst C,Dube B M,Gupta V V S R.Biological Indicators of Soil Health.CAB International,Wallingford,Oxon,UK,1997:121-157.
[22] Hopkins D W,Shiel R S.Size and activity of soil microbial communities in long-term experimental grassland plots treated with manure and inorganic fertilizers[J].Biology&Fertility of Soils,1996,22:66-70.
