辛伐他汀抑制血管平滑肌细胞增殖的可能表遗传新机制
2010-05-07谢静李晓琼王树人李丽娟
谢静 李晓琼 王树人 李丽娟
(1.四川省第四人民医院病理科,四川 成都 610016;2.四川大学华西医学中心病理生理学教研室,四川 成都 610041;3.贵州省遵义医学院病理生理教研室,贵州 遵义 563003)
3-羟基-3-甲基戊二酰辅酶 A(HMG-CoA)还原酶抑制药(他汀类)是目前临床上应用最为广泛的调血脂药物。近年来的大量研究提示,他汀类除调脂作用外,还具有一系列调脂外作用,可能在动脉粥样硬化和冠心病的防治中占有重要地位。有研究显示,脂质和脂蛋白成份具有直接调控染色质结构和基因表达的功能[1],如 VLDL可诱导平滑肌细胞的增殖,胆固醇、氧化、糖基化脂蛋白促进动脉壁的纤维化等[2]。但在基因水平,脂质成份的这些影响多不至于引起基因突变,而更可能是通过表遗传机制引起基因的表达异常。因此,调脂药物也可能在表遗传水平通过对基因表达调控的影响进而发挥抗动脉粥样硬化的功效。
多梳基因(Polycomb group genes,PcG)的表达和功能改变目前被认为是一个非常早期的环节。PcG是一个在机体发育过程中控制许多重要基因活性的基因家族,Polycomb复合物对于胚胎发育和不同谱系基因抑制及长期基因沉默是必不可少的的主要组份,并与肿瘤干细胞的发育密切相关。As病损中VSM C的增殖与良性肿瘤增殖具有高度相似的单克隆性,因此,诱发VSMC增殖的早期基因调控中,很可能会有PcG家族成员的改变。Bmi-1基因属于PcG家族的PCR1,与多种干细胞的增殖密切相关。血管平滑肌细胞的表型转换和异常增殖是动脉粥样硬化的病理生理基础,而多梳基因Bmi-1表达的变化在VSMC的表型转换和增殖中发挥重要的调控作用,且是其中的早期基因事件[3]。血管平滑肌细胞在体外培养至第四代时已经发生了明显的表型转换[4],因此本研究通过检测辛伐他汀对体外培养的第四代血管平滑肌细胞多梳基因Bmi-1的表达及其对细胞增殖、凋亡、周期的影响,以观察调脂药物是否可以在表遗传水平发挥作用,为辛伐他汀的作用机制提供新的解释。
1 材料与方法
1.1 主要仪器和试剂
CO2孵箱(Heraeus,Germany);紫外分光光度计(Perkin Elmer LamBda Bio40,Germany);PCR仪(Biometra,Germany);倒置相差显微镜(Nikon,Japan);pH测定仪(4330,JENWAY Ltd,UK);电泳仪和酶标仪(BIO-RAD,America);流式细胞仪(ELITE EST coulter,America);凝胶成像系统(DBT-08,EEC公司)。辛伐他汀、DM EM/F12培养基、小牛血清、0.25%胰蛋白酶及RT-PCR试剂盒(成都博瑞克生物技术有限公司);四甲基偶氮唑盐(Methyl thiazolyl tetrazolium,MT T)和PI染料(Sigma公司);AnnexinⅤ/PI试剂盒(武汉博士德生物工程有限公司)。
1.2 方法
1.2.1 细胞分离与培养
取8w龄雄性SD大鼠,体重120g左右,购自四川中药研究所,常规处死,剖胸取出胸主动脉。分离血管周围组织,纵向剖开血管,分离中、外膜。将中膜剪成 1 mm×1 mm×1 mm组织块。添加含有20%小牛血清的 DMEM/F12培养基,5%CO2、37℃培养箱培养。7-9d后细胞达汇合状态时,用0.25%胰蛋白酶消化,传代。取第1~4代细胞用于实验。
1.2.2 实验分组
实验分两组:对照组和辛伐他汀处理组。对照组:正常生长的第四代平滑肌细胞;辛伐他汀处理组:不同浓度辛伐他汀(5,10,20,40μ mol◦L-1)作用第四代平滑肌细胞 12、24和36h。
1.2.3 逆转录聚合酶链反应检测Bmi-1 mRNA
用Trizol试剂提取各组大鼠VSMC总RNA,用逆转录酶和Oliga(dT)20引物合成cDNA。Bmi-1引物序列上游为5'-AGA GAA GCC AAA GGA GGAGGT-3',下游为 5'-GAT GAT TTC CGA GGT CTACTG G-3',扩增长度为494bp;内参L-19引物序列上游为5'-CTG AAG GTC AAA GGG AAT GTG-3',下游为 5'-GGA CAG AGT CT T GAT GAT CTC-3',扩增长度为194bp。两对引物均加入25μ L反应体系中,PCR反应条件为 94℃变性45s,56℃复性45s,72℃延伸60s,共35个循环。RT-PCR产物经20g◦L-1琼脂糖胶分离后凝胶成像系统摄影,用Gel-pro凝胶定量分析软件分析RT-PCR产量。
1.2.4 细胞形态观察
取对数生长期细胞,以每孔2×105的量接种于6孔板,4h后加入终浓度 0、5、10、20、和 40μ mol◦ L-1的辛伐他汀,药物处理后12、24和36h在倒置显微镜下连续观察细胞形态学变化并拍摄记录细胞形态。
1.2.5 四甲基偶氮唑盐法测定细胞增殖活力
分别收集对数生长期细胞,用胰酶消化,制成细胞悬液(5×1012◦ L-1),加入 96 孔培养板,每孔 200μ L,置 5%CO2、37℃培养箱中,培养24h后吸出培养液,按分组设计加入不同浓度(0、5、10、20、和 40μ mol◦ L-1)辛伐他汀,分别培养 12、24和36h,在终止培养前4 h每孔加入20μ L MT T(5g◦L-1),置5%CO2、37℃培养箱中作用4h,除去上清液,加入 150μ L DMSO溶解,平板振荡仪振荡10min,酶标仪490nm波长检测各孔吸光度值。以只加培养液不含细胞的培养孔为空白对照组。
1.2.6 细胞周期及凋亡检测
选取 24h 作 为时 间点,加 入不同 浓度(0、5、10、20、和40μ mol◦L-1)辛伐他汀培养细胞后,用 0.25%胰蛋白酶消化收集细胞,800 r◦min-1离心5min,弃去培养液,磷酸盐缓冲液(PBS)洗涤1次,离心去PBS,加入冰预冷的 70%乙醇固定,4℃冰箱中保存。染色前以PBS离心沉淀去除固定液,加入PI染色,4℃避光30min,上机行流式细胞术检测细胞周期变化。同样用胰酶消化收集不同浓度组辛伐他汀液培养24 h后的细胞,按照AnnexinⅤ/PI试剂盒说明进行操作,流式细胞术分析细胞凋亡情况。
1.3 统计学方法
2 结果
2.1 辛伐他汀对第四代大鼠血管平滑肌细胞Bmi-1 mRNA表达水平的影响
采用RT-PCR检测Bmi-1的mRNA表达水平。不同浓度辛伐他汀作用细胞12、24、36h后,Bmi-1的 mRNA表达水平随作用浓度的增加和时间的延长呈下降趋势(P<0.05,n=3)。(见图1)
2.2 细胞形态学改变
加药前对照组与辛伐他汀加药组平滑肌细胞数量和形态基本一致;加药12、24和 36h后,对照组细胞生长良好、数量随生长时间增长而增多,细胞大小均匀、形态一致并呈梭形,高倍镜下可见细胞染色质疏松、胞质丰富。加药组细胞培养 12h后,辛伐他汀低浓度组与对照组相比变化不明显,40μ mol◦L-1组可见细胞数量减少、细胞大小和形态不均,部分细胞胞体肿胀变圆。药物作用24和36h后,各实验组均可见细胞数量明显减少,细胞大小不一,形态不规则,高倍镜可见细胞核固缩、胞质减少以及胞质内出现空泡,大部分细胞脱壁呈半悬浮状态,以上细胞数量及形态改变随药物作用时间的延长和浓度的增加而更明显(见图2)。
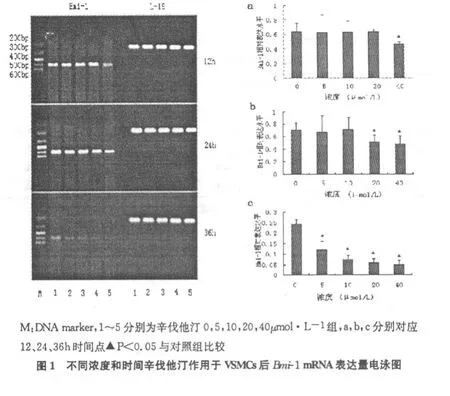

2.3 辛伐他汀对平滑肌细胞生长的抑制作用
M TT试验显示,辛伐他汀作用12、24和36h后,各浓度组均出现了不同程度的生长抑制(P<0.05,n=14;见图3)。

图3 不同时间和浓度辛伐他汀对VS MC s的A490值的影响
2.4 细胞凋亡及细胞周期的检测
经 5、10、20、40μ mol◦L-1的辛伐他汀作用 24h 后,平滑肌细胞凋亡率明显增加。细胞周期检测显示G0/G1期细胞比例明显增加,而S期细胞比例明显降低,显示细胞主要阻滞于G0/G1期,且随着浓度的增高及时间的延长,细胞凋亡和周期阻滞越明显(见表1,图4)。
3 讨论
近年来,随着人们生活水平的提高和工作节奏的加快,心脑血管病的发病率和病死率都呈明显的上升态势。动脉粥样硬化是心脑血管病的主要病理基础,引起动脉粥样硬化和冠心病的危险因素很多,其中脂质代谢紊乱尤为重要。
表1 不同浓度辛伐他汀作用24h后对VSMCs凋亡及细胞周期的影响(,n=3)
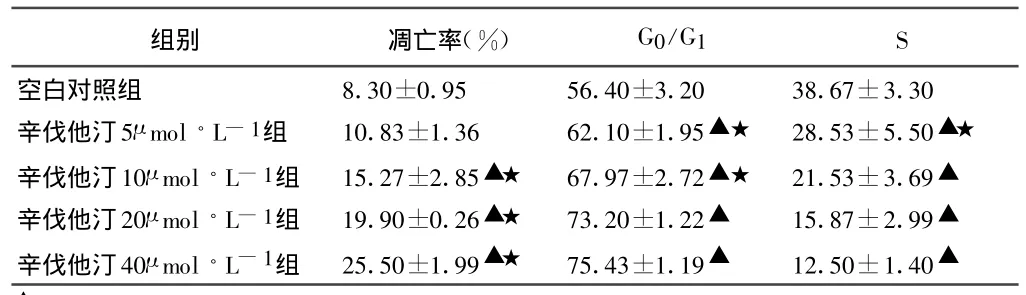
表1 不同浓度辛伐他汀作用24h后对VSMCs凋亡及细胞周期的影响(,n=3)
▲P<0.05与对照组比较;★P<0.05与不同浓度组间比较。
组别 凋亡率(%) G0/G1 S空白对照组 8.30±0.95 56.40±3.20 38.67±3.30辛伐他汀5μ mol◦L-1组 10.83±1.36 62.10±1.95▲★ 28.53±5.50▲★辛伐他汀10μ mol◦L-1组 15.27±2.85▲★ 67.97±2.72▲★ 21.53±3.69▲辛伐他汀20μ mol◦L-1组 19.90±0.26▲★ 73.20±1.22▲ 15.87±2.99▲辛伐他汀40μ mol◦L-1组 25.50±1.99▲★ 75.43±1.19▲ 12.50±1.40▲
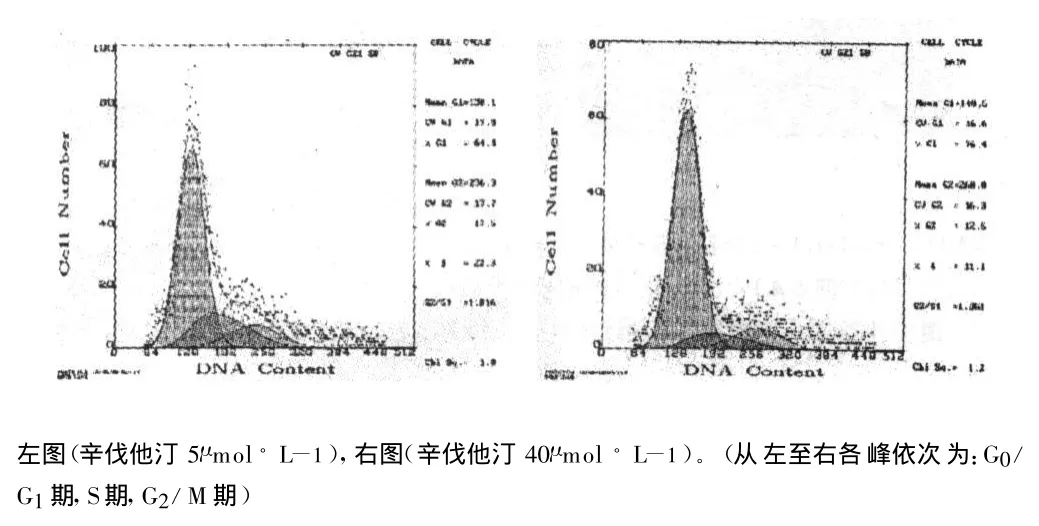
图4 24h不同浓度辛伐他汀处理后细胞周期的变化
3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制药(他汀类)是目前临床上应用最为广泛的调血脂药物。HMGCoA还原酶是细胞内甲羟戊酸(M VA)合成途径的限速酶,其催化产物MVA及下游产物参与细胞膜构成、糖蛋白合成、电子传递、细胞内信号转导及细胞周期进展等重要的生物学功能[5]。他汀类药物通过对该酶特异性抑制作用,使HMG-CoA不能转变成MVA,从而阻断胆固醇的合成,降低血胆固醇的水平,已普遍用于临床治疗高脂血症。近年来的大量研究提示,他汀类除调脂作用外,还具有调脂外作用,主要包括改善内皮功能、抑制平滑肌细胞的增殖和聚集、诱导凋亡和抑制炎症反应,减缓斑块的形成,减小斑块大小及稳定斑块等作用[6]。
他汀类药物能通过多种途径抑制细胞增殖,如:抑制细胞内胆固醇的合成,使质膜的构成比例变化,导致细胞通讯连接子的构象或功能改变[7];破坏细胞内钙稳态[8];下调细胞外信号调节激酶活性[9];增加表达周期素依赖性蛋白激酶抑制因子,导致细胞在G0/G1阻滞[10]。他汀类药物诱导凋亡的机制主要在于通过影响M VA途径而发挥作用:当MVA代谢产物水平下降时,关键信号转导蛋白的异戊烯化受阻,引起调控细胞凋亡的一系列分子表达改变,包括原癌基因和抑癌基因的产物,从而影响凋亡信号级联反应,诱导细胞凋亡[11]。
虽然调脂治疗作用可解释临床上应用他汀类获得的较多益处,但更多研究支持他汀类药物具有调脂以外的临床益处,他汀类的非调脂作用可能在动脉粥样硬化和冠心病的防治中占有重要地位。辛伐他汀除了通过以上途径引起细胞的增殖抑制和凋亡外,是否在表遗传方面发挥作用尚未见报导。
本研究结果发现:在使用安全用药浓度范围内的辛伐他汀作用于发生表型转换的平滑肌细胞后,能明显降低Bmi-1基因的表达,同时抑制细胞增殖,促进凋亡,将细胞周期阻滞在G0/G1期。这表明辛伐他汀确能通过影响表遗传调控过程发挥抗血管平滑肌细胞增殖的作用,从而揭示了辛伐他汀抗动脉粥样硬化的另一新的作用机制。
1 Zaina S,Dossing KB,Lindholm MW,et al.Chromatin modification by lipids and lipoprotein components:an initiating event in atherogenesis?[J].Curr Opin Lipidol,2005,16(5):549-553.
2 Lipskaia L,Pourci M-L,Delomenie C,et al.Phosphoinositol 3-kinase and calcium-activated transcription pathway s are required for V LDL-induced smooth muscle cell proliferation[J].Circ Res,2003,92(10):1115-1122.
3 谢静,李丽娟,王树人,等.体外培养的平滑肌细胞多梳基因Bmi-1的表达变化及其与细胞增殖和细胞周期的关系[J].中国动脉硬化杂志,2009,17(1):43-47.
4 王生兰,苏娟,徐一洲,等.大鼠血管平滑肌细胞体外培养的表型转换及表型鉴定[J].中国动脉硬化杂志,2008,16(4):268-272.
5 Goldstein JL,Brown MS.Regulation of the mevalonate pathway[J].Nature,1990,343(6257):425-430.
6 Athyros VG,Kakafika AI,Tziomalos K,et al.Pleiotropic effects of statins-clinical evidence[J].Current Pharmaceutical Design,2009,15(5):479-489.
7 周永,糜漫天,朱俊东,等.洛伐他汀对MCF-7细胞增殖分化功能及间隙连接细胞通讯的影响[J].癌症,2003,22(3):257-261.
8 Florio T,T hellung S,Arena S,et al.Somatostatin and its analog lanreotide inhibit the proliferation of dispersed human non-functioning pituitary adenoma cells in vitro[J].Eur J Endocrinol,1999,141(4):396-408.
9 Holstein SA,Hohl RJ.Interaction of cy tosine arabinoside and lovastatin in human leukemia cells[J].Leukemia Res,2001,25(8):651-660.
10 Zuckerbraun BS,Shapiro RA,Billiar TR,et al.RhoA influences the nuclear localization of extracellular signal-regulated kinases to modulate p21Waf/Ciplexpression[J].Circulation,2003,108(7):876-881.
11 Xia Z,T an MM,Wong WW,et al.Blocking protein gerany lgeranylation is essential for lovastatin-induced apoptosis of human acute myeloid leukemia cells[J].Leukemia,2001,15(9):1398-1407.
