东方百合不同外植体愈伤组织诱导效果
2010-05-01高慧卿樊兰瑛王秀红高宏樟
高慧卿,樊兰瑛,王秀红,高宏樟
(1.山西省农业科学院现代农业研究中心,山西太原030031;2.山西省农业科学院农业资源综合考察研究所,山西太原030006)
近几年,我国百合切花市场消费量不断攀升,生产面积逐年增长。据不完全统计,目前全国的百合切花生产面积已达0.2万多hm2,年生产百合切花2亿多支[1]。百合切花的规模化生产,拉动了百合种球的需求,而目前我国商品化生产用东方百合种球主要依靠进口,这已成为阻碍我国百合切花产业发展的最大瓶颈。为了降低成本,实现种球国产化,通过组培技术解决新品种繁育是一条较好途径。本研究以Tiber品种的新鲜鳞茎、花器官、花后的鳞茎等为外植体,探讨了不同取材部位、不同生长调节剂对其愈伤组织的诱导效果,旨在为东方百合的组培快繁研究提供基础。
1 材料和方法
1.1 不同外植体的选择及预处理
选取东方百合Tiber品种的鳞片、叶片、花器官(花瓣、花托、花丝)、花后鳞茎、幼嫩鳞茎、老鳞茎及鳞茎盘为外植体,将外植体剥离后用加入洗涤剂的清水洗3次,之后用流水冲20min,过纯净水1次。用75%乙醇灭菌30 s,无菌水冲洗2次,0.1%的升汞灭菌8min,无菌水冲洗5~6次。灭菌期间要不时轻轻晃动,以保证灭菌彻底,且不伤害外植体。外植体均切为0.5 cm×0.5 cm的方块,进行接种,每瓶4块。
1.2 培养条件
培养室温度20~28℃,光照强度1 500~2 000 lx,光照时间12 h/d,相对湿度70%~80%。
1.3 培养基的设置
以MS为基本培养基,用不同激素浓度的6-BA(0.2,0.5,1.0mg/L)与 NAA(0.1mg/L)组合成3种培养基用于鳞片、叶片和叶柄的诱导培养;2,4-D(0.5,1.0 mg/L)与 6-BA(0,0.5 mg/L)组成3种培养基用于花器官的诱导培养;6-BA(0,0.5 mg/L)与 NAA(0.1,0.5,1.0 mg/L)组成 3种培养基用于花后鳞片外植体的诱导培养。不同培养基均加蔗糖20 g/L,琼脂6.5 g/L,pH 5.8。
1.4 数据处理
应用DPS软件[2]和Excel 2003软件进行数据处理和分析。
2 结果与分析
2.1 鳞片、叶片、叶柄的诱导培养效果
对表1中愈伤诱导率进行方差分析,结果显示,外植体之间差异显著(表2),其中鳞片的愈伤诱导率明显大于叶片和叶柄的愈伤诱导率,而叶片和叶柄之间差异不显著(表3)。试验还发现,鳞茎接种后约20 d便长出嫩绿色愈伤组织,大约30 d可看到丛生芽的雏形;而以叶片和叶柄为外植体的长势较为缓慢,诱导时间比鳞片诱导时间推迟10 d左右,且愈伤组织较小。结果得出,以鳞片为外植体的诱导效果,从数量和质量上均优于叶片和叶柄的诱导效果。

表1 鳞片、叶片、叶柄的诱导培养效果比较

表2 方差分析结果

表3 Duncan’s多重比较
2.2 花瓣、花丝、花托的诱导培养效果
开花时选用花器官的不同部位进行愈伤组织的诱导试验,取未开放的花蕾进行灭菌之后,取花瓣、花丝、花托分别进行培养,结果列于表4。

表4 花瓣、花丝、花托的愈伤诱导培养效果比较
从表4可以看出,接种40 d后,不同的花器官启动愈伤的能力不同,花瓣和花丝在3种培养基中,除花瓣在MS+2,4-D1.0+6-BA0.5中有2个形成愈伤组织外,其余均不能诱导出愈伤组织,在培养过程中全部变白、发干坏死。而花托的愈伤组织诱导效果较好,在3种培养中最低的愈伤诱导率为53.3%,最高的愈伤诱导率为95%,变异系数为0.28。表明花瓣、花丝的诱导是不成功的,而花托的诱导率最高,结果与文献报道的其他百合品种的研究结果一致[3]。
2.3 花后的老鳞茎、鳞茎盘及幼嫩鳞茎的诱导效果
经对表5不定芽的发生率进行方差分析得出,不同外植体间不定芽发生率呈极显著差异(表6),幼嫩鳞茎明显好于成熟的老鳞茎和鳞茎盘,说明新生的鳞茎生命力强,易于诱导分化。老鳞茎和鳞茎盘由于结构致密,脱分化较为困难,诱导率均较低(表7)。从3种外植体的整体诱导水平来看,幼嫩鳞茎均好于后二者;尽管培养基间差异不显著,但对于新鳞茎,一个合适的生长调节素的浓度是至关重要的;对于鳞茎盘,MS+6-BA0.5+NAA1.0培养基的诱导率最高,达到24%,说明较老的外植体选用高浓度的生长调节素有助于细胞的脱分化。

表5 花后的鳞茎、鳞茎盘及幼嫩鳞茎的诱导培养比较

表6 方差分析结果

表7 Duncan’s多重比较
2.4 东方百合Tiber品种不同外植体培养效果总体比较
不同外植体的愈伤诱导效果总体比较如图1所示。
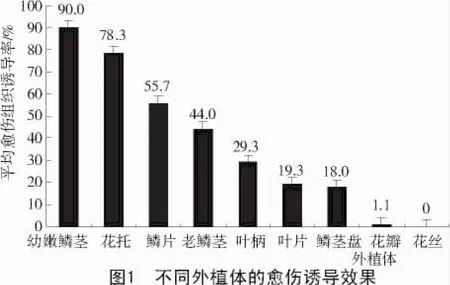
从图1可以看出,不同的外植体培养效果不同,愈伤组织的诱导能力存在差异,其诱导能力从高到低依次为幼嫩鳞茎、花托、鳞片、老鳞茎、叶柄、叶片、鳞茎盘、花瓣,只有花丝诱导不分化。
3 讨论
植物不同外植体的愈伤组织诱导效果和同一外植体在不同激素浓度中的愈伤组织诱导效果均有一定的差异[4]。百合的许多组织和器官都可通过组织培养诱导成苗,常作为外植体的主要有鳞片、叶片、茎尖、珠芽、花丝、花瓣等,其中以鳞片最常见[5-9]。Arzate 等[10]以麝香百合(L longiflorum)的花丝为外植体,通过诱导愈伤组织分化再生植株,未发现遗传变异。Nhut等[11]用百合的花梗、花托、花瓣、花柱等外植体进行离体培养,结果花托最易成活,且诱导率最高。
本试验以东方百合Tiber品种的鳞片、叶片、叶柄、花器官、开花后的老鳞茎和新生的幼嫩鳞茎为外植体,在不同激素浓度的培养基条件下进行诱导试验,结果表明,东方百合Tiber各外植体形成愈伤组织的能力有差异,幼嫩鳞茎花托较易诱导出愈伤组织,且诱导率较高,形成的愈伤组织生长最好,质地疏松。不同外植体愈伤形成能力大小依次为幼嫩鳞茎>花托>鳞片>叶柄>叶片。通过本研究,为进行百合快繁提供技术支持。
[1] 樊兰瑛,高宏樟,郭常莲.东方百合组培快繁试验[J].山西农业科学,2008,36(9):29-32.
[2] 唐启义,冯明光.实用统计分析及其DPS数据处理系统[M].北京:科学出版社,2002.
[3] 王俐,李权林.百合的组织培养和快繁技术[J].云南农业大学学报,1997,19(4):374-375.
[4] 王秀红,孙煊,苑波,等.一品红试管快速繁殖技术研究[J].山西农业科学,2008,36(11):38-40.
[5] 常乐.石蒜属植物再生体系与鳞茎花卉遗传转化体系研究进展[J].华北农学报,2009,24(增刊):76-80.
[6] 张延龙.东方百合叶片组织培养研究 [J].西北农林科技大学学报(自然科学版),2004,32(1):47-50.
[7] 赵祥云,程廉,邢尤美,等.百合珠芽组培及脱毒研究[J].园艺学报,1993,20(3):284-288.
[8] 徐品三,栾雨时,刘纪文,等.百合不定芽培养脱毒种球生产的研究[J].植物学通报,2003,20(3):313-318.
[9] 唐东芹,黄丹枫,唐克轩,等.东方百合鳞片的组织培养[J].植物生理学通讯,2003,39(5):450-452.
[10]Arzate F A M.Efficient callus induction and plant regeneration from filaments with anther in lily(Lilium longiflorum Thunb)[J].PlantCellRep,1997,16(12):836-840.
[11] NhutDT.Shoot induction and plant regeneration from receptacle tissues of Lilium logiflorum [J].Sci Hort,2001,87:131-138.
