tTS真核表达载体构建及稳定转染HepG2细胞系的建立
2010-04-25帅丽芳赵勇张若霜银涛唐博恒
帅丽芳,赵勇,张若霜,银涛,唐博恒
(1.广州军区疾病预防控制中心,广东广州 510507;2.中山大学 实验动物中心,广东 广州510080)
动物模型研究是疾病研究中的重要手段,合适的动物模型对于人类疾病的研究意义尤其重大。但是由于转基因技术是一种基因全表达或不表达的技术,基因表达常不局限在一个器官,一个组织,简单的转基因技术无法回答基因功能的细节问题。此外,转基因动物转入的外源基因常常由于某些基因表达产物使细胞或胚胎不耐受,从而妨碍了转基因动物的建立。故目的基因表达在时序和水平上的有效调控,将有益于基因功能的研究、动物模型发育期间基因表达的分析以及基因治疗过程中基因的运载。目前出现的比较成熟的诱导调控体系主要有四环素调控体系,它是一种真核生物体外表达系统,利用四环素及其衍生物对感兴趣的目的基因进行定时、定量的诱导表达。该系统优点是调节特异性高,宿主基因不受影响,无相关毒性;在特定时间内调节范围较宽。但该系统在目的基因无诱导剂存在时有高水平的背景表达。而四环素转录沉默子tTS可以解决这一缺陷:它与rtTA系统结合在体外体内都呈现低背景高诱导表达功能。本实验将tTS克隆到pApoE-rtTA质粒上,获得了一个能在真核细胞中表达tTS蛋白的pApoE-rt-TA-tTS-Neo表达载体,从而建立一个tTS基因特异性表达的细胞模型,为进一步研究和完善四环素调控体系的严密性奠定基础。
1 材料与方法
1.1 主要材料和试剂
质粒pApoE-rtTA、pApoE-rtTA-Neo由本课题组构建(含有启动子ApoE的质粒Pliv.7由美国John Hopkins University and the Howard Hughes Medical Institute的范春阳博士惠赠);质粒pTet-tTS、pT RE-luc购自 CLONT ECH 公司;Anti-kRAB 本实验室保存 ;HpaⅠ、XhoⅠ、XbaⅠ、SpeⅠ、Hind Ⅲ、NotⅠ、T4连接酶购自宝泰克公司 。
1.2 技术路线与方法
1.2.1 引物设计
上游引物带有 HpaⅠ酶切位点5'-CCA GTT AAC ATG TCT AGA TTA GAT AA-3'、下游引物带有XhoⅠ酶切位点5'-TA CTC GAG TTA CCA GGG ATC CTC T-3'均由北京赛百盛公司合成。
1.2.2 扩增
以质粒pTet-tTS(779-1626 bp)为模板进行PCR,PCR反应体系:质粒pTet-tTS模板1μ L,10×PCR 缓冲液 5 μ L,dNTP(2.5 mmol◦L-1)4 μ L,上下游引物(10 μ mol◦ L-1)各 1 μ L,Ex Taq DNA 酶 0.5 μ L,水 补足 至 50 μ L,反 应条 件为 :96℃预变性2 min后,94℃变性30 s,58℃退火30 s,72℃延伸 45 s,30个循环,最后72℃延伸10 min。PCR产物电泳鉴定。
1.2.3 真核表达载体的构建
将上述tTS基因的PCR产物和质粒pMD18-T分别用限制性内切酶HpaⅠ和XhoⅠ双酶切后,回收tTS基因,质粒pApoE-rtTA用限制性内切酶HpaⅠ和XhoⅠ双酶切后,用 T4连接酶连接tTS基因,转化 E.coli DH5α感受态菌,氨苄青霉素筛选培养,挑取阳性克隆pApoE-rtTA-tTS提取质粒进行酶切和DNA测序鉴定。
将Neo基因和质粒pMD18-T连接后,用限制性内切酶 SpeⅠ和 XbaⅠ酶切,回收 Neo基因。pA-poE-rtTA-tTS用限制性内切酶SpeⅠ单酶切,电泳、回收纯化,与Neo基因连接后转化DH5α感受态菌,筛选培养并挑取阳性克隆 pApoE-rtTA-tTS-Neo扩增,提取质粒进行酶切和DNA测序鉴定。
1.2.4 建立稳定转染tTS的HepG2细胞系[1~3]
将HepG2细胞培养于DMEM(含10%小牛血清)中,置于CO2培养箱培养。待细胞融合至70%~80%时按照 L ipofectamineTM 2000操作说明书进行空质粒pApoE-rtTA-Neo和重组表达载体pApoE-rtTA-tTS-Neo的转染。然后在含有G418(900 mg◦L-1)的选择性培养基中加压筛选6周,获得具G418抗性的阳性细胞克隆,即为稳定表达tTS的HepG2细胞系,命名为HepG2-tTS细胞。
1.2.5 转录水平与翻译水平的表达
1.2.5.1 RT-PCR检测tTS转录水平的表达
收集pApoE-rtTA-Neo转染细胞以及pA-poE-rtTA-tTS-Neo转染细胞,按T rizol试剂说明书提取细胞总 RNA,取1 μ g进行一步法 RTPCR。加入总RNA 2 μ L,2×RT-PCR缓冲液25 μ L,正义引物(10 mmol◦ L-1)2 μ L,反义引物(10 mmol◦ L-1)2 μ L,RT/T aq Mix(10 mmol◦L-1)1 μ L,H2O 补足至 50 μ L,混匀,38℃ 30 min, 逆转录合成cDNA,94℃预变性2 min,进行下述循环:94℃30 s,57℃30 s,72℃45 s,32个循环,再72℃延伸 7 min。β-actin退火温度为62℃。取PCR产物进行琼脂糖凝胶电泳鉴定。
1.2.5.2 Western blot检测tTS翻译水平的表达
将转染细胞进行收集后裂解,取20 μ g处理后的蛋白样品进行SDS-PAGE电泳。电转移至NC膜上,室温振荡封闭1 h后,与稀释后的一抗4℃孵育过夜,洗膜,然后与1∶5000稀释后的HRP标记的二抗室温孵育2 h,洗膜,然后进行显色,检测目的蛋白是否存在。
2 结果与分析
2.1 真核表达载体pApoE-rtTA-tTS-Neo的鉴定
pApoE-rtTA-tTS-Neo质粒的酶切鉴定结果见图1。pApoE-rtTA-tTS-Neo重组质粒经SpeⅠ和NotⅠ单酶切后理论上可切出7700 bp、3600 bp大小的条带,在图1中1泳道可见条带大小与理论相符。pApoE-rtTA-tTS-Neo中经PCR扩增得到与大小相符的条带849 bp。将其送到大连宝泰克公司测序,重组质粒插入片段的序列与质粒pTettTS中的 tTS序列完全一致,表明pApoE-rtTA-tTS-Neo的真核表达载体构建成功。将其命名为pApoE-rtTA-tTS-Neo。

图1 质粒pApoE-rtTA-tTS-Neo经PCR和酶切鉴定图Fig.1 Identification of plasmid pApoE-rtTA-tTS-Neo by PCR and enzyme digestion
2.2 指标检测
2.2.1 细胞克隆中mRNA的表达
HepG2细胞克隆中tTS mRNA的表达,我们所做结果表明稳定转染pApoE-rtTA-tTS-Neo的细胞提取的RNA能扩增出tTS基因(849 bp)、rt-TA 基因(1008 bp)及内参β-actin基因(758 bp)的条带;而稳定转染pApoE-rtTA-Neo质粒的细胞所提RNA仅能扩增出rtTA基因(1008 bp)和代表内参GAPDH基因的758 bp条带,说明tTS基因在稳定转染 pApoE-rtTA-tTS-Neo的 HepG2细胞中mRNA水平上得到了表达。
2.2.2 tTS蛋白在HepG2细胞中的表达
Western blot检测结果(图2)表明,稳定转染pApoE-rtTA-tTS-Neo的细胞检测到tTS在蛋白水平的表达,而对照的空质粒转染后的细胞则没有相应的条带,结果表明所构建的真核表达载体pA-poE-rtTA-tTS-Neo已在HepG2细胞表达。
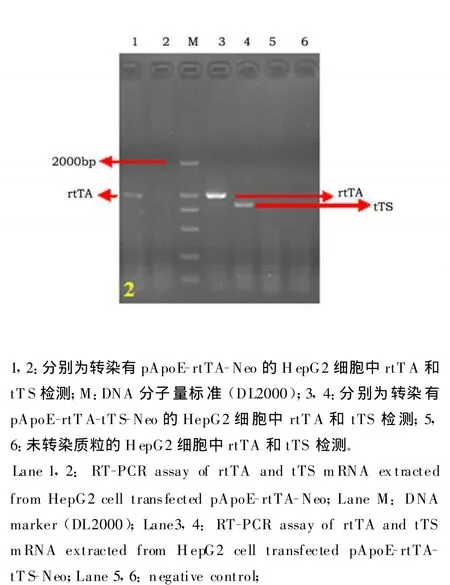
图2 检测转染细胞中tTS和rtTA的mRNA的表达Fig.2 The mRNA of tTS and rtTA detection of the HepG2 cells
图3 β-actin作为对照Fig.3 β-actin as internal control
3 讨论
动物模型研究是疾病研究中的重要手段,可以用来研究人类疾病发生的分子机制、组织病理状况、治疗的效果等,合适的动物模型对于人类疾病的研究意义尤其重大。利用转基因技术培育人类疾病动物模型比用其它方法更加优越,它可在动物原来遗传背景的基因上,通过改变某种基因的表达水平而实现。这种模型模拟动物症状单一,接近于病人症状,产生这些疾病症状的基因是外源基因的转入。因而发展有效的诱导型基因表达系统对于认识基因在生长发育、生理活动及其病理过程中的作用是十分必要的。在大多数基因治疗或真核基因功能研究时,多数转基因都是持续表达的,没有表达量和表达时间的调控。很多情况下,这种持续表达外源基因不论是基因功能研究还是基因治疗都存在很大的局限。基于这些局限性条件,人们正在发展一些可以适用于不同研究需要的基因表达的诱导调控体系。
四环素调控系统是近年来人工设计的一种定时、定量、准确地调控基因表达的调控模式,不仅应用最广,也是已用于转基因动物的可调控表达系统之一[4~6]。研究表明,在调控基因表达的系统中,四环素调控系统在细胞系及机体中都表现出良好的调控作用。
但随着时间的验证,发现该系统也存在背景表达,而这样的模型显然对于精确研究存在着很大局限性[7~8]。因此,如何使四环素调控系统更加严密有效成为研究的热点,如何保证有效目的基因在体内适时、适量地表达是实现安全、有效的基因治疗的保障。因此,对此系统的改进及应用将推动人类疾病基因治疗的进展。
四环素转录沉默子tTS是转录抑制子[9~12],有研究表明,tTS结合rtTA的调控系统可以有效降低基础表达,同时可以增强rtTA的表达水平和转录性能。为使四环素调控系统更加严密有效,我们选用在该调控系统中加入转录沉默子tTS。tTS/rtTA系统特别适用于低背景、高诱导表达。
4 结论
以质粒pTet-tTS为模板获得tTS基因,并插入到 pApoE-rtTA载体中,成功构建了一个表达载体 pApoE-rtTA-tTS-Neo。将该载体转染HepG2细胞,成功构建了转染有 pApoE-rtTA-tTS-Neo的HepG2细胞克隆,用 RT-PCR、Western blotting鉴定,检测到tTS基因在mRNA和蛋白水平均有表达。综上所述,我们认为本研究成功地建立了一个在基因组DNA中稳定整合有pA-poE-rtTA-tTS-Neo载体的 HepG2细胞系,在该细胞系中tTS基因得到了表达。它的建立为研究四环素调控系统的反应部分携带任何感兴趣基因的功能研究提供了一个细胞模型,关于tTS功能特性及它四环素调控系统的关系,我们将作进一步研究。
[1]Sambrook J,Fritsch EF,Manitatis T.分子克隆实验[M].北京:科学出版社,1992:532-576.
[2]F.奥斯伯,R.E金斯顿等.精编分子生物学实验指南[M].北京:中国科学出版社,2001:286-288.
[3]萨姆布鲁克,D.W.拉塞尔.分子克隆实验指南[M].北京:科学出版社,2002(3):1271-1313.
[4]Baron U,Bujard H.Tet repressor-based system for regulated gene ex pression in eukary otic cells:principles and advances[J].Methods Enzymol,2000,327:401-421.
[5]Berens C,Hillen W.Gene regulation by tetracyclines.Constraints of resistance regulation in bacteria shape TetR for application in eukaryotes[J].Eur J Biochem,2003,270:3109-3121.
[6]Gossen M,Bujard H.Studying gene function in eukary otes by conditional gene inactivation[J].Annu Rev Genet,2002,36:153-173.
[7]杨国柱.基于四环素调控系统的肝脏特异表达的转基因小鼠的建立[D].广州:中山大学,2005:22-35.
[8]谢丽,万大方.四环素调控基因表达系统的研究新进展[J].肿瘤,2003,23(6):522-524.
[9]Deuschle U,Meyer WK,Thiesen HJ.Tetracycline-reversible silencing of eukaryotic promoters[J].Mol Cell Biol,1995,15:1907-1914.
[10]Forster K,Helbl V,Lederer T,et al.Tetracycline-inducible expression systems with reduced basal activity in mammalian cells[J].Nucleic Acids Res,1999,27:708-710.
[11]Freundlieb S,Schirra-Muller C,Bujard H.A tetracycline controlled activation/repression system with increased potential for gene transfer into mammalian cells[J].J Gene Med,1999,1:4-12.
[12]Rossi FM,Guicherit OM,Spicher A,et al.T etracyclineregulatable factors with distinct dimerization domains allow reversible growth inhibition by p16[J].Nat Genet,1998,20:389-393.
