降温方法对鸭梨采后种子转色及膜透性的影响
2010-04-25闫师杰王继栋王如福郭李维郝晓玲李晓丹
闫师杰,王继栋,王如福,郭李维,郝晓玲,李晓丹
(1.天津农学院 食品科学系,天津 300384;2.天津市农产品加工科技创新与成果转化基地,天津300384;3.山西农业大学食品科学与工程学院,山西太谷 030801)
鸭梨(Pyrus bretschneideri Rehd cv Yali)是白梨品系中优良主栽品种,在采后贮藏过程易发生黑心病,最初从心皮或心皮背部、腹部微管束开始变色,并且从近萼洼一端开始变色[1]。为什么黑心病总是从心皮和近萼端开始?我们知道心皮内部是种子,是否黑心病的发生与种子有关?本实验拟用急速和缓慢两种降温方法对早、中、晚不同采收成熟度鸭梨进行处理,研究降温方法对不同成熟度鸭梨种子生理及转色的影响,从而研究种子与鸭梨果实褐变的关系。关于急速降温和缓慢降温对鸭梨生理、果实颜色变化的影响已有资料报道[2,3],而对于不同降温方法对鸭梨种子生理及颜色变化影响的资料还未见报道,本实验拟对此进行研究,以进一步完善鸭梨褐变机理,提高鸭梨贮藏品质和延长保鲜期。
1 材料与方法
1.1 实验材料及取样方法
实验用套袋鸭梨采自北京市密云县不老屯镇燕落村,分别于2007年9月6日、9月16日和9月26日采摘中等大小、无虫害、无机械伤的果实,套网套装入纸箱中运抵天津农学院实验冷库,精选后用微孔膜包装,装入专用包装纸箱中,每箱装50个果,每个处理共装18箱。急速降温处理的果实经预冷后直接放入0±1℃冷库中贮藏;缓慢降温处理的果实直接放入12℃冷库中,每5 d降2℃,30 d内将温度降至0±1℃,湿度80%~85%。每隔一定时间从不同果箱中随机选取一定数量的果实,沿果实赤道偏果梗处(尽量避免伤及种子)切开果实,挑出种子,快速进行观察和测定。不同处理方式用以下缩写名表示:早采急降种子-ZJZ,早采缓降种子-ZHZ,中采急降种子-ZHJZ,中采缓降种子-ZHHZ,晚采急降种子-WJZ,晚采缓降种子-WHZ。
1.2 实验方法
1.2.1 种子转色指数的测定
随机选取10个果实,沿果实赤道偏果梗处切开果实,挑出种子,分成三组,每组10~15粒种子,根据种子颜色深浅和面积划分转色级别:淡绿色无褐色为0级;轻微褐变至褐变部位占全部面积的20%以下为1级;20%~50%为2级;50%~75%为3级;大于75%为4级。种子转色指数的计算方法为:

1.2.2 多酚氧化酶(PPO)测定
参照 Venisse等[4]、Galeazzi等[5]和朱广廉[6]的方法进行测定。酶活以每分钟内 OD420变化0.01为1个活性单位 U,酶活性以U◦min-1◦mg protein-1表示,重复3次。
1.2.3 细胞膜渗透率测定
准确称取计算过种子转色指数的种子2 g,用DDS-Ⅱ型电导率仪测定提取液电导度C1,再将试管放入沸水浴中煮沸5 min,冷却后再测定提取液的电导度C0,电导率/%=C1/C0×100计算种子细胞膜渗透率,重复3次。
1.3 数据统计分析
用Excel2003统计分析所有数据,计算标准误差并制图;用SPSS 11.5软件进行方差分析和显著性检验。
2 结果与分析
2.1 不同降温方法对不同成熟度鸭梨采后种子转色指数的影响
由图1可以看出,早采、中采、晚采鸭梨种子转色指数初值分别为0.13(图1A),0.41(图1B)和0.55(图1C),说明不同采收成熟度果实的种子颜色有显著差异(P<0.05)。早采果种子为花籽,颜色较浅,部分为绿白色,部分为浅褐色,随着果实的贮藏期延长,鸭梨种子颜色逐渐加深,转色指数增加;晚采果种子颜色最深,呈褐色,种子转色指数最大,但晚采果种子颜色变化的趋势最缓;中采果种子的颜色及转色指数的增加介于早采和晚采果种子之间,说明不同成熟度果实种子采后转色速度是有差异的。从图1还可看到,在贮藏前中期,急速降温果种子转色指数变化趋势略快于缓慢降温果种子;但后期,两种降温方法对鸭梨种子转色的影响不明显。到贮藏180 d时,早缓、早急、中缓、中急、晚缓、晚急种子转色指数与初值相比分别提高了85.22%、85.71%,52.33%、53.93%、39.56%、38.2%。说明不同成熟度和不同降温方式对采后种子转色影响不同,成熟度越低种子颜色变化越大。
2.2 不同降温方法对不同成熟度鸭梨采后种子PPO活性的影响
从图2可看出,鸭梨采后初期种子PPO活性较高,早采鸭梨种子PPO活性为98.6 U◦min-1◦mg pro-1,中采为121.8 U ◦min-1◦mg pro-1,晚采为85.4 U◦min-1◦mg pro-1。鸭梨采后种子PPO活性变化总体呈先缓慢下降,后迅速升高至高峰后又下降的趋势变化。总体来看,整个贮藏期间早采鸭梨种子PPO活性较高,中采次之,晚采变化最小,这也与图1种子转色指数变化趋势相对应,由于早采种子PPO活性较高造成了其转色指数变化也较快。从图2A中可看出,早采急速降温种子PPO活性在缓慢降温期间(采后40 d前)低于同期缓慢降温果种子,如在高峰时,急速降温和缓慢降温种子PPO活性分别是 127.4 U◦min-1◦mg pro-1和88.7 U ◦min-1◦mg pro-1;而40 d之后直到贮藏结束始终高于同期缓慢降温种子(P<0.05),说明低温促进了种子PPO活性的增加。从图2B可看出,中采鸭梨急速降温种子在贮藏前中期PPO活性略高于同期缓慢降温种子,而后期差异不显著。如图2C所示,不同降温处理对晚采鸭梨种子PPO活性影响只是在高峰时有所区别,而在其它贮藏时间影响不明显(P>0.05),这可能是因为晚采种子成熟度较高,种子颜色大部分已呈褐色,保护组织已经形成的缘故。

图1 降温方法对不同成熟度鸭梨采后种子褐变指数的影响Fig.1 Effect of cooling methods on browning index of seeds of different maturity Yali pear after harvest
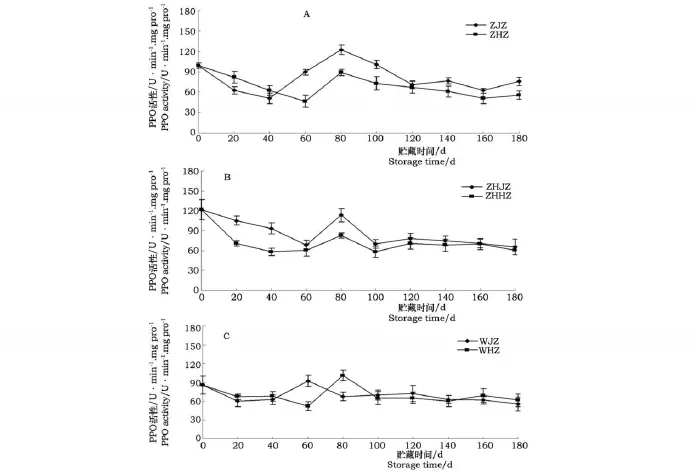
图2 降温方法对不同成熟度鸭梨采后种子多酚氧化酶(PPO)活性的影响Fig.2 Effects of cooling methods on PPO activity of seeds of different maturity Yali pear after harvest
2.3 不同降温方法对不同成熟度鸭梨采后种子细胞膜渗透率的影响
不同降温方法对不同成熟度鸭梨采后种子细胞膜渗透率的影响见图3。
从图3可以看出,在采收初期,早采种子由于没有发育完全,部分为绿白色部分为浅褐色,种子保护组织未发育完全,细胞膜渗透率较高;中采果种子颜色大部分已呈浅褐色,保护层已基本形成,种子采收初期细胞膜渗透率要比早采种子低;晚采果种子颜色加深,发育较完全,采收初期细胞膜渗透率最低。鸭梨种子细胞膜渗透率在贮藏中缓慢升高到出现峰值,之后逐渐下降,到后期又出现升高的趋势变化,高峰出现的时间与种子呼吸高峰出现相近。从图3A可以看到,在缓慢降温阶段(采后40 d前)缓慢降温果种子细胞膜渗透率略高于同期急速降温果种子,之后整个贮藏期低于急速降温果种子(P<0.05),说明急速降温使得种子受到低温胁迫,对种子细胞膜造成了损伤。缓慢降温的中采和晚采果种子的细胞膜渗透率在缓慢降温阶段(采后40 d前)略高于同期急速降温果种子,之后略低于急速降温果种子,在后期影响差异不明显。贮藏末期,种子细胞膜渗透率增高较快,尤其是晚采果趋势最明显,远远高于早采和中采,这也与晚采鸭梨种子发芽率较高,种子休眠被打破吻合。种子细胞膜渗透率出现高峰后下降,这可能是因为高活力种子对细胞膜有自我保护、自我修复的功能所致[7,8]。
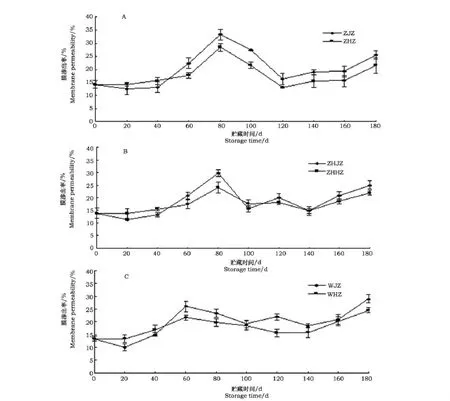
图3 降温方法对不同成熟度鸭梨采后种子细胞膜渗透率的影响Fig.3 Effects of cooling methods on membrane permeability of seeds of different maturity Yali pear after harvest
3 讨论
通过实验发现,随着鸭梨果实贮藏期的延长,鸭梨种子颜色逐渐加深,转色指数增加;PPO活性变化起伏不大,在种子呼吸高峰出现时出现高峰;细胞膜渗透率呈现先升后降再升的变化趋势,分别在种子呼吸高峰时和贮藏后期出现峰值。急速降温促进了鸭梨采后贮藏中种子转色指数、PPO活性和细胞膜渗透率的升高。程奇等[9]研究发现,低温处理时间越长,越提高了杜梨种子的发芽率。鸭梨在贮藏后期种子发育成熟,果实因衰老褐变,细胞膜破坏,组织液渗漏到果心中,再加上低温贮藏,这对鸭梨种子本身就是一种低温层积处理,从而促进鸭梨种子打破休眠萌发。费亚利等[10]研究认为,萌发阶段种子呼吸强度和各种生理代谢急剧上升。本实验研究结果与此相一致,到贮藏末期种子打破休眠发芽,生理代谢和膜的破坏加强,从而对鸭梨果心的褐变造成了影响。
4 结论
通过研究降温方法对三种不同采收成熟度鸭梨种子转色指数、PPO活性与细胞膜渗透率的影响,结果发现,随着采收成熟度的提高和贮藏时间的延长,鸭梨种子颜色逐渐加深,转色指数增加;早采果种子颜色变化最大,晚采果种子最缓,中采果种子介于两者之间。早采鸭梨种子保护组织未发育完全,整个贮藏期间PPO活性和细胞膜渗透性最高,中采果次之,晚采果最低。缓慢降温较好地抑制了鸭梨采后贮藏中种子转色指数、PPO活性和细胞膜渗透率的升高,对早采果种子的影响更为明显,进而延缓了种子生理代谢和果心褐变。
[1]中国科学院北京植物研究所.鸭梨黑心病的研究Ⅰ:温度对黑心病的影响[J].植物学报,1974,16(2):140-143.
[2]闫师杰,陈计峦,梁丽雅,等.降温方法对不同采收成熟度鸭梨某些生理指标的影响[J].中国食品学报,2008,8(4):96-101.
[3]闫师杰,梁丽雅,胡小松,等.不同处理对鸭梨采后颜色变化的影响[J].农业机械学报,2009,40(6):120-123.
[4]Venisse J S,Gullner G,Brisset M N.Evidence for the involvement of an oxidative stress in the initiation of infection of pear by Erwinia amylovora[J].Plant Physiol,2001,125:2164-2172.
[5]Galeazzi M A M,Sgarbieri N,Costantinides S M.Isolation,purifilation and physiochemical characterization of phenol oxidase from dwarf variety of banana(M usa cavendishii)[J].Food Sci,1981,46:150-155.
[6]朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:38-39.
[7]蒋燕,郝文利,田野.液氮保存对南瓜种子生理生化特性的影响[J].北方园艺,2009(2):77-79.
[8]胡晋,龚利强.超低温保存对西瓜种子活力和生理生化特性的影响[J].种子,1996(2):25-28.
[9]程奇,吴翠云,阿依买木.不同处理对梨种子休眠与萌发的影响[J].塔里木大学学报,2005,17(1):28-30.
[10]费亚利,李嘉璐.休眠与萌发过程中苹果的呼吸代谢[J].西北植物学报,1992,12(2):125-130.
