绵羊前体脂肪细胞的原代培养及分化
2010-04-17阿依木古丽杨具田马忠仁卢建雄臧荣鑫吴建平
蔡 勇 阿依木古丽 杨具田 马忠仁 卢建雄 臧荣鑫 吴建平
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.西北民族大学实验中心,兰州 730030;3.西北民族大学生命科学与工程学院,兰州 730030)
绵羊前体脂肪细胞的原代培养及分化
蔡 勇1,2阿依木古丽3杨具田3马忠仁3卢建雄3臧荣鑫3吴建平1*
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.西北民族大学实验中心,兰州 730030;3.西北民族大学生命科学与工程学院,兰州 730030)
本试验旨在建立绵羊前体脂肪细胞的原代培养方法,探讨反刍动物脂肪沉积机理。以1日龄羔羊的肾周脂肪组织为试验材料,采用组织块法和酶消化法分离培养前体脂肪细胞,观察形态学变化,测定生长曲线,油红O染色检测细胞内脂肪含量,并用实时定量PCR法检测脂蛋白脂酶、过氧化物体增殖剂活化受体γ、脂肪酸合酶的表达量。结果表明:原代培养的细胞成分均一、增殖旺盛、分化率高,具有前体脂肪细胞的形态特征和基因表达特性,为绵羊前体脂肪细胞。本试验成功建立了绵羊前体脂肪细胞原代培养方法,并在体外重现了增殖和分化的过程。
绵羊;前体脂肪细胞;原代培养;分化
脂肪组织不仅具有储能功能,而且具有重要的内分泌功能,其代谢失常可引起甘油三酯蓄积过多,导致肥胖、胰岛素抵抗、动脉粥样硬化、Ⅱ型糖尿病等多种肥胖相关疾病的发生[1]。家畜过度沉积脂肪会降低其产品质量,增加饲养成本。因此,认识脂肪形成的规律和机制,调控体脂沉积并改善动物产品质量在畜牧业生产中具有重要意义。
前体脂肪细胞(preadipocyte)是脂肪细胞的前体细胞,是研究脂肪形成(adipogenesis)机理的理想模型,通过培养前体脂肪细胞,能够在体外重现脂肪细胞的发生、增殖和分化的全过程,同时也便于观察各种因素对整个过程的影响,探讨脂肪形成机理,最终达到对脂肪形成的有效控制。国内外已建立了来源于鼠前体脂肪细胞的细胞系,如 3T3L1、3T3F442A、ob17等[2],也开展了大鼠[3]、人[4]、猪[5]、鸡[6]、草鱼[7]和牛[8]前体脂肪细胞原代培养体系的研究,但尚未见绵羊前体脂肪细胞分离培养的相关报道。本试验在借鉴国内外人及其他动物前体脂肪细胞体外原代培养技术的基础上,以兰州大尾羊为动物模型,建立绵羊前体脂肪细胞的体外原代培养体系,为进一步研究反刍动物脂肪沉积机理奠定基础。
1 材料与方法
1.1 试验材料
临床检查无异常的新生1日龄兰州大尾羊,颈部放血致死,无菌条件下取肾及肾周脂肪组织,低温运输,1 h送至实验室进行试验。
1.2 培养液及主要试剂的配制
DMEM/F12培养液:称取 15.60 g DMEM/F12(G ibco),3.50 g NaHCO3,10m L胎牛血清(民海生物),蒸馏水定容至1 L。不加入胎牛血清即为无血清培养液。
红细胞裂解液[3]:8.24 g NH4 C l,0.70 g KHCO3,29.22 mg EDAT,蒸馏水定容至1 L。
胶原酶消化液[3]:0.10 gⅠ型胶原酶(Sigm a)和2.00 g牛血清白蛋白溶于100m L无血清培养液中。
胰蛋白酶消化液:称取0.25 g胰蛋白酶溶于100m L的无血清培养液中。上述溶液均调整pH至7.2~7.4,0.22μm微孔滤膜正压过滤除菌,分装后置-20℃保存。
1.3 前体脂肪细胞培养方法筛选[9]
组织块培养法:无菌条件下取新生羊肾周脂肪组织约3 g,用PBS缓冲液冲洗3次,剪去脂肪组织中可见的血管和其他结缔组织,并将脂肪组织剪成1mm3左右的小块,均匀地摆放在25 m L培养瓶中,37℃、5%CO2培养箱中培养,4 h后加入DMEM/F12培养液继续培养。
胶原酶消化培养法:将脂肪组织处理成1mm3左右的小块,转移至含有玻璃珠的25m L三角烧瓶中,加入1 mg/m L的Ⅰ型胶原酶消化液,置于37℃水浴中消化50min(每5 m in振荡1次),过孔径为200目的钢筛,1 000 r/m in离心5m in弃上清,加入红细胞裂解液,吹打均匀,室温静置 10 m in,1 000 r/m in离心5m in,弃上清液,用培养液重悬,1 000 r/m in离心5 min,弃上清液,加入培养液并吹打均匀,即为绵羊前体脂肪细胞。台盼蓝染色计数,按5×104个/m L的浓度接种于96孔和24孔培养板中,37℃,5%CO2培养箱中培养,每2 d换液1次,并在显微镜下进行观察、照相。
1.4 细胞传代培养及诱导分化
原代培养的前体脂肪细胞达到80%~90%汇合时,用胰蛋白酶消化液消化0.5~3.0m in,用含血清培养液终止消化,按1︰3的比例进行传代培养。传代培养过程中,每2 d更换1次培养液,直至细胞汇合并铺满整个培养皿后,再重复上述操作。第4代培养至80%汇合时,换用诱导分化培养液[DMEM/F12培养液中添加5μg/m L的牛胰岛素(Sigma)、50μg/m L的转铁蛋白质、5 ng/m L亚硒酸钠和50 ng/m L的氢化可的松]进行诱导分化。
1.5 MTT比色法检测细胞活力[10]
将原代细胞悬液按每孔103~104个细胞接种于96孔培养板中(0 d),自第1天起,每隔2 d在同一时间取 8孔,在每孔中加 20μL噻唑蓝溶液(M TT,5m g/m L、PBS配制),继续培养4 h后终止培养,弃去孔内溶液后每孔加150μL二甲基亚砜(DMSO),避光震荡10m in,在酶联检测仪上测定各孔OD490nm值,以时间为横坐标,OD490nm值(表示细胞相对数量)为纵坐标绘制生长曲线。
1.6 油红O染色及脂肪含量的测定
脂肪细胞的油红O染色按照卢建雄等[10]的方法进行,细胞内脂肪含量的测定参考Ram irez等[11]使用的方法,通过测定萃取液OD510nm值来衡量细胞内的脂肪含量。
1.7 引物设计与合成、实时定量PCR
根据GenBank中登录的绵羊脂蛋白脂酶(lipoprotein lipase,LPL,X 68308)、过氧化物体增殖剂活化受体γ(peroxisome proliferators-activated receptorγ,PPARγ,AY 137204)、脂肪酸合酶(fatty acid synthase,FAS,AB011671)和 β-肌动蛋白(β-actin,NM_001009784)基因序列,用 Primer Prem ier 5.0软件设计引物(表1),引物由上海生工生物工程有限公司合成。
用TRIzo l提取细胞总RNA,经琼脂糖电泳检测后立即按照试剂盒说明书进行反转录。用反转录的cDNA第一链为模板进行实时定量PCR(realtime PCR,RT-PCR)(SLAN荧光定量PCR仪)。反应体系为 25μL体系(SYBR Premax Tag 12.5μL、上下游引物各0.25μL、cDNA样品2μL,水补足至 25μL)。反应条件为:95.0℃预变性10 s、95.0 ℃变性5 s、54.0 ℃退火及延伸 25 s,40个循环。每个循环的退火及延伸阶段采集荧光信号数据。扩增结束后立即进行溶解曲线分析,从60.0℃开始每30 s升高1.0℃,直到94.0℃结束,共35个循环,每个循环待温度恒定后5 s采集荧光信号数据,系统自动分析数据后生成溶解曲线报告。反应结束后系统根据梯度稀释模板的扩增情况自动绘制标准曲线,以 β-actin做内参用 ΔCt法[12]进行分析细胞培养过程中脂肪细胞分化标志基因的表达情况。

表1 引物序列与RT-PCR反应参数Tab le 1 Prim er sequences and RT-PCR reaction parameters
1.8 试验设计与数据处理
所有试验均设置5次重复,试验所得数据以平均值±标准差表示,采用SPSS 11.5统计分析软件中的One-w ay ANOVA进行方差分析,Duncan氏方法进行多重比较,显著性水平定为P<0.05。
2 结 果
2.1 绵羊前体脂肪细胞的形态学观察
经胶原酶消化后的绵羊前体脂肪细胞为圆形,3 h后细胞开始贴壁,2 d细胞呈梭形纤维状、三角形或不规则形状(图1),4 d形成单层汇合,部分细胞内出现微小脂滴(图2),6 d分化的细胞增多,并可见散在分布的大小不等的脂滴(图3),9 d脂滴逐渐融合,细胞核位于边缘,之后细胞停止生长,脂滴逐渐变得灰暗,部分细胞脱落,浮于培养液内(图4)。
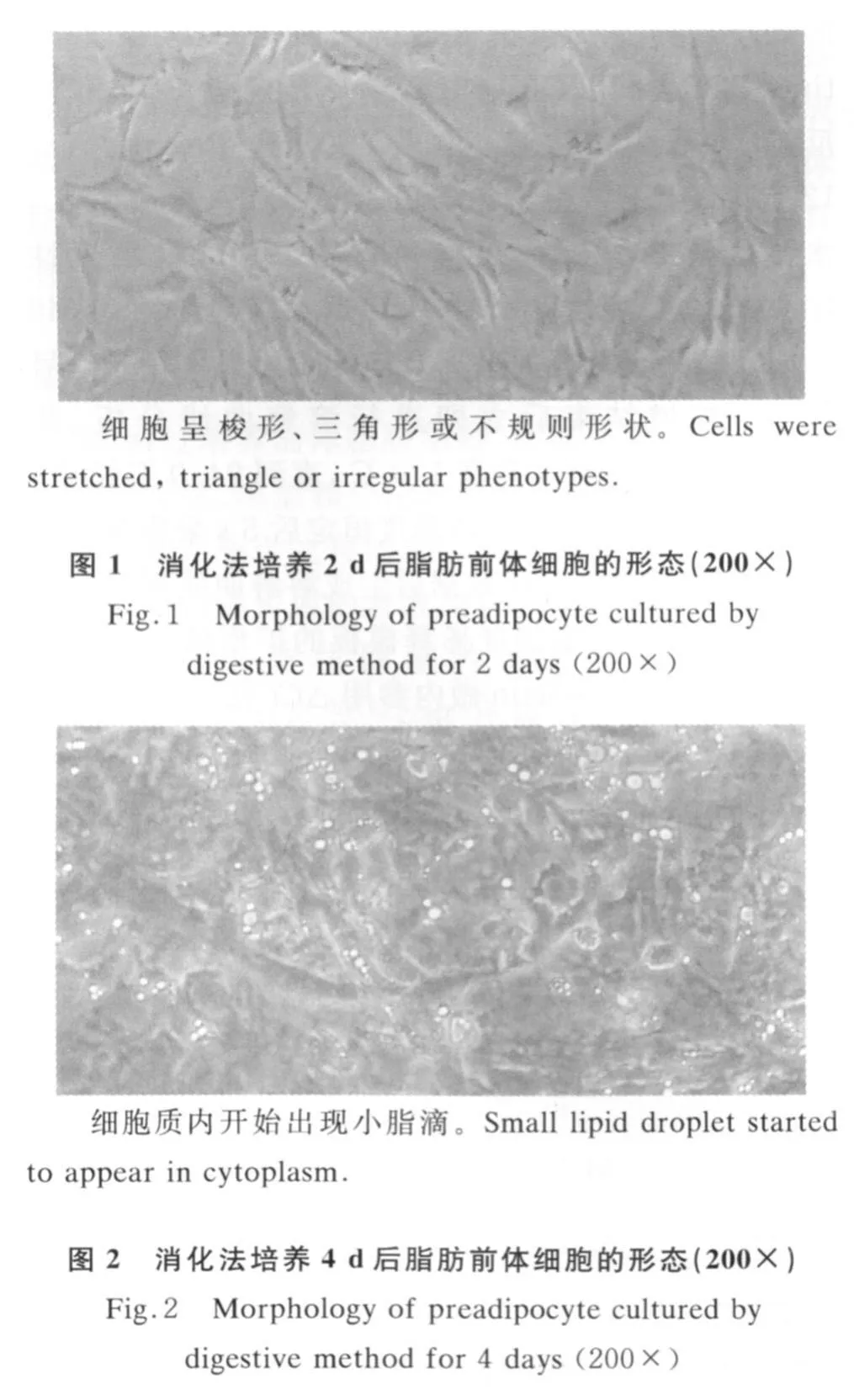

组织块法培养绵羊前体脂肪细胞,4 d可观察到组织块边缘游离出少量梭形或不规则形成纤维样细胞(图5),6 d左右大量增殖,围绕脂肪块呈漩涡状排列,并逐渐形成局部单层汇合,积聚脂肪颗粒(图6)。组织块法培养的前体脂肪细胞分布不均,9 d时部分区域细胞形成汇合,细胞内充满脂滴,而有的区域细胞呈梭形或三角形,处于分裂增殖状态,由于细胞从组织块中游离出的时间不同,细胞增殖和分化不同步(图 7)。经油红O染色的脂肪细胞在显微镜下观察,脂滴被亲脂的油红O着色而呈橘红色,表明具有脂肪细胞的特征(图8)。
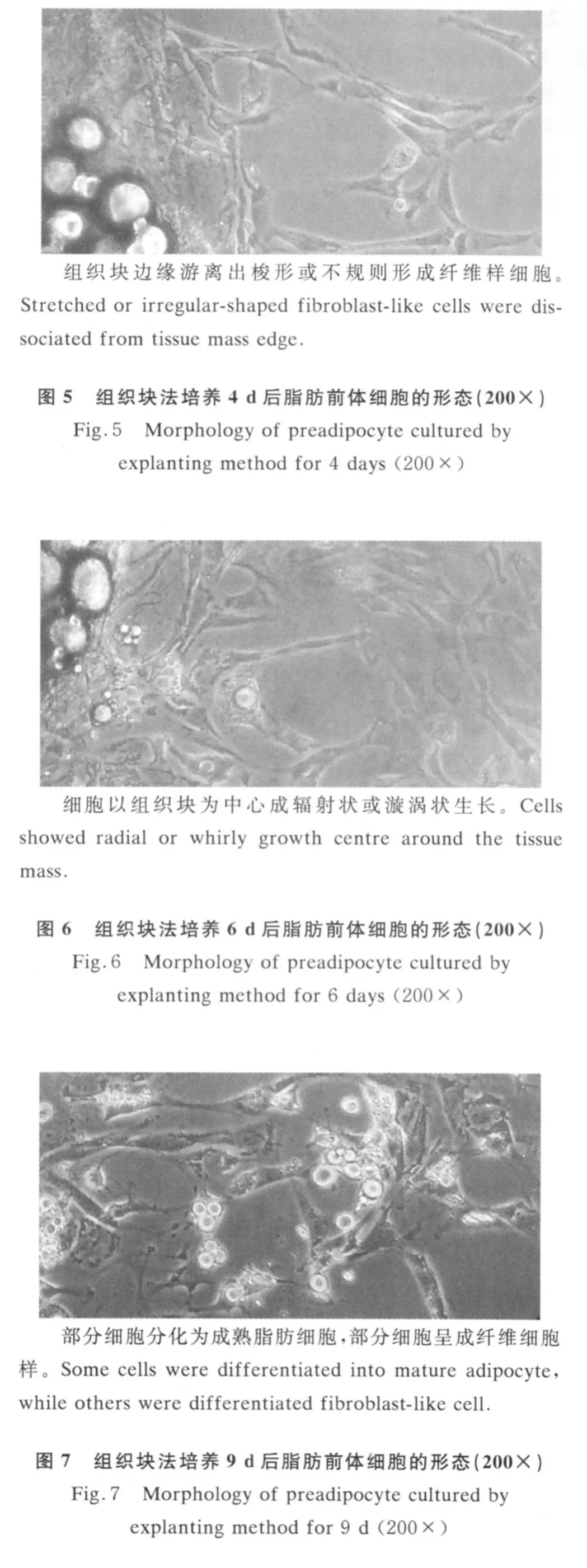
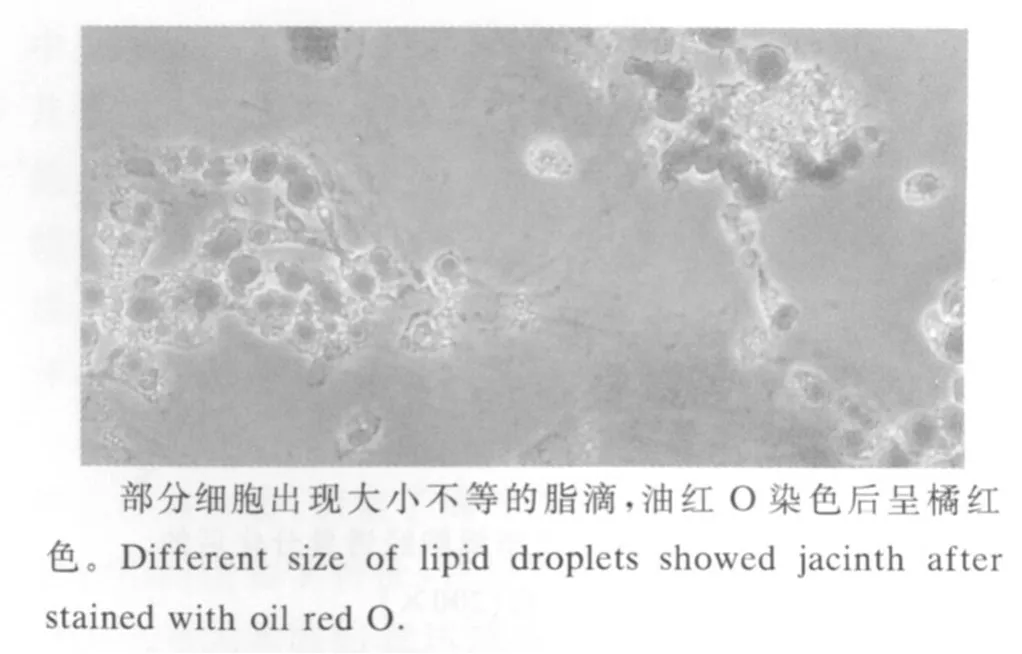
图8 组织块法培养9 d经油红O染色的脂肪前体细胞(200×)Fig.8 Morphology of preadipocyte cultured by explantingmethod and stained with oil red O(200×)
2.2 前体脂肪细胞的传代培养及诱导分化
细胞传代后2 h内贴壁,传代细胞与原代细胞形态一致(图9),增殖速度较原代细胞明显增快,2~3 d即可达到单层汇合。再次传代后细胞自主分化为脂肪细胞的能力逐渐减弱,4代后,几乎没有细胞分化为脂肪细胞,但改用诱导分化培养液培养后,细胞内出现大小不等的脂滴(图10),表明细胞分化能力有所恢复。
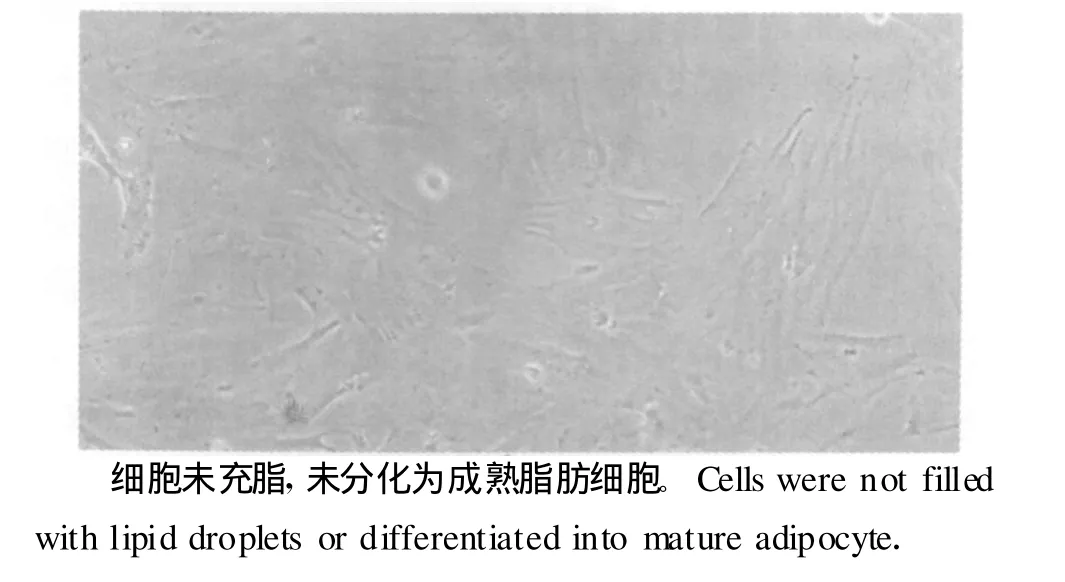
图9 第4代的前体脂肪细胞形态(200×)Fig.9 Morphology of the 4th generation of preadipocy tes(200×)
2.3 M TT比色法绘制生长曲线
由图11可见,曲线呈“S”型,3~9 d为指数生长期,之后便进入平台期。绵羊前体脂肪细胞的倍增时间为54.6 h。
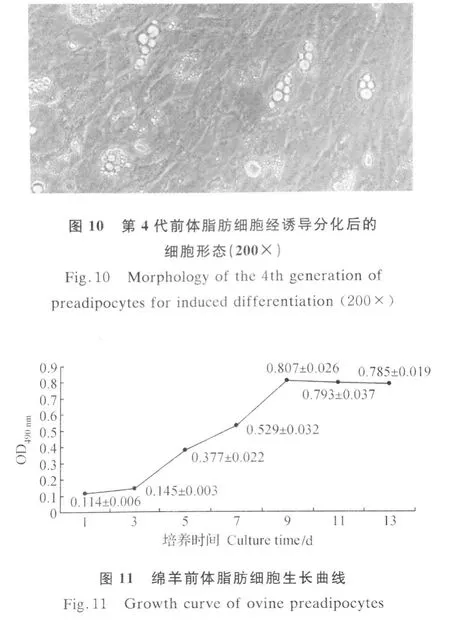
2.4 细胞内脂肪含量的变化
由图12可见,随培养时间增加,细胞内脂肪含量逐渐增加,在原代培养的前3天,几乎见不到脂滴,OD510 nm值接近于 0;培养4 d后,极小部分细胞内出现微小脂滴,OD510 nm值开始上升,细胞内脂滴逐渐沉积,5~11 d期间OD510 nm值呈线性上升,11 d后脂滴沉积速度开始变慢,与形态学观察结果一致。
2.5 前体脂肪细胞分化过程中标志基因表达情况
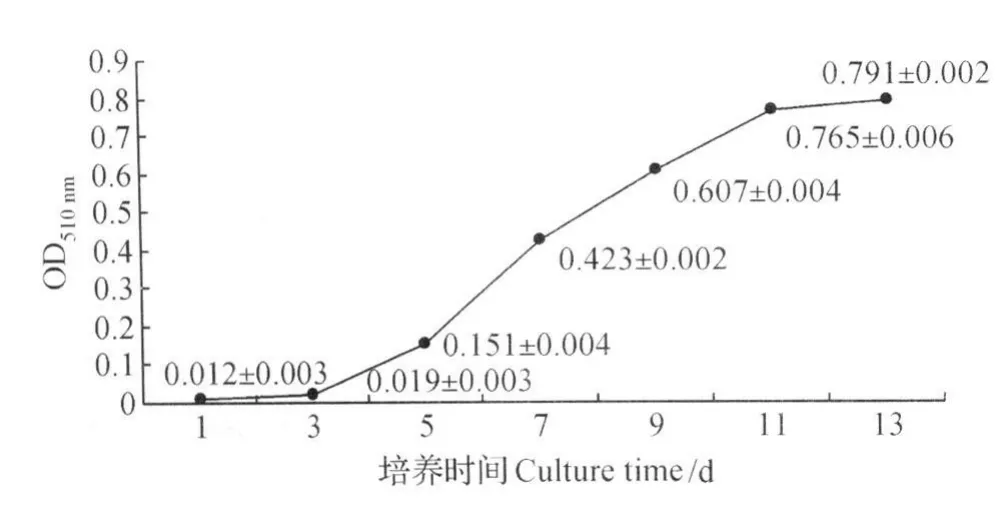
图12 前体脂肪细胞分化过程中细胞内脂肪含量的变化Fig.12 Changes of fat contents in cells during the preadipocy tes dif ferentiation
如图13所示,LPL和PPARγ在前体脂肪细胞分化的早期(培养3 d)就有表达,但显著低于分化中期(7 d)和分化后期(11 d)(P<0.05)。FAS在3 d时表达量极少,到7 d显著增加(P<0.05)并达到最大值,11 d时又显著降低(P<0.05)。
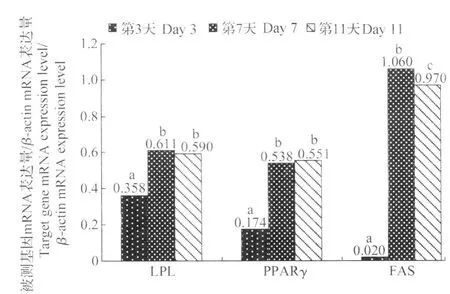
图13 绵羊前体脂肪细胞分化过程中LPL、PPARγ和FAS基因的表达情况Fig.13 LPL,PPARγand FAS gene expression during the ovine preadipocyte differentiation
3 讨 论
3.1 绵羊前体脂肪细胞体外培养体系的构建
细胞体外分离培养是研究复杂的生物系统的重要手段,通过分离培养绵羊前体脂肪细胞,在体外重现增殖分化过程,是研究反刍动物脂肪形成机理的重要途径。本试验通过酶消化法和组织块培养法获得了绵羊前体脂肪细胞。发现组织块培养法具有操作简便、不易污染、成本较低、成功率高等优点,但细胞培养时间较长,获取细胞的数量有限,并且细胞增殖和分化时间不一致,细胞均一性差,不便于试验处理;酶消化法能一次性获取大量的前体脂肪细胞,并且细胞均匀一致,便于试验处理。在原代培养和传代培养中,应用脂肪细胞贴壁时间长、胰蛋白酶消化时间短的特点,进行差速贴壁和差速消化的方法可对其进一步纯化[13],便能得到大量纯度高、均匀一致的前体脂肪细胞。在试验中我们选用消化法进行培养。
细胞体外培养的主要影响因素是培养液和培养环境。培养液的选择上,国内外各个实验室不尽相同,DMEM[5-6]、DMEM/F12[4,7]、M 199 在不同物种的前体脂肪细胞的培养中均有应用,我们对不同的培养液做了预筛选后,因DMEM/F12对绵羊前体脂肪细胞的增殖、分化和脂滴沉积均优于其他培养基,而被采用,这与牛[8]、大鼠[3]、人[4]和草鱼[7]的研究结果一致,而与猪[5]和鸡[6]的不同,这可能是物种之间的差异所致。培养环境与猪[5]、鸡[6]、牛[8]、大鼠[3]和人[4]的前体脂肪细胞一致,37℃、5%CO2及饱和湿度均为最佳条件。
3.2 前体脂肪细胞的增殖和分化
脂肪沉积包括脂肪细胞数目增加和体积增大。前体脂肪细胞增殖、分化为成熟脂肪细胞、甘油三酯的合成以及脂肪细胞的凋亡,是一系列基因和细胞因子调控的结果[14-15]。对脂肪细胞增殖和分化相关基因的研究都是在体外进行的,因此细胞分化的模式也受材料来源、培养基、培养条件等的影响。Ailhaud等[16]认为LPL和PPARγ的表达是脂肪细胞分化的早期标记,LPL的表达预示着脂肪沉积的开始,并且LPL的表达是在细胞汇合时自然发生的,不依赖于脂肪细胞分化所必需的各种介质。在前体脂肪细胞分化的早期,LPL和PPARγ就有表达,但是显著低于分化中期和分化后期,PPARγ在细胞分化后期才达到表达的高峰。PPARγ的主要异构体是脂肪细胞和脂肪组织所特有的,他们在前体脂肪细胞中就能检测到,在加入诱导分化的激素或介质之后表达迅速增加,在成熟的脂肪细胞中达到最高水平[17]。脂肪酸合成酶(FAS)是脂肪酸生物合成的关键酶,在动物体内的表达受激素和营养等方面的因素调控[18],是脂肪细胞晚期分化的分子标志[19],他在前体脂肪细胞中不转录表达,而在分化的脂肪细胞中有较高表达[20],试验中,培养7 d后细胞的FAS的基因表达量显著高于3 d的(P<0.05),这与脂肪沉积的速度相一致。
本试验培养的原代前体脂肪细胞分离自1日龄羔羊的脂肪组织,培养2 d后就能观察到大量梭形、三角形或不规则形状的成纤维细胞样细胞——绵羊前体脂肪细胞。前体脂肪细胞在培养过程中不需要诱导即可自动分化为脂肪细胞。但在传代过程中,这种自动分化能力逐渐减弱,到第4代时几乎观察不到充脂的脂肪细胞,但是加入诱导剂后,又可见部分细胞充脂。并且原代前体脂肪细胞自动分化过程中呈现出聚集现象,即分化为成熟脂肪细胞的大多几个到几十个聚集在一起,很少见到单个分散存在的细胞分化为脂肪细胞,这有可能是分离前体脂肪细胞时部分细胞处于分化期,在体外培养条件下继续分化并分泌有关的激素,通过旁分泌途径诱导相邻细胞的分化,但其具体机制有待进一步研究。
综上所述,本试验建立了绵羊前体脂肪细胞原代培养的方法,探索了绵羊前体脂肪细胞生长、增殖及分化的生物学特征,在体外重现了其增殖的过程,检测了相关基因的表达情况,为进一步研究反刍动物脂肪代谢机理奠定了基础。
4 结 论
①酶消化法和组织块培养法均能培养出绵羊前体脂肪细胞,但酶消化法获得的细胞数目多且均匀一致,更便于试验处理。
②绵羊原代前体脂肪细胞在体外含血清的DM EM/F12培养液中能自行分化为脂肪细胞,在分化中后期 LPL、PPARγ和FAS的基因表达增强。
③本试验初步建立了绵羊前体脂肪细胞原代培养方法,并在体外重现了增殖和分化的过程。
[1] KOPELMAN P G.Obesity as a m edical prob lem[J].Nature,2000,404:635-643.
[2] BILLINGS E,MAY JW.H istorical review and present status of free fat graftauto trans-p lantion in plastic and reconstructive surgery[J].Plastic and Reconstructive Surgery,1989,83(2):368-381.
[3] 孙超.ECM组分和cAMP对大鼠前体脂肪细胞增殖与分化的调控[D].博士学位论文.杨凌:西北农林科技大学,2001.
[4] 王竹晨,刘建中,李燕,等.人前脂肪细胞的原代培养[J].中山医科大学学报,2001,22(6):443-446.
[5] 屈长青,张国华,陈粉粉,等.猪前体脂肪细胞的原代培养[J].农业生物技术学报,2005,13(5):649-653.
[6] YOSH IYUKI M,TSUYOSH I E,KO ICH IRO K.Fatty acids but not dexamethasone are essential inducers for chick adipocyte differentiationin vitro[J].Comparative Biochem istry and Physiology:Part A,2008,151:511-518.
[7] 吉红,曹艳姿,林亚秋,等.草鱼前体脂肪细胞的原代培养[J].水生生物学报,2009,33(6):1226-1230.
[8] 夏成,王哲,牛淑玲,等.犊牛前脂肪细胞的培养及其增殖与分化模型的建立[J].中国兽医科技,2004,34(5):26-30.
[9] 李影,杨公社,卢荣华.原代猪前体脂肪细胞培养方法的优化[J].细胞生物学杂志,2005,27:697-700.
[10] 卢建雄,杨具田,臧荣鑫,等.胰岛素对原代培养大鼠前体脂肪细胞增殖分化的影响[J].中国兽医科学,2006,36(11):915-919.
[11] RAM IREZ J L,M UNOZLEDO F C,HARCUCH W.Quantitation of adipose conversion and trig lycerides by staining intracytop lasm ic lipidswith oil red O[J].H istochem istry,1992,97:493-497.
[12] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[13] VARZANECH F E,SHILLABEER G,WONG K L,et al.Ex tracellular matrix com ponents secreted by m icrovascular endothelial cells stimulate preadipocyte differentiationinvitro[J].Metabolism,1994,43:906-912.
[14] NAKAM URA T,SHIOJIMA S,HIRA I Y,et al.Temporal gene changes during adipogenesis in hum an m esenchym al stem cells[J].Biochem ical and Biophysical Research Comm unications,2003,303:306-312.
[15] HUNGA S C,FANG C,LI C H,et al.Gene expression profiles of early adipogenesis in human mesenchymal stem cells[J].Gene,2004,340:141-150.
[16] AILHAUD G.Early adipocyte differentiation[J].Biochem ical Society Transactions,1996,24:400-402.
[17] WU Z,BUCHER M,FARMER SR.Induction of peroxisome p roliferators-activated recep tor gamm a during the conversion of 3T3 fibroblasts into adipocytes ismeditated by C/EBP beta,C/EBP delta and glucocorticoids[J].Molecular and Cellu lar Biochemistry,1996,16:4128-4136.
[18] 颜新春,汪以真,许梓荣.动物脂肪酸合成酶(FAS)基因表达的调控[J].动物营养学报,2002,14(2):1-4.
[19] ERICSSON J,JACKAON SM,KIM JB,et al.I-dentification of glycerol-3-phosphate acyltransferase as an adipocyte determ ination factor 1 and sterol regulatory element-binding protein responsive gene[J].Journal of Bio logical Chem istry,1997,172:7298-7305.
[20] 卢建雄,刘翊中,臧荣鑫,等.大鼠脂肪细胞分化过程中脂代谢相关基因转录表达时序的研究[J].中国兽医科学,2006,36(4):306-310.
*Correspond ing au thor,p rofessor,E-m ail:w ujp@gsau.edu.cn
(编辑 王智航)
Primary Culture and Differentiation ofOvine Preadipocytes
CAIYong1,2Ayimuguli3YANG Jutian3MA Zhongren3LU Jianxiong3ZANG Rongxin3WU Jianping1*
(1.College of Animal Science and Technology,Gansu Agricu ltural University,Lanzhou730030,China;2.Science Experimen tal Center,Nor thwest University for Nationalities,Lanzhou730030,China;3.College of Life Science and Engineering,Northwest Un iversity for Nationalities,Lanzhou730030,Ch ina)
The study w as conduc ted to set up amethod for prim ary culture of ovine p readipocytes,and p robe them echanism of fat deposition in rum inants.Preadipocyteswere isolated from perinephrit fat of 1-day-o ld ovine and cultured by digestive and exp lantingmethods.Themorphological changes of cultured cellswere observed,growth curvew as determ ined,intracellular fat contents weremeasured by themethod of oil red O staining,and LPL,PPARγand FAS expression levels were analyzed by real-tim e PCR.Results showed as follows:primary cultured cells show ed homogeneous cell components,vigorous proliferation and high differentiation ratio and p resented themorpho logy charac teristics and idiotype genes of p readipocytes.All the resu lts verified their preadipocy te identity.In this paper,amethod for p rimary cu lture of p readipocytesw as successfully set,and the processes of proliferation and dif ferentiation were exhibitedin vitro.[Chinese Journal of Animal Nutrition,2010,22(6):1768-1774]
ovine;preadipocyte;primary culture;differentiation
S826
A
1006-267X(2010)06-1768-07
10.3969/j.issn.1006-267x.2010.06.044
2010-06-29
国家自然科学基金项目(30871811);国家民委科研项目(2009-158-09X B02)
蔡 勇(1979—),男,土家族,湖北宜昌人,讲师,博士研究生,主要从事生物化学和分子生物学研究。E-mail:caiyong1979@163.com
*通讯作者:吴建平,教授,博士生导师,E-mail:w ujp@gsau.edu.cn
