维生素B12在碳纳米管修饰玻碳电极上的电化学行为
2010-04-11金叶玲
陈 静,金叶玲
(淮阴工学院生命科学与化学工程学院,江苏淮安223003)
0 引言
维生素B12(VB12)是生命活动中重要的辅酶,是目前已知的唯一含金属元素的维生素。维生素B12的代谢意义在于它能保持甲硫氨酸的储备,同时提供四氢叶酸参加嘌呤、嘧啶和核酸合成,因此,缺乏维生素B12会影响核酸和某些蛋白的生物合成,以及脂肪酸的代谢。
维生素B12结构简单,其复合环结构(钴啉环,中心原子为钴)非常类似铁卟啉类蛋白的活性中心结构,因此研究它的氧化还原行为对于理解金属卟啉类蛋白或酶的结构与生物功能之间的关系具有很大的帮助。电化学模拟用于阐明维生素B12的一些生化反应具有很大的优势。文献表明,固定良好的维生素B12中的Co能在Co(III),Co(II)和Co(I)之间进行转换,并获得良好的催化性能。Rusling等和Zagal等都曾以维生素B12为催化剂,用于生物分子的电催化。维生素B12能催化有机卤化物的脱卤反应,催化分子氧、胱氨酸和半胱氨酸、联氨、硫醇、谷胱甘肽和一氧化氮的还原反应,或核酸的合成反应。因为固定材质和固定方法对维生素B12的催化活性有很大的影响,所以各种修饰材料,如硅基材料、碳糊、溶胶-凝胶和其他电极修饰材料,和各种固定方法,如吸附法、电聚合反应固定和包埋等方法逐渐被提出。
碳纳米管拥有良好的导电性、化学稳定性、机械性能和生物亲和性,是制作酶修饰电极的良好固定材料。碳纳米管高的比表面积能够增加蛋白质键合的位点;碳纳米管良好的机械稳定性和弹性可以避免修饰膜的破裂;经纯化或截断处理过的碳纳米管表面会带上-OH,-COOH和 C=O基团,能有效改善电极表面的电子传递能力,合适的亲水性能给其固定的蛋白质提供良好的微环境以保持高的生物催化活性。本文报道 VB12在CNT/GC电极表面固定及其直接电化学。实验表明,固定在CNT/GC电极表面的VB12能进行有效和稳定的直接电子转移,并能保持良好的生物电催化活性。
1 实验部分
1.1 试剂
维生素B12购自Sigma公司。短多壁碳纳米管(直径:30-50nm,长 <600nm,纯度 >95%)购自于成都有机化工厂(中国,成都),其它试剂为分析纯,溶液均用二次蒸馏水配制。支持电解质为0.1 mol/L的磷酸盐缓冲液,由 KH2PO4和 H3PO4配制。不同浓度的H2O2溶液均由30%的H2O2溶液用0.1 mol/L的PBS缓冲溶液稀释得到。将碳纳米管配制在二次蒸馏水中,超声处理使之形成浓度为2 mg/mL无明显沉降的悬液,每次实验前均提前再超声30 min备用。
1.2 维生素B12在CNT/GC电极上的固定
玻碳电极(GC,直径为3 mm)先在6号砂纸上磨光,依次用 0.3、0.05 μm 的 Al2O3粉抛光至镜面,并用二次蒸馏水冲洗干净,依次在无水乙醇和二次蒸馏水中超声清洗各2 min,备用。
以微量进样器取25 μL碳纳米管分散液和5 μL VB12(5 mg/mL)溶液充分混合,取混合液置于上述经抛光处理后的玻碳电极表面上,将室温下凉干的电极放入0.1 mol/L的 PBS缓冲液中浸泡5分钟,以脱除没有吸附的VB12,即得VB12-CNT/GC修饰电极。如不立即使用,将电极保存在4℃冰箱中。用同样的方法可得CNT/GC电极和VB12/GC电极。
1.3 电化学实验
电化学实验在兰力科电化学分析系统上(天津)进行,采用三电极体系,VB12-CNT/GC电极为工作电极,饱和甘汞电极(SCE)为参比电极,螺旋铂丝为对电极。所有实验均在25±2℃下进行。
2 结果与讨论
2.1 维生素B12在CNT/GC电极上的直接电化学
图1a和图1b分别为GC电极和VB12/GC电极在0.1 mol/L PBS(pH 5)中于0.1 V/s时的循环伏安曲线,由图可知,在实验的电位扫描范围内,GC电极和VB12/GC电极上均没有可观察到的电化学反应发生。CNT/GC电极(图1c)在-50 mV处有一对很宽的氧化还原峰,该对峰可归属于碳纳米管表面的含氧基团;CNT/GC电极具有比GC电极大得多的充电电流,这是因为CNT/GC电极具有比玻碳电极更大的表面积所致;CNT/GC电极经多次循环扫描,其伏安曲线几乎没有变化,这说明CNT在GC电极表面是很稳定的。图1d是VB12-CNT/GC 电极在0.1 mol/L PBS(pH 5)中的循环伏安曲线,它有两对稳定的氧化还原峰。比较图1d和图1c可以得出,图1d中的氧化还原峰是由VB12发生直接电子转移反应所产生的伏安峰。
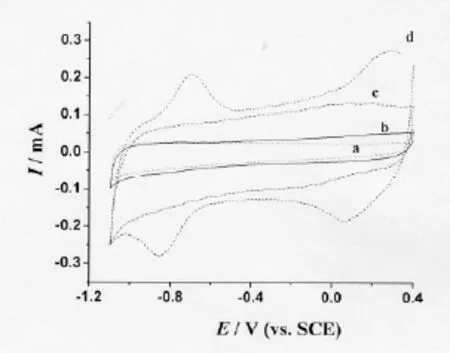
根据文献报道,固定良好的维生素B12中的Co能在Co(III),Co(II)和 Co(I)之间进行转换,初步判断该两对峰分别归属于Co(III)和 Co(II),Co(II)和Co(I)之间转换:
0.174 V 处:Vitamin B12(Co III)+e-≒ Vi-tamin B12(Co II)
0.775 V 处:Vitamin B12(Co II)+e-≒ Vitamin B12(Co I)
由图1可知,100 mV/s时,VB12直接电子转移的两对氧化还原峰电位分别为:Epa(1)=–0.716 V,Epc(1)= –0.834 V,EO'(1)= –0.775 V;Epa(2)=0.253 V,Epc(2)=0.094 V,EO'(2)=0.174 V,均为准可逆过程,这些值与文献报道的VB12的式量电位非常相近。CNT促进VB12的直接电子转移的能力可能与其纳米尺寸及其导电性能有关外,更重要可能来自CNT表面含氧基团的作用,如羧基、羟基和羰基等,这些基团在CNT的纯化过程中因氧化引入。已有文献报道CNT催化细胞色素c和NADH的电化学氧化与CNT表面含氧基团有关。
2.2 扫速的影响
图2是VB12-CNT/GC电极在0.1 mol/L PBS中于不同扫速时的循环伏安曲线。
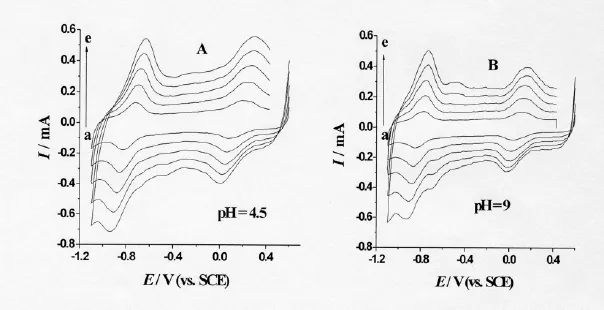
图2 VB12-CNT/GC电极在0.1 mol/L PBS
由图2可知,低扫速时(v<100 mV/s﹚,VB12的直接电子转移反应的两对氧化还原峰(0.17V和–0.775 V附近)的氧化峰电流和还原峰电流均几乎相等,即ipa/ipc=1,并且峰电流ip与扫描速率v有线性关系,说明整个电极过程是受表面过程控制的。随着扫描速率的增加,氧化峰电位Epa向正方向移动,还原峰电位Epc向负方向移动,峰位差增加,但式量电位几乎不随扫速的增加而发生变化(在10 -100 mV/s范围内,EO'(1)=0.173±0.003 V;EO'(2)= -0.773 ± 0.004 V)。
由图2还可以看出,在pH=9的缓冲液中,随着扫速的增加(>100mV),在 -0.4 V和 -0.6 V处均逐渐长起一对峰,但-0.6 V处更明显,且其还原电流均明显大于氧化电流,表明有催化还原电流存在。当溶液pH=4.5时,上述两对峰的氧化峰基本消失,而对应于Co(II)→Co(III)的0.253处的氧化峰增大;与此同时,分别对应于Co(II)→Co(I)和Co(III)→Co(II)的–0.834 V和0.094 V处的还原峰的峰电流增大,如pH 4.5时,-0.834 V处的还原电流比pH 9时的要大136微安,表明酸性条件更有利于催化反应。实验发现如实验前充分通氮除氧,该两处的峰则均不出现,而当以空气饱和后,则该两处的峰重新出现,所以实验初步将此两处的峰分别归属如下:

因为CNT/GC电极在同样条件下没有出现这两对峰,所以VB12的促进作用可能是这两对峰出现的重要原因。鉴于该两处均存在明显的还原电流,所以VB12应对上述可逆反应中的还原反应有催化作用。Lin等在pH 3的条件下仅观察到上述两对峰的还原峰,与本实验中pH 4.5时的实验结果相似。
2.3 pH 的影响
图3是VB12-CNT/GC电极在不同pH值的0.1mol/L PBS缓冲溶液中的循环伏安图。循环伏安实验表明,两对峰的峰电位差均随pH的减小而增加(0.17V和– 0.775 V附近),这可能是因酸性条件下存在较强的催化还原,致使低pH下的峰电位差相对较大;随着缓冲溶液的pH值增加,氧化和还原峰均向负方向移动,但VB12直接电子转移反应的式量电位受pH的影响较小(移动仅为:7 mV/pH)。上述结果表明VB12在CNT/GC电极表面的直接电子转移反应为无质子参与过程;但是因pH的改变会改变VB12活性中心的外界微环境,从而也会影响其直接电子传递行为,表现为其式量电位的变化。
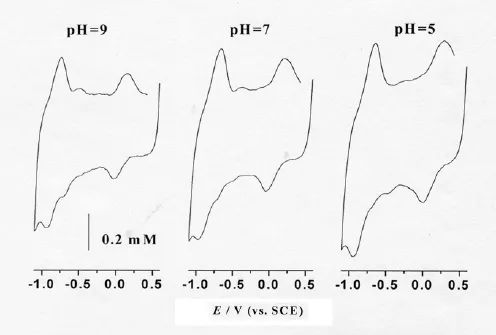
图3 VB12-CNT/GC电极在0.1 mol/L PBS中的循环伏安曲线pH 分别为 5.0,7.0 ,9.0,扫速为 200 mV/s
实验还发现,随着pH增加,催化还原电流减小,进一步印证3.2中的结论—VB12催化的反应为质子参与反应。
2.4 维生素B12-CNT/GC电极对过氧化氢的电催化还原
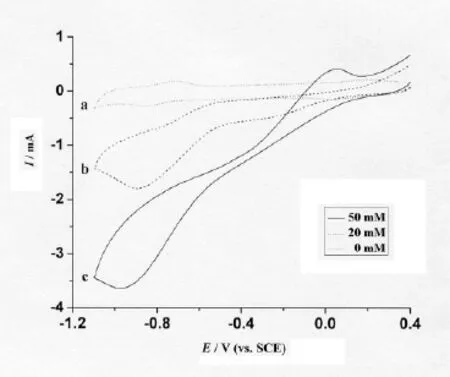
图4 VB12-CNT/GC电极在含不同浓度H2O2的0.1 mol/L PBS(pH 5)中的循环伏安曲线H2O2的浓度分别为(a)0(b)20(c)50 mmol/L,扫速为100 mV/s
为了考查VB12-CNT/GC电极对过氧化氢的 电催化还原行为,分别在含和不含 H2O2的0.1 mol/L的PBS缓冲溶液中进行循环伏安扫描。催化实验结果如图4所示,a为VB12-CNT/GC电极在不含H2O2的0.1 mol/L PBS(pH=5)中的循环伏安曲线,在实验的电位扫描范围内为直接电子转移的两对氧化还原峰;b为向0.1 mol/L的PBS溶液(pH=5)中加入20 mmol/L H2O2后的VB12-CNT/GC电极的循环伏安曲线,可以看到两对氧化峰完全消失,还原峰电流增加很大,该电流应为VB12-CNT/GC电极对H2O2的催化还原电流。c为向0.1 mol/L的PBS溶液(pH=5)中加入50 mmol/L H2O2后的VB12-CNT/GC电极的循环伏安曲线,可以看到催化电流更大。以上实验结果表明,固定在碳纳米管上的Vb12不仅可以进行直接电子转移反应,还可以保持其生物催化活性,有效催化H2O2的电化学还原。
VB12-CNT/GC电极的催化实验表明,固定的VB12对过氧化氢具有灵敏的催化响应,催化电流随H2O2的浓度增大而增加(如图5所示)。H2O2浓度在4 × 10-5mol/L~4.5 × 10-2mol/L 范围内时,VB12催化还原电流与H2O2浓度有良好的线性关系,见图5中的插图。
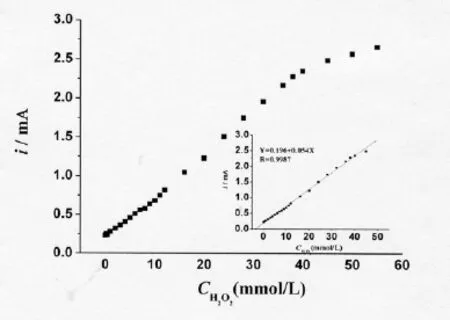
2.5 维生素B12-CNT/GC电极稳定性
六根VB12-CNT/GC电极对20 mmol/L H2O2响应的氧化电流平均值为1.23±0.06 mA,说明VB12-CNT/GC电极具有良好的重现性。将VB12-CNT/GC电极保存在缓冲溶液,定期取出考察H2O2在VB12-CNT/GC电极上的氧化峰电流随保存时间的关系,结果表明,第二天电极的氧化峰电流下降为第一天的93%,22天后其氧化电流仍可保持第一天时的74%。以上实验结果说明,VB12-CNT/GC电极具有较好的催化稳定性和储存稳定性良好。
3 结论
维生素B12在CNT/GC电极表面能进行有效、稳定的直接电子转移,其循环伏安曲线上表现出两对氧化还原峰,式量电位EO'几乎不随扫速(至少在10~100 mV/s的扫速范围内)而变化,其平均值分别为(0.173 ± 0.004)V 和(-0.773 ± 0.004)V(VS.SCE),pH与式量电位的关系表明VB12在CNT/GC电极表面的直接电子转移反应为无质子参与过程。进一步的实验结果表明固定在CNT/GC电极上的维生素B12能保持其对H2O2还原的高催化活性。
[1]Hisaeda Y,Nishioka T,Inoue Y,et al.Electrochemical reactions mediated by vitamin B12 derivatives in organic solvents[J].Chem.Rev.,2000(198):21 -37.
[2]Banerjee R.Chemistry and Biochemistry of B12[M].New York:Wiley,1999:1948 -1998.
[3]Darbre T,Siljegovic V,Amolins A,et al.Novel Trends in Electroorganic Synthesis[J].Springer- Verlag,Tokyo,1998:395 -397.
[4]Darbre T,Zheng D,Fraga R,et al.Immobilization of Vitamin B12 onto solid electrodes by electropolymerization of a catalyst- modified monomer,Electrochem[J].Soc.Proc.,2000(15):53 -55.
[5]Zheng D,Darbre T,Keese R J.Methanol and dimethylaniline as methylating agents of Co(I)corrinoids under acidic conditions[J].Inorg.Biochem,1999(73):273 -275.
[6]Wedemeyer C E,Darbre T,Keese R.A Model for the Cobalamin- Dependent Methionine Synthase[J].Chim.Acta.,1999(82):1173 -1184.
[7]Njue C K,Nuthakki B,Vaze A,et al.Vitamin B12-mediated electrochemical cyclopropanation of styrene[J].Electrochem.Commun,2001(3):733-741.
[8]Shao Y,Mirkin M V,Rusling J F,Liquid/Liquid Interface as a Model System for Studying Electrochemical Catalysis in Microemulsions.Reduction of trans-1,2-Dibromocyclohexane with Vitamin B12 [J].J.Phys.Chem.B,1997(101):3202-3208.
[9]Zagal J H,Aguirre M J,Parodi C G,et al.Electrocatalytic activity of vitamin B12 adsorbed on graphite electrode for the oxidation of cysteine and glutathione and the reduction of cystine.Electroanal[J].Chem.,1994(374):215-221.
[10]Zagal J H,Páez M A.Electro-oxidation of hydrazine on electrode modified with vitamin B12,Electrochim[J].Acta,1997(42):3477 -3485.
[11]Holliger C,Wohlfahrt G,Diekert G.Reductive dechlorination in the energy metabolism of anaerohic bacteria[J].FEMS Rev.,1999(22):383 -398.
[12]McCauly K M,Wilson S R.Synthesis and Characterization of Chlorinated Alkenylcobaloximes To Probe the Mechanism of Vitamin B12-Catalyzed Dechlorination of Priority Pollutants[J].Inorg.Chem.,2002(41):393-404.
[13]Lin M S,Leu H J,Lai C H.Development of Vitamin B12 based disposable sensor for dissolved oxygen[J].Analytica Chimica Acta,2006(561):164 -166.
[14]Ngandu L,Robin D,Kasmi A E,et al.Vitamin B12 -transport protein interaction:Electrochemistry of aque and glutathionnl-cobalamins adsorbed on carbon electrodes;role of the nucleotide chain[J].Chim.Acta,1999(292):204-209.
[15]Borek V,Morra M J.Cyclic voltammetry of aquocobalamin on clay - modified electrodes[J].Environ.Sci.Technol,1998(32):2149 -2153.
[16]Vilakazi S L,Nyokong T.Electrocatalytic properties of vitamin B12 towards oxidation and reduction of nitric oxide[J].Electrochimica Acta,2000(46):453 -457.
[17]Porter M D,Bright T B,Allara D L.Chidsey C.E.D.J.Spontaneously organized molecular assemblies.4.Structural characterization of n-alkyl thiol monolayers on gold by optical ellipsometry,infrared spectroscopy,and electrochemistr[J].Am.Chem.Soc.,1987(109):3559-3566.
[18]Wittkampf M,Chemnitius G C,Cammann K,et al.Silicon thin film sensor for measurement of dissolved oxygen.Sens[J].Actuators B,1997(43):40 -42.
[19]Hu S,J Electroanal.Electrocatalytic reduction of molecular oxygen on a sodium montmorillonite-methyl viologen carbon pastechemically modified electrode[J].Chem.,1999(463),253 -255.
[20]Tavar G,Kalcher K,Ogoreve B.Applicability of a Sol-Gel Derived CeO2-TiO2 Thin Film Electrode as an Amperometric Sensor in Flow Injection[J].Analyst,1997(122):371-376.
[21]Glasspool W,Atkinson J.A screen-printed amperometric dissolved oxygen sensor utilising an immobilised electrolyte gel and membrane[J].Sens.Actuators B,1998(48):308-312.
[22]Choi S H,Ha J,Shin J H,et al.Planar amperometric oxygen sensor with improved preconditioning property[J].Anal.Chim.Acta,2001(431):261 -262.
[23]Otten T,Darbre T,Cosnier S,et al.ChemInform Abstract:Synthesis of Vitamin-B12 Derivatives with an Electropolymerizable Side Chain[J].Chim.Acta,1998(81):1117-1126.
[24]蔡称心,陈静,鲍建春,等.碳纳米管在分析化学中的应用[J].分析化学,2004,32(3):381 -387.
[25]Wang J X,Li M X,Shi Z J,et al.Direct Electrochemistry of Cytochrome c at a Glassy Carbon Electrode Modified with Single - Wall Carbon Nanotubes[J].Anal.Chem.,2002,74(9):1993-1997.
[26]吕亚芬,蔡称心.铁氧化还原蛋白在多壁碳纳米管上的固定、表征及直接电子转移[J].化学学报,2006,64(24):2396-2402.
