H3N8 型马流感血凝素核酸疫苗的初步研究
2010-04-06许莹郭巍王世霞黄文强张璐卢山周建华相文华黄祖瑚
许莹,郭巍,王世霞,黄文强,张璐,卢山,周建华,相文华,黄祖瑚
H3N8 型马流感血凝素核酸疫苗的初步研究
许莹*,郭巍*,王世霞,黄文强,张璐,卢山,周建华,相文华,黄祖瑚
【摘要】
目的研发一种具有良好免疫原性的 H3N8 型马流感血凝素(hemagglutinin,HA)核酸疫苗。
方法根据马 A 型流感病毒 A/Equine/Xinjiang/3/08(H3N8)的 HA 蛋白序列,经密码子优化后化学合成能够表达相应蛋白的基因片段,并将该片段克隆到核酸疫苗载体 pJW4303中,构建带有天然信号肽的 H3HA 核酸疫苗,命名为H3HA/XJ3-08-wt;进一步对 HA 基因进行修饰,以人组织纤维蛋白酶原激活剂(human tissue plasminogen activator,tPA)取代 H3HA 天然信号肽,命名为 H3HA/ XJ3-08-tPA,或切除部分 HA 的基因片段使之只表达 HA 蛋白的胞外域,命名为 H3HA/XJ3-08-dTM。用这 3 种重组质粒分别转染 293T 细胞,蛋白表达经蛋白质印迹检测得到确认。采用电转录法免疫新西兰白兔。ELISA 方法检测免疫后兔血清中抗 H3HA 抗体滴度,血凝抑制实验(hemagglutination inhibition,HI)检测保护性抗体水平。
结果3 种 H3HA 核酸疫苗均可在 293T 细胞中高效表达,并能够在新西兰白兔体内诱导产生特异性抗 H3HA 抗体,HI 检测到不同水平的保护性抗体。其中以 H3HA/XJ3-08-tPA 的免疫原性最强。
结论新构建的 H3N8 型马流感血凝素核酸疫苗具有良好的免疫原性,为此类疫苗的进一步研发奠定了基础。
【关键词】流感病毒 A 型,H3N8 亚型; 血凝素类;疫苗,DNA
www.cmbp.net.cn 中国医药生物技术, 2010, 5(3):196-201
近年来,A 型流感在不同物种中广泛流行,如高致病性禽流感 H5N1、新型猪来源 H1N1 流感等。A 型流感同样在马属动物中频繁爆发。国际上根据流感病毒血凝素(hemagglutinin,HA)和神经氨酸酶(neuraminidase,NA)的不同,将 HA 分成了 16 个亚型,NA 分成 9 个亚型。其中马流感病毒包括 H7N7 和 H3N8 亚型。近 30 年来,H7N7 型马流感病毒未再分离到,而 H3N8 型马流感在世界范围内常有爆发,提示现有疫苗还不能有效地控制该病毒的流行[1-7]。
血凝素分子是流感病毒的主要保护性抗原。研究表明,动物接种流感病毒血凝素 DNA 疫苗后,中和抗体效价很高,并对致死剂量流感病毒攻击的小鼠有完全保护作用[8]。本研究根据马 A 型流感病毒 A/Equine/Xinjiang/3/08(H3N8)[9]的 HA 氨基酸序列,设计并人工合成了能够表达相应蛋白质的基因片段,构建了三种经密码子优化的核酸疫苗,并研究了其免疫原性。本实验为 H3N8 型马流感疫苗的进一步开发研究奠定了良好的基础。
1 材料和方法
1.1 材料
1.1.1 试剂 A/Equine/Xinjiang/3/08 的 HA 基因序列信息由哈尔滨兽医研究所马病研究室提供;H3HA 基因序列经密码子优化后人工合成,由德国Geneart 公司完成;核酸疫苗载体 pJW4303 及293T 细胞由美国马萨诸塞州大学医学院提供;HB101 由本实验室保存;限制性内切酶 BamHI、PstI、NheI 及连接酶购自美国 Promega 公司;HRP标记的羊抗兔抗血清购自联科生物技术有限公司;质粒大量提取试剂盒购自德国 Qiagen 公司;质粒小量提取试剂盒购自大连宝生物工程有限公司;TMB 片剂购自美国 Sigma 公司;West pico 购自美国 Pierce 公司。
1.1.2 实验仪器 水平电泳仪为北京东方特力公司产品;凝胶图象分析系统为美国 Pharmacia 公司产品;U-2001 型紫外可见分光光度计为日本Hitach 公司产品;Model 680 型酶标比色仪、聚丙烯酰胺凝胶电泳仪均为美国 Bio-Rad 公司产品;WJ-2002 活体基因导入仪为宁波新芝生物科技股份有限公司产品。
1.1.3 实验动物 新西兰白兔,雌性,体重 3 kg,由上海斯莱克试验动物有限责任公司提供。
1.1.4 测序公司 上海英骏生物技术有限公司。
1.2 方法
1.2.1 H3HA 核酸疫苗的构建及鉴定 根据马A 型流感病毒 A/Equine/Xinjiang/3/08 的基因序列,经密码子优化后人工合成相应的基因片段。虽然密码子优化后的 HA 基因序列不同于天然 HA基因,但其编码的 HA 蛋白质氨基酸序列不变。在基因片段两端分别引入 PstI 和 BamHI 酶切位点,将经此位点双酶切所得的基因片段克隆到核酸疫苗载体 pJW4303 中,构建了含天然信号肽的H3HA 核酸疫苗,命名为 H3HA/XJ3-08-wt;进一步对 HA 基因进行修饰,以人组织纤维蛋白酶原激活剂(human tissue plasminogen activator,tPA)取代 H3-XJ 天然信号肽或切除部分 HA 基因片段使之只表达 HA 蛋白的胞外域,并在其两端分别引入 NheI 和 BamHI 酶切位点,将经此双酶切所得的基因片段克隆到核酸疫苗载体 pJW4303中,得到另外两种表达 H3HA 蛋白的核酸疫苗,分别命名为 H3HA/XJ3-08-tPA 和 H3HA/XJ3-08-dTM(图 1)。构建的上述核酸疫苗均经过限制性内切酶酶切和测序鉴定。核酸疫苗以及空载体质粒 pJW4303 分别转化大肠杆菌 HB101,经大量扩增后,提取制备高纯度质粒,用生理盐水稀释成1 μg/μl,–20 ℃ 保存备用。

图 1 H3HA 核酸疫苗的设计Figure 1 The design of H3HA DNA vaccines
1.2.2 马流感 H3HA 核酸疫苗的体外表达及检测 将以上构建好的核酸疫苗以及空载体pJW4303 分别用 PEI(polyethylenimine)法转染293T 细胞,转染后 72 h 收集培养上清和细胞裂解液。用 Western blot 法检测马流感 HA 抗原,观察核酸疫苗在真核细胞内表达以及向细胞外分泌的情况。具体步骤如下:灌制 10% SDS-PAGE 电泳胶;取培养上清和细胞裂解液各 20 μl,分别加入 5 μl 的上样 Buffer,煮沸 5 min 后上样,电泳;转膜,100 V,1 h;封闭,5% 脱脂奶粉,4 ℃ 过夜;1% 脱脂奶粉 1∶500 稀释 H3HA/XJ3-08-tPA核酸疫苗的兔免疫血清,室温摇床上慢摇孵育 1 h;PBST 漂洗滤膜 6 次,每次 10 min;1% 脱脂奶粉 1:5000 稀释 HRP 标记的羊抗兔 IgG 抗血清,室温摇床上慢摇孵育 1 h;PBST 漂洗滤膜 6 次,每次 10 min;显影以及定影后观察结果。
1.2.3 动物实验 通过活体基因导入仪进行DNA 免疫。12 只 3 kg 新西兰白兔随机平均分成4 组,分别接受空载体质粒 pJW4303、核酸疫苗H3HA/XJ3-08-wt、H3HA/XJ3-08-tPA 或 H3HA/XJ3-08-dTM 免疫,程序为 0、2、4、8 周各一次,每次每兔四点注射共 200 μg 质粒 DNA(图 2)。注射后立即于注射部位用 WJ-2002 活体基因导入仪进行体内电转染(技术参数:电压 100 V,脉冲次数正反各 6 次,波宽 60 ms,频率 60 Hz),兔腿部肌肉发生抖动视为电转录有效。首次免疫前以及每次免疫后 2 周耳中动脉采血 10 ml,分离血清,–70 ℃ 保存备用。

图 2 实验动物的分组及 H3HA 核酸疫苗免疫程序Figure 2 Rabbits grouping and Immunization schedule for H3HA DNA vaccines
1.2.4 马流感 H3HA 核酸疫苗抗体应答的检测 采用酶联免疫吸附试验(ELISA)间接法检测抗马流感 H3HA 抗体[10]。具体步骤如下:包被抗原:H3HA/XJ3-08-dTM 转染 293T 细胞收获的上清,用 1 × PBS 按照 1∶5 稀释作为抗原包被ELISA 板,100 μl/孔,4 ℃ 过夜;PBST 洗 3 次,5% 脱脂奶粉封闭,200 μl /孔,37 ℃,2 h;PBST洗 3 次,加入 1% 脱脂奶粉 1∶500 稀释的待检血清,100 μl/孔,37 ℃,1 h;PBST 洗 5 次,加入 1%脱脂奶粉 1∶2 000 稀释的生物素标记的羊抗兔IgG;100 μl/孔;37 ℃,1 h;PBST 洗 5 次,加入1% 脱脂奶粉 1∶5 000 稀释的 HRP 标记的链亲和素,100 μl/孔;37 ℃,1 h;PBST 洗 5 次,TMB显色,100 μl/孔,3.5 min。最后用酶标仪检测吸光度值。
1.2.5 血凝抑制试验(HI) 血清处理方法:采用胰蛋白酶-高碘酸盐处理方法,具体如下:加入1/2 体积的胰蛋白酶溶液于 1 体积的血清中,56 ℃灭活 30 min 后取出并冷却至室温。加 3 体积的0.11 mol/L 过碘酸钾,混匀,室温孵育 15 min,其后加 3 体积的 1% 甘油溶液,室温孵育 15 min。最后加 2.5 倍体积的 0.85% 生理盐水并混匀。该处理后血清的终稀释度为 1∶10。胰蛋白酶溶液:将 200 mg 的胰酶溶于 25 ml 0.1 mol/L pH 8.2 的1 × PBS 中,过滤除菌后小量分装,–20 ℃ 保存。
采用血凝抑制实验检测实验动物中 HI 抗体水平。具体步骤如下:标记 96 孔微量板,每孔加25 μl 1 × PBS;第一行每孔加 25 μl 待测血清,混匀(1∶2),最后一孔不加作为对照;吸取第一孔中血清 25 μl 到下一孔,混匀,依次进行倍比稀释(1∶4),以此类推到其他孔,弃掉最后一孔中吸取的 25 μl 液体;每孔加上 25 μl 的 4 单位标准化抗原,22 ℃ 孵育 30 min;每孔加入 50 μl 标准化红细胞,如前混匀,22 ℃ 孵育 30 min;判定并记录结果。阴性对照为免疫前的混合血清。
2 结果
2.1 马流感 H3HA 核酸疫苗的构建及表达
将构建好的质粒测序,结果显示其核酸序列与本研究原先设计的核酸序列完全一致。将 H3HA-wt、H3HA-tPA、H3HA-dTM 转染 293T 细胞 72 h后,获取细胞培养上清和细胞裂解液,以 H3HA-tPA的免疫兔血清行 Western blot 检测。结果显示,所设计的密码子优化后的血凝素基因均有目的蛋白的表达(约 72 kD)。其中 H3HA-dTM 在上清中也能检测到蛋白的表达(约 90 kD),而空载体pJW4303 转染后,细胞培养上清及裂解液中均检测不到 H3HA 蛋白的表达,如图 3 所示。提示H3HA-wt、H3HA-tPA、H3HA-dTM 转染 293T 细胞后均可在细胞内表达,H3HA-dTM 还可以将表达产物分泌到细胞外。
2.2 马流感 H3HA 核酸疫苗的抗体应答
用构建好的马流感 H3HA 核酸疫苗免疫新西兰白兔。结果表明:第 2 次免疫后 2 周,三组核酸疫苗免疫的动物血清中均可检测到特异性抗 H3HA 抗体;第 3 次免疫后 2 周,特异性抗H3HA 抗体水平明显升高。随着免疫次数的增加,H3-tPA 免疫血清特异性抗体水平上升的速度最快,显著高于 H3HA-wt 和 H3HA-dTM 免疫组(P < 0.01)。而 H3HA-wt 和 H3HA-dTM 两组免疫血清,特异性抗体水平上升情况无明显差异。阴性对照组无抗体反应(图 4)。第 4 次免疫后 2 周,三组免疫动物血清中特异性抗 H3HA 抗体的平均滴度分别为:H3HA-tPA 组:1∶56 300;H3HA-wt组:1∶13 500;H3HA-dTM 组:1∶6 500(图 5)。
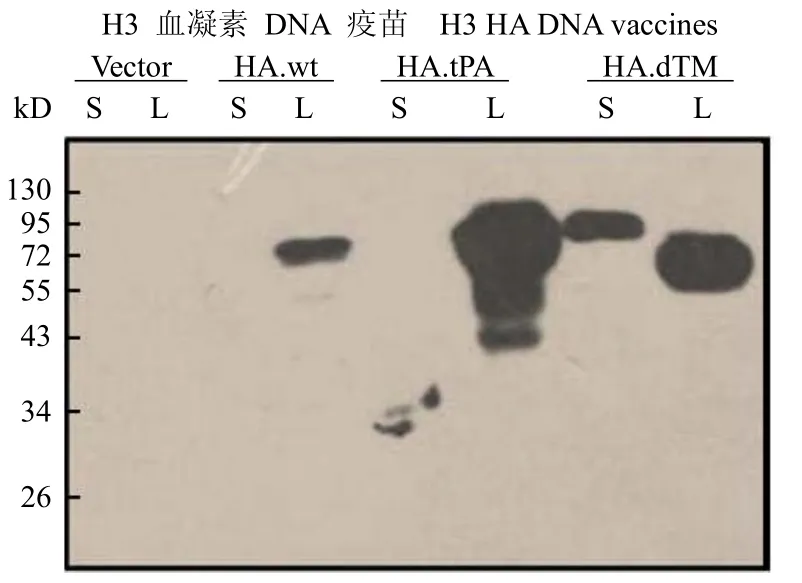
图 3 三种核酸疫苗在 293T 细胞中的表达Figure 3 Transient expression of DNA vaccines in 293T cell line
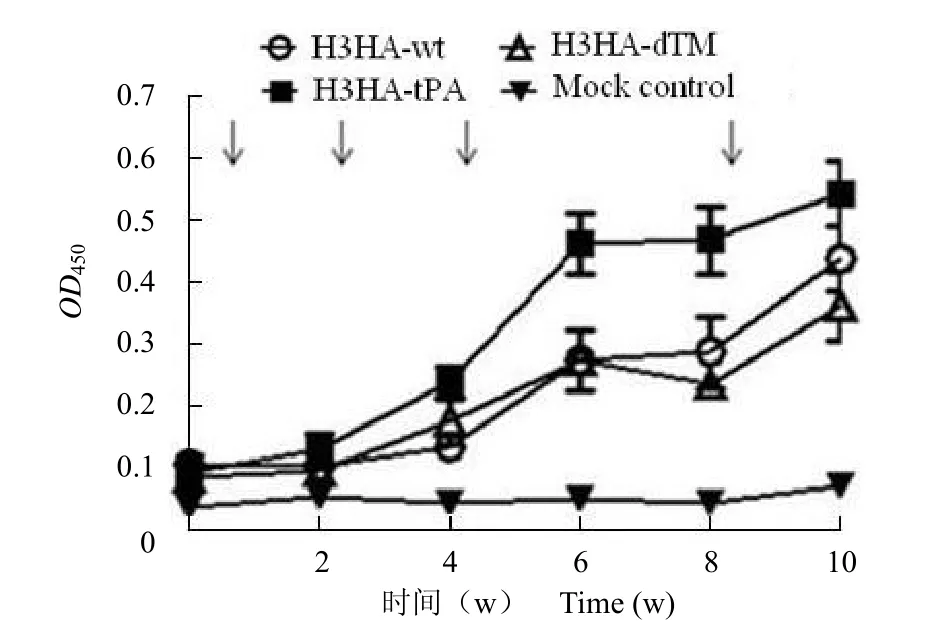
图 4 各组新西兰白兔免疫血清抗 H3HA 抗体水平的动态变化Figure 4 Temporal changes of serum anti-H3HA IgG in different rabbit groups
2.3 免疫动物血清 HI 抗体的检测
血凝抑制试验结果显示:第 4 次免疫后 2 周,各组新西兰白兔均产生了 HI 抗体,其中 H3HA-tPA 组血凝抑制效价最高,达到 1∶320;H3HA-wt组次之,平均血凝抑制效价为 1∶90;H3HA-dTM组血凝抑制效价最低,只有 1∶16。免疫前血清血凝抑制效价小于 1∶8(图 6)。

图 5 各组新西兰白兔免疫血清抗 H3HA 抗体的终点滴度Figure 5 Serum end–point anti-H3HA IgG titers in different rabbit groups
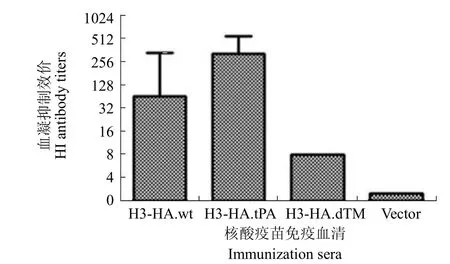
图 6 各组新西兰白兔免疫前后血清 HI 水平Figure 6 Serum HI titers in different rabbit groups
3 讨论
在很多物种中都已经证明,运用 DNA 疫苗免疫可以诱导较强的特异性免疫保护反应。DNA 疫苗因其能够同时激起机体的体液以及细胞免疫而优于传统的灭活疫苗,加上其生产成本低廉、可规模生产、易于保存而具有广泛的市场前景[11-12]。到目前为止,已经有 4 种运用于动物的 DNA 疫苗取得上市许可,分别为运用于马的西尼罗病毒DNA 疫苗、运用于鲑鱼的传染性造血组织坏死病DNA 疫苗、运用于狗的黑色素瘤 DNA 疫苗和降低幼猪致病率及致死率的生长激素释放激素 DNA疫苗[13-14]。
我国的马流感疫苗研究工作相对迟滞。20 世纪 70 年代研制成马流感灭活疫苗,目前国内未见有新疫苗的开发研究。国际上对于 H3N8 马流感疫苗已经进行较为深入的研究,也包括 DNA 疫苗。Soboll 等以马流感病毒 A/equine/Kentuchy/1/81的血凝素基因片段为依据,构建了马流感 HA 核酸疫苗,以基因枪免疫马,共免疫 3 次,多位点注射,间隔 60 d 一次。免疫结束后的同型流感病毒攻毒试验表明,疫苗的保护效果较好[15-16]。证明了HA 核酸疫苗在抗马 H3N8 流感方面的成功运用。在此基础上,我们对 H3HA 基因序列进行了优化和修改,设计了 3 种表达 H3HA 抗原的核酸疫苗。其中以 tPA 组的效果最理想。说明在插入完整H3HA 基因的情况下,以 tPA 信号肽取代原始信号肽后,核酸疫苗在体外的表达增强,免疫原性增强。一般认为血凝抑制效价大于 64 即可产生临床保护[17]。据此标准,tPA 组及 wt 组免疫后产生了具有保护作用的中和抗体,而 dTM 组尽管产生了一定的结合抗体,但未产生中和抗体。在既往H1HA 流感 DNA 疫苗的研究过程中也曾发现:完整的 H1HA 产生中和抗体的能力远远大于去掉跨膜区的 H1HA[18]。可能是去掉跨膜区及胞内区基因的马 H3HA 核酸疫苗在表达成 HA 抗原的过程中分子构象发生改变,或关键抗原表位隐藏、消失或改变,免疫原性降低,不能产生中和抗体。
流感疫苗最大的问题是流感血凝素通过抗原漂移和抗原转换发生频繁的变异,这对于研发广泛适用性的 HA 疫苗增加了难度。香港 1992 年爆发马流感过程中,有 75% 的免疫马不能抵抗感染,英国和意大利等也有过类似报道[2-4]。可见由于病毒的变异,原有疫苗往往不能提供良好的保护力;对于不同谱系的毒株,单价疫苗只能提供有限的保护[19]。解决的方法包括:①根据流行的毒株不断更新现有疫苗;②制成多价疫苗等。Kodihalli 等[20]发现,在 HA1 亚型氨基酸序列同源性有 11% ~13% 差异的变异株致死剂量攻击时,HA DNA 疫苗仍然具有交叉保护性作用。故如采用不同来源的HA 基因制成二价或多价疫苗,可能其免疫后产生的交叉保护性更强,所针对的流感毒株范围更广,效果更好。在后续工作中,我们将着重研究不同毒株 HA 基因制成的多价 DNA 疫苗,期望研制开发出具有较强免疫原性、能够对多种毒株感染产生确切保护的抗 H3N8 型马流感核酸疫苗。
参考文献
[1] Paillot R, Hannant D, Kydd JH, et al. Vaccination against equine influenza: quid novi? Vaccine, 2006, 24(19):4047-4061.
[2] Newton JR, Daly JM, Spencer L, et al. Description of the outbreak ofequine influenza (H3N8) in the United Kingdom in 2003, during which recently vaccinated horses in Newmarket developed respiratory disease. Vet Rec, 2006, 158(6):185-192.
[3] Martella V, Elia G, Decaro N, et al. An outbreak of equine influenza virus in vaccinated horses in Italy is due to an H3N8 strain closely related to recent North American representatives of the Florida sub-lineage. Vet Microbiol, 2007, 121(1/2):56-63.
[4] Powell DG, Watkins KL, Li PH, et al. Outbreak of equine influenza among horses in Hong Kong during 1992. Vet Rec, 1995, 136(21): 531-536.
[5] Barbic L, Madic J, Turk N, et al. Vaccine failure caused an outbreak of equine influenza in Croatia. Vet Microbiol, 2009, 133(1/2):164-171.
[6] Müller I, Pinto E, Santibáñez MC, et al. Isolation and characterization of the equine influenza virus causing the 2006 outbreak in Chile. Vet Microbiol, 2009, 137(1/2):172-177.
[7] Reeve-Johnson L. Equine influenza in Australia. Vet Rec, 2007, 161(18):635.
[8] Deck RR, DeWitt CM, Donnelly JJ, et al. Characterization of humoral immune responses induced by an influenza hemagglutinin DNA vaccine. Vaccine, 1997, 15(1):71-78.
[9] Guo W, Yan Y, Wang YY, et al. Isolation and identification of equine influenza virus in Xinjiang. Chin J Prev Vet Med, 2008, 30(8):584-586, 591. (in Chinese)郭巍, 闫妍, 王英原, 等. 新疆地区一株马流感病毒的分离及鉴定.中国预防兽医学报, 2008, 30(8):584-586, 591.
[10] Guo W, Wang YY, Wang Y, et al. Establishment and application of indirect ELISA for the detection of antibody for equine influenza virus H3N8 subtype. Chin J Prev Vet Med, 2010, 32(3):190-193. (in Chinese)郭巍, 王英原, 王宇, 等. H3N8亚型马流感病毒间接ELISA抗体检测方法建立及应用. 中国预防兽医学报, 2010, 32(3):190-193.
[11] Carvalho JA, Prazeres DM, Monteiro GA. Bringing DNA vaccines closer to commercial use. IDrugs, 2009, 12(10):642-647.
[12] Ledgerwood JE, Graham BS. DNA vaccines: a safe and efficient platform technology for responding to emerging infectious diseases. Hum Vaccin, 2009, 5(9):623-626.
[13] Kutzler MA, Weiner DB. DNA vaccines: ready for prime time? Nat Rev Genet, 2008, 9 (10):776-788.
[14] Salonius K, Simard N, Harland R, et al. The road to licensure of a DNA vaccine. Curr Opin Investig Drugs, 2007, 8(8):635-641.
[15] Lunn DP, Soboll G, Schram BR, et al. Antibody responses to DNA vaccination of horses using the influenza virus hemagglutinin gene. Vaccine, 1999, 17(18):2245-2258.
[16] Soboll G, Horohov DW, Aldridge BM, et al. Regional antibody and cellular immune responses to equine influenza virus infection, and particle mediated DNA vaccination. Vet Immunol Immunopathol, 2003, 94(1/2):47-62.
[17] Mumford JA, Wood J. Establishing an acceptability threshold for equine influenza vaccines. Dev Biol Stand, 1992(79):137-146.
[18] Wang S, Taaffe J, Parker C, et al. Hemagglutinin (HA) proteins from H1 and H3 serotypes of influenza A viruses require different antigen designs for the induction of optimal protective antibody responses as studied by codon-optimized HA DNA vaccines. Virol, 2006, 80(23): 11628-11637.
[19] Yates P, Mumford JA. Equine influenza vaccine efficacy: the significance of antigenic variation. Vet Microbiol, 2000, 74(1/2):173-177.
[20] Kodihalli S, Haynes JR, Robinson HL, et al. Cross-protection among lethal H5N2 influenza viruses induced by DNA vaccine to the hemagglutinin. J Virol, 1997, 71(5):3391-3396.
ObjectiveTo develop a higly immunogenic DNA vaccine against equine influenza H3N8.
MethodsAccording to the amino acids sequence of HA antigen from equine influenza A strain A/Equine/Xinjiang/3/08 (H3N8), a codon optimized H3HA genes was chemically synthesized. It was then subcloned into vector pJW4303 to express the wild type HA insert (H3HA /XJ3-08-wt). The codon optimized HA gene was further modified to either replace the original HA leader sequence with a human tissue plasminogen activator (tPA) leader (H3HA /XJ3-08-tPA) or truncate the HA coding sequence to express only the extracellular portion of the HA protein (H3HA/XJ3-08-dTM). The expression of the above three HA DNA vaccines was verified in 293T cells by Western blot analysis. New Zealand White rabbits were vaccinated with three versions of HA DNA vaccines or vector individually by electroporation. H3HA specific antibody responses in rabbit sera were analyzed by ELISA and the protective antibody activities were measured by HI against equine H3N8 virus.
ResultsThe H3HA DNA plasmids could express HA antigen successfully in 293T cells in vitro, and induced high level protective anti-H3HA antibody. Among three H3HA DNA vaccines, HA DNA vaccine design with a tPA leader showed the best immunogenicity.
ConclusionOptimal HA DNA vaccines against H3N8 equine influenza have been successfully constructed, affording a new way to develop equine H3N8 vaccine in the future.
【Key words】Influenza A virus, H3N8 subtype; Hemagglutinins; Vaccines, DNA
Author Affiliations: Department of Infectious Diseases, and China-US Vaccine Research Center, The First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China (XU Ying, WANG Shi-xia, ZHANG Lu, LU Shan, HUANG Zu-hu); Division of Livestock Infectious Diseases, State Key Laboratory Veterinary Biotechnology, Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Harbin 150001, China (GUO Wei, HUANG Wen-qiang, ZHOU Jian-hua, XIANG Wen-hua); Department of Internal Medicine, Umiversity of Massachusetts Medical School, Worcester 01605, America (WANG Shi-xia, LU Shan)
*第一、二作者同等贡献
Corresponding authors:XIANG Wen-hua, Email: xiangwenhua1@yahoo.com.cn; HUANG Zu-hu, Email: huangzh@jswst.gov.cn www.cmbp.net.cn Chin Med Biotechnol, 2010, 5(3):196-201
基金项目:黑龙江省自然科学基金重点项目(ZD200812);兽医生物技术国家重点实验室基本科研业务费项目(NKLVBP200815);江苏省自然科学基金(BK2006728)
作者单位:210029 南京医科大学第一附属医院感染病科/江苏省人民医院中美疫苗中心(许莹、王世霞、张璐、卢山、黄祖瑚);150001 哈尔滨,中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室大动物病研究室(郭巍、黄文强、周建华、相文华);01605 渥斯特,美国麻省大学医学院内科学系(王世霞、卢山)
通讯作者:相文华,xiangwenhua1@yahoo.com.cn;黄祖瑚,Email:huangzh@jswst.gov.cn
收稿日期:2010-01-18
DOI:10.3969/cmba.j.issn.1673-713X.2010.03.007
The optimization of HA DNA vaccines against equine H3N8 influenza
XU Ying, GUO Wei, WANG Shi-xia, HUANG Wen-qiang, ZHANG Lu, LU Shan, ZHOU Jian-hua, XIANG Wen-hua, HUANG Zu-hu
【Abstract】
