胰腺癌转移相关基因 C14orf166 的真核表达及其蛋白相互作用的蛋白质组学筛选
2010-04-06张登禄韩金祥崔亚洲周小艳
张登禄,韩金祥,崔亚洲,周小艳
胰腺癌转移相关基因 C14orf166 的真核表达及其蛋白相互作用的蛋白质组学筛选
张登禄,韩金祥,崔亚洲,周小艳
【摘要】
目的旨在对胰腺癌转移相关基因 C14orf166 进行真核重组表达,并在此基础上结合蛋白质组学方法初步筛选其相互作用蛋白,为进一步研究 C14orf166 在肿瘤转移中的作用提供研究基础。
方法构建人 C14orf166 的带双标签的真核表达载体pcDNA3.1-Flag-C14orf166-His,通过脂质体将其转染至人胚肾 293T 细胞。采用 Ni-agrose 进行 His 标签蛋白的pull-down 纯化,分离 C14orf166 的蛋白结合复合体,对蛋白混合物进行 SDS-PAGE 分析,选择差异条带,进行MALDI-TOF-TOF 质谱鉴定。
结果在 293T 细胞中重组表达了 C14orf166 蛋白,对C14orf166 蛋白复合体进行分离鉴定后,筛选出 RS8、EFCB9 和 NRAP 3 个可能与 C14orf166 相互作用的蛋白。
结论基因重组表达结合 pull-down 和蛋白质组学方法可以发现新的相互作用蛋白,为进一步了解 C14orf166 在肿瘤发病机制中的作用提供了新的线索。
【关键词】胰腺肿瘤; 蛋白质组学; 基因表达
www.cmbp.net.cn 中国医药生物技术, 2010, 5(3):186-190
C14orf166 蛋白相对分子量约为 26 kD,广泛存在于人体各组织中[1]。我们在前期研究中通过定量蛋白质组学的方法首次发现 C14orf166 在转移的胰腺癌中高表达[2],近期有研究进一步支持C14orf166 可能参与了胰腺癌的发病过程,但其机制尚不清楚[3]。
本研究通过基因转染的方法在真核细胞中表达带标签的 C14orf166 重组蛋白,然后采用pull-down 的方法获得 C14orf166 蛋白及其相互作用蛋白的复合物,再利用蛋白质组学的方法对蛋白复合体进行成分鉴定,以期发现新的 C14orf166的相互作用蛋白,为进一步研究其促转移机制提供研究基础。
1 材料与方法
1.1 材料
实验所需大肠杆菌菌株 DH5α 和质粒pcDNA3.1(-) 均为本实验室保存;DMEM 培养基购自美国 Gibco 公司;限制性内切酶 Nhe I、Xho I、T4 连接酶、RT-PCR 试剂盒均购自日本 Takara公司;Protein A and G agrose 及鼠源的 His 标签抗体均购自德国默克公司;兔源的 C14orf166 单克隆抗体购自美国 Aviva 公司;鼠源的 β-actin 抗体购自美国 Abcam 公司;山羊抗鼠二抗和山羊抗兔二抗购自北京中衫金桥生物技术有限公司;Lipofectamine2000 购自美国 Invitrogen 公司;Ni-agrose 购自北京康为世纪生物科技有限公司。
293T 细胞株系本实验保存,用含 10% 胎牛血清的 DMEM 培养基培养,置于 37 ℃,5% CO2培养箱中,常规消化传代。
1.2 实验方法
1.2.1 从胰腺癌 Panc-1 细胞中克隆 C14orf166基因 Trizol 法从胰腺癌 Panc-1 细胞中提取总RNA 做为模板。利用 RT-PCR 试剂盒扩增C14orf166 基因核心编码区。上游引物:5’ GTGATG ATGACGATAAGTTCCGACGCAAGTT 3’,下游引物:5’ GGCATGATGATGGTGATGTCATCTTCCAA CT 3’,扩增片段长度约为 750 bp。然后利用 PCR的方法引入酶切位点(Nhe I 和 Xho I)和标签(Flag和 His)。上游引物:5’ CGCTAGCATGGATTACAA GGATGATGACGAT 3’,下游引物:5’ GCCTCGAGT TAATGATGATGATGGTGATGCAG 3’。PCR 反应条件:94 ℃ 预变性 5 min,94 ℃,30 s;59 ℃,45 s;72 ℃,90 s;循环 39 次。反应完毕,取 PCR产物进行 1% 琼脂糖凝胶电泳,紫外灯下观察结果。1.2.2 C14orf166 重组载体的构建、转化扩增及鉴定 用 Nhe I 和 Xho I 分别对 C14orf166 基因和pcDNA3.1(-) 进行双酶切,酶切片段经琼脂糖电泳回收后经 T4 连接酶连接后转化入感受态大肠杆菌 DH5α,挑取阳性单克隆,在含氨苄西林的 LB培养液(100 μg/ml)中摇菌培养过夜,离心收集菌体,提取质粒。利用 Nhe I 和 Xho I 双酶切验证。同时将质粒送 Invitrogen 公司测序。将构建好的重组质粒命名为 pcDNA3.1- Flag-C14orf166-His。
1.2.3 细胞转染 参照 Invitrogen Lipofectamine 2000 说明书进行操作,将 pcDNA3.1-Flag-C14orf166-His 和 pcDNA3.1 分别转染 293T 细胞。
1.2.4 Western-blot 检测 C14orf166 蛋白的表达 细胞转染 48 h 后,离心收集细胞,用非变性细胞裂解液(1% NP-40,1 mmol/L EDTA,50 mmol/L KCl,20 mmol/L HEPES-KOH,pH 7.8)冰上裂解30 min,超速离心(13 000 × g)提总蛋白。Bradford法测蛋白浓度。每孔上样量 40 μg。采用 12.5% 的SDS-PAGE 胶分离蛋白,将目的条带转到 NC 膜上 ECL 显色,以 β-actin 作为内参验证蛋白含量。
1.2.5 pull-dwon 实验 细胞转染(参照说明书)48 h 后,离心收集细胞(约 107个),非变性裂解液(配方同上)冰上裂解 30 min,超速离心(13 000 × g)提总蛋白,Bradford 法蛋白定量,用结合缓冲液(Tris-HCl 7.9,10 mmol/L咪唑,0.5 mol/L NaCl)稀释蛋白浓度至 2 mg/ml 左右;加 Protein A and G agrose 去除非特异性,加 Ni-agrose 100 冰上缓缓摇动 30 min 以上,450 × g 离心 5 min,收集沉淀,用结合缓冲液洗 3 次;加 40 μl 洗脱液(Tris-HCl 7.9,500 mmol/L 咪唑,0.5 mmol/L NaCl)和 10 μl SDS上样 buffer,煮沸 3 min。
1.2.6 SDS-PAGE 制 12.5% 的 SDS 聚丙烯酰胺凝胶;每孔上样 20 μl;电泳完毕之后,考马斯亮蓝法染色,比较空转组和转 C14orf166 组的差异条带。
1.2.7 胶内酶解和 MALDI-TOF-MS/MS 鉴定 将 7 个差异条带从凝胶上切割下来,用脱色工作液(50 mmol/L NH4HCO3和乙腈 1∶1 用前混合)37 ℃ 水浴脱色,乙腈脱水直至胶块变为白色。用 0.2% DTT 还原,1% 的 IAA 氨基化,乙腈脱水。再用 10 μg/μl 胰酶(trypsin)37 ℃ 水浴酶解过夜。用萃取液(50 % 乙腈 + 5 % 三氟乙酸)将蛋白从胶中萃取出来,真空离心浓缩抽干样品。然后再用溶解液(30 % 乙腈 + 1 % 三氟乙酸)溶解样品,取 0.3 μl 样品与等体积饱和的 CHCA 基质液混合,点样于不锈钢点样板上,空气中干燥,然后在 MALDI-TOF-MS/MS 质谱仪上分析。当质荷比达到 800 ~ 3500 D 时,获得肽质量指纹图谱(PMF)。选取最强的 5 个峰值来获得 MS/MS 数值。最后通过 Mascot 软件检索 Swiss Prot 数据库鉴定蛋白质。
2 结果
2.1 人 C14orf166 的核心编码区 DNA 制备
采用 RT-PCR 从人胰腺癌 Panc-1 扩增C14orf166 的核心编码区,如图 1 所示,在 750 bp处可见一清晰条带,与实际人 C14orf166 基因长度一致。
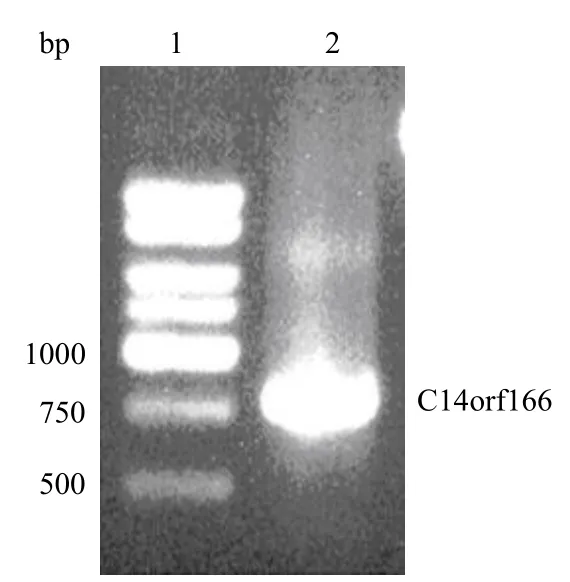
图 1 RT-PCR 扩增出的 C14orf166 基因核心编码区Figure 1 CDS of C14orf166 gene was obtainded by RT-PCR
2.2 重组质粒的酶切鉴定结果
重组质粒 pcDNA3.1-C14orf166 经 Nhe I 和Xho I 双酶切,产生了两条片段,其中一条在 750 bp附近(图 2)。测序结果进一步证实 C14orf166 克隆片段的插入方向正确,插入序列符合要求,测序发现克隆的 C14orf166 基因片段的编码区序列和Genank 中报道的序列完全一致。
2.3 Western-blot 检测外源 C14orf166 蛋白在细胞中的表达
293T 细胞转染 48 h 后提总蛋白,分别用 His抗体和 C14orf166 蛋白抗体进行 western blot 验证,实验表明转染后细胞中的 C14orf166 蛋白表达量明显提高(图 3),并且带 His 标签(图 4)。即获得了高表达带 His 标签的 C14orf166 蛋白的细胞。

图 2 酶切验证结果Figure 2 Restriction enzyme analysis result

图 3 用 C14orf166 抗体 western blots 结果Figure 3 Western blots result using C14orf166 antibody

图 4 用 His 抗体 western blots 结果Figure 4 Western blots result using His antibody
2.4 C14orf166 蛋白复合体的分离和质谱鉴定
将瞬时转染 48 h 的 293T 细胞温和裂解法抽提总蛋白,进行 pull-down 实验,得到两组蛋白质复合物,通过 SDS-PAGE 分离得到 7 条差异条带(图 5),其中最明显的条带 S6 通过质谱鉴定是C14orf166 蛋白,其余条带里的蛋白可能与C14orf166 相互作用。
我们对 7 条差异条带进行质谱分析初步得到3 种蛋白:40S ribosomal protein S8(RS8)、EF-hand calcium-binding domain-containing protein 9(EFCB9)、Nebulin-related-anchoring protein(NRAP),其中RS8 与 C14orf166 存在于 S6 条带中,NRAP 存在于 S2 条带中,EFCB9 存在于 S3 条带中。
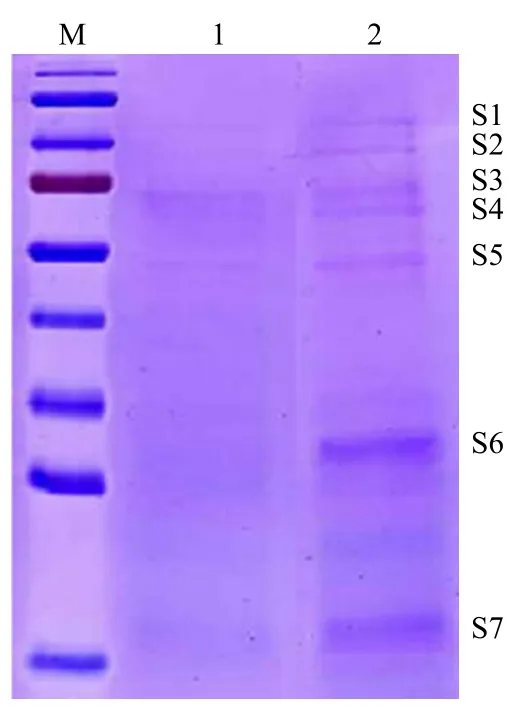
图 5 SDS-PAGE 结果Figure 5 SDS-PAGE results
3 讨论
C14orf166 基因定位于人 14 号染色体上,基因全长 1064 bp,核心编码区 735 bp,编码一个分子量约 26 kD 的蛋白分子,广泛分布于人体各种组织[1],主要表达于细胞质,在细胞核中也有表达[4]。但其分子功能尚不清楚。关于该蛋白的报道最早见于 2001 年,Huarte 等[4]研究发现 C14orf166与甲型流感病毒聚合酶复合物 PA 亚基相互作用,后来 Pérez-González 等[5]进一步证明了上述相互作用调节 RNA 聚合酶 II 活性,影响 mRNA 的转录。近年来研究发现 C14orf166 与肿瘤的发生和转移呈正相关[1-3]。但其内在机制尚不清楚。
任何一个蛋白质起作用都是通过与其他蛋白相互作用实现的,研究 C14orf166 蛋白的功能作用机制必需从相互作用蛋白研究开始。亲和层析或pull-down 与质谱串联的技术已经成为研究蛋白相互作用的重要的方法[6-7]。其基本流程是:在真核或原核细胞中转染一个带标签的外源基因的表达载体,让其在细胞中表达,参与细胞的生理生化反应,然后利用标签抗体将外源蛋白连同与其组成复合物的蛋白分子一起 pull-down 或纯化出来,然后对产物进行分析鉴定,这样就能得到一组与外源蛋白直接或间接相互作用的蛋白。
本研究首先选择了常用的 pcDNA3.1 真核表达载体,构建了 C14orf166 真核表达载体,并在C14orf166 的两端分别添加了 Flag 和 His 标签。我们选择了易转染、表达效率高的 293T 细胞做为靶细胞。利用脂质体转染法,在细胞中表达带标签的 C14orf166蛋白。通过 His pull-down 的方法成功地分离了 C14orf166 的蛋白复合体,表明这一方法对于研究目的蛋白特别是低丰度蛋白的相互作用是可行的。
质谱鉴定初步得到了 RS8、EFCB9 和 NRAP 3 个可能与 C14orf166 相互作用的蛋白。RS8 是一种核糖体小亚基蛋白,参与蛋白的翻译。关于该蛋白没有直接的文献报道。Wang 等[8]研究发现CNG6_MOUSE(C14orf166 同系物)和 RS3A 都与小鼠脑发育有关。另有文献报道 RS13 通过下调P27 促进胃癌的发展[9]。NRAP 是伴肌动蛋白相关的锚定蛋白,参与肌原纤维的形成[10]。EFCB9 是一种含有钙离子结合结构域的 EF 手型蛋白,具有类似结构域的蛋白有很多,例如 S100。有文献报道 S100 在胃癌中高表达,可能参与胃癌的发展[11]。
仅仅通过一两种方法并不能完全确定蛋白质之间的相互作用关系,在今后的研究中将对这些潜在的相互作用蛋白利用其他方法进行进一步的验证和功能研究,以阐明 C14orf166在肿瘤发病机制中的可能作用。
参考文献
[1] Howng SL, Hsu HC, Cheng TS, et al. A novel ninein-interaction protein, CGI-99, blocks ninein phosphorylation by GSK3beta and is highly expressed in brain tumors. FEBS letters, 2004, 566(1/3):162-168.
[2] Cui Y, Wu J, Zong M, et al. Proteomic profiling in pancreatic cancer with and without lymph node metastasis. Int J Cancer, 2009, 124(7): 1614-1621.
[3] Guo J, Wang W, Liao P, et al. Identification of serum biomarkers for pancreatic adenocarcinoma by proteomic analysis. Cancer Sci, 2009, 100(12):2292-2301.
[4] Huarte M, Sanz-Ezquerro JJ, Roncal F, et al. PA subunit from influenza virus polymerase complex interacts with a cellular protein with homology to a family of transcriptional activators. J Virol, 2001, 75(18):8597-8604.
[5] Pérez-González A, Rodriguez A, Huarte M, et al. hCLE/CGI-99, a human protein that interacts with the influenza virus polymerase, is a mRNA transcription modulator. J Mol Biol, 2006, 362(5):887-900.
[6] Lambert JP, Mitchell L, Rudner A, et al. A novel proteomics approach for the discovery of chromatin-associated protein networks. Mol Cell Proteomics, 2009, 8(4):870-882.
[7] Bürckstümmer T, Bennett KL, Preradovic A, et al. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat Methods, 2006, 3(12):1013-1019.
[8] Wang J, Gu Y, Wang L, et al. HUPO BPP pilot study: a proteomics analysis of the mouse brain of different developmental stages. Proteomics, 2007, 7(21):4008-4015.
[9] Guo X, Shi Y, Gou Y, et al. Human ribosomal protein S13 promotes gastric cancer growth through downregulating p27(Kip1). J Cell Mol Med, 2009, 13.
[10] Lu S, Horowits R. Role of nonmuscle myosin IIB and N-RAP in cell spreading and myofibril assembly in primary mouse cardiomyocytes. Cell Motil Cytoskeleton, 2008, 65(9):747-761.
[11] Liu J, Li X, Dong GL, et al. In silico analysis and verification of S100 gene expression in gastric cancer. BMC cancer, 2008, 8:261.
ObjectiveThe aim of this study was to express C14orf166 in eukaryotic cells, and to screen and identify proteins interacting with C14orf166, which will provide foundation for further study on its function on tumor metastasis.
MethodsConstructed eukaryotic expression vector of human C14orf166 gene pcDNA3.1- Flag-C14orf166-His with two tags, then the recombinated vector were transfected into 293T cells by Lipofectamine2000.Using Ni-agrose to pull-down His labeled Proteins, then C14orf166 compouds were obtained. SDS-PAGE was used to separate the compouds, then different straps were selected and identified by MALDI-TOF- TOF.
ResultsC14orf166 was successfully overexpressed in 293T cells, three poteintial interaction proteins of C14orf166 were identified.
ConclusionGene recombination expression combined with pull-down and Proteomics methods are eligible to find out novelinteracting proteins, which provide new clues to investigate the effect of C14orf166 on tumor pathogenesis.
【Key words】Pancreatic neoplasms; Proteomics; Gene expression
Author Affiliations: Shandong Academy of Medical Sciences/Shandong Medical Biotechnological Center/Key Laboratory for Biotech Drugs of Health Ministry, Key Laboratory for Medical Molecular Biology of Shandong Province, Jinan 250062, China
Corresponding author:HAN Jin-xiang, Email: jxhan@sdu.edu.cn www.cmbp.net.cn Chin Med Biotechnol, 2010, 5(3):186-190
基金项目:山东省科技攻关计划项目(2005GG1102003)
作者单位:250062 济南,山东省医学科学院/山东省医药生物技术研究中心/国家卫生部生物技术药物重点实验室/山东省现代医用药物与技术重点实验室
通讯作者:韩金祥,Email:jxhan@sdu.edu.cn
收稿日期:2010-02-08
DOI:10.3969/cmba.j.issn.1673-713X.2010.03.005
The eukaryotic expression of pancreatic cancer relted gene C14orf166 and screening of its interacting proteins by Proteomics methods
ZHANG Deng-lu, HAN Jin-xiang, CUI Ya-zhou, ZHOU Xiao-yan
【Abstract】
