微生物抑制法检测饲料中盐霉素含量的研究
2010-04-02赵光华陈红歌董小海马红芳
赵光华 陈红歌 董小海 马红芳
微生物抑制法检测饲料中盐霉素含量的研究
赵光华 陈红歌 董小海 马红芳
从几种标准工作菌株中筛选出对盐霉素敏感的菌株,以敏感菌株为工作菌株测定饲料中盐霉素的含量。结果显示:枯草芽孢杆菌、藤黄微球菌对盐霉素不敏感,地衣芽孢杆菌、嗜热脂肪芽孢杆菌对盐霉素敏感。以嗜热脂肪芽孢杆菌敏感菌株为工作菌株测定饲料中盐霉素含量,最低检出浓度为0.25μg/m l,饲料中最低检出限为1.0mg/kg,标准曲线相关系数为0.99,回收率在60%~80%,均高于标准中规定的参数。试验结果表明:微生物抑制法检测饲料中盐霉素含量,灵敏度高,快速,简便。
盐霉素;微生物抑制法;枯草芽孢杆菌;地衣芽孢杆菌;藤黄微球菌;嗜热脂肪芽孢杆菌
盐霉素(Salinomycin Sodium)[1,2]是由白色链霉菌发酵产生的一种一元羧酸聚醚类抗生素,具有特有的环状结构,是典型的离子载体抗生素,属于离子载体抗球虫药,通常为钠盐。由于其广谱高效、不易产生耐药性,国内外广泛用来防治牛、羊、鸡、兔的球虫病,同时可以作饲料添加剂使用,促进畜禽生长发育和提高饲料利用率[3]。盐霉素对人无害,不干扰植物生长,不影响土壤中的微生物。但聚醚类抗生素使用剂量安全范围较窄,在饲料中含量稍大即可使动物的增重减慢,饲料转化率降低,并且随着人们对动物性食品质量要求的提高以及对外出口贸易的需要,饲料中盐霉素含量的准确测定则显得尤为重要。
本试验就是采用微生物抑制法的原理对饲料中盐霉素含量的测定方法作了进一步的研究。确定了地衣芽孢杆菌也可以作为工作菌株使用,确定了最适菌层浓度,并优化了样品前处理程序和菌种培养程序。微生物抑制法[4]与高效液相色谱法[5]、分光光度法[6]、质谱联用法[2]等仪器法相比较,仪器法前处理复杂,试剂损耗大,仪器昂贵,而微生物抑制法则有良好的剂量关系,较低的检出限,可接受的回收率,并且前处理简单、不需要昂贵的仪器设备,能同时筛选大量样品,具有方便、快速的优点。
1 材料和方法
1.1 试验材料
1.1.1 标准品
盐霉素钠,德国Dr.Ehrenstorfer GmbH公司生产,含量80.0%。用无水甲醇稀释成浓度为1000μg/m l的标准储备液,置于0~5℃冰箱保存,临用时用甲醇溶液(9+1)将标准储备液分别稀释成不同浓度。
1.1.2 标准菌株
嗜热脂肪芽孢杆菌(Bacillus stearothermophilus var.calidolactis,CMCC63509,广东省微生物研究所菌种保藏中心提供);藤黄微球菌(CMCC28001,广东省微生物研究所菌种保藏中心提供);枯草芽孢杆菌(单位自有);地衣芽孢杆菌(单位自有)。
1.1.3 试剂
无水甲醇(分析纯);中性氧化铝:270~335目,300℃活化3 h备用;抗生素检定Ⅰ、Ⅱ号培养基。
1.1.4 仪器与设备
高压灭菌锅、恒温培养箱、旋转真空蒸发器、离心机、振荡器、游标卡尺、牛津杯、培养皿(具陶瓦盖)、可调微量移液器等。
1.2 方法
1.2.1 检测条件的优化
1.2.1.1 对盐霉素敏感菌株的筛选
分别取嗜热脂肪芽孢杆菌、藤黄微球菌、枯草芽孢杆菌和地衣芽孢杆菌斜面菌种接种于营养琼脂斜面培养,培养24 h后用5ml灭菌水洗下菌苔,作为菌液储备液。在Ⅱ号培养基中分别加入上述4种菌液储备液,制成检定平板,每个平板等距离放置3个牛津杯,牛津杯中加入100μl参照浓度为1μg/m l的盐霉素标准品稀释液,分别于55℃培养箱中培养16 h后测量每个平板的抑菌圈直径,选择有抑菌圈,且抑菌圈边缘光滑、完整的敏感菌株。
1.2.1.2 最适菌层浓度的选择
在Ⅱ号培养基中分别加入0.01%、0.025%、0.05%、0.075%、0.10%浓度的敏感菌株的菌液储备液,菌液储备液以营养琼脂斜面培养物接种培养瓶中,培养24 h后用10ml灭菌生理盐水洗下,即为菌液储备液。以此不同浓度菌液作为平板菌层添加液,制成一系列菌层浓度的平板,每个平板等距离放置6个牛津杯,3个牛津杯中分别加入100μl参照浓度1μg/ml的盐霉素标准品稀释液,另3个牛津杯中分别加入100μl参照浓度5μg/ml的盐霉素标准品稀释液,55℃培养(17±1)h后测量每个平板的抑菌圈直径,选择最适菌层浓度,使得参照浓度的抑菌圈直径大于10mm,并且抑菌圈边缘光滑、完整。
1.2.1.3 饲料中最低检测限的测定
在空白饲料样品中加入已知量的不同浓度的标准品,准确加入20.0ml样品提取液,震荡1 h后静置片刻,全部转移到准备好的氧化铝柱中,用样品提取液不间断洗脱,用100ml容量瓶接收至刻度。稀释或浓缩后为试验样液,经培养、测定抑菌圈直径,以产生直径大于10mm的明显、清晰抑菌圈的最小浓度为最低检测限。
1.2.1.4 饲料中回收率的测定
分别取不同浓度的盐霉素标准溶液各1.0ml添加到空白饲料样品中,同1.2.1.3节处理样品,培养、测定抑菌圈直径,代入标准曲线回归方程,计算样品药物浓度和回收率。
1.2.2 标准曲线的建立
以最适菌层浓度为菌液添加浓度,用甲醇溶液稀释盐霉素标准储备液,分别配制成0.25、0.5、1.0、2.0、4.0 μg/ml和 5.0、10.0、15.0、20.0、25.0 μg/m l各五个工作浓度的两条标准曲线,前者以1.0μg/ml为标准参考浓度,后者以5.0μg/ml为标准参考浓度,培养,测定抑菌圈直径,校正后绘制标准曲线图或计算回归方程。
2 结果与分析
2.1 对盐霉素敏感菌株的筛选
分别取嗜热脂肪芽孢杆菌、藤黄微球菌、枯草芽孢杆菌和地衣芽孢杆菌的菌液储备液,分别以0.10%浓度的菌层浓度接种于Ⅱ号培养基中,制成检定平板,以1μg/ml的盐霉素标准品稀释液为参照浓度,分别于55℃培养16 h后测量每个平板的抑菌圈直径,结果见表1。

表1 敏感菌株的筛选(n=6)
结果表明:除枯草芽孢杆菌外,其他几种标准菌株均对盐霉素敏感,其中在相同的菌层浓度、相同的参照浓度的情况下,嗜热脂肪芽孢杆菌的抑菌圈直径最大,说明嗜热脂肪芽孢杆菌对盐霉素最为敏感,地衣芽孢杆菌次之,藤黄微球菌更次之,枯草芽孢杆菌不敏感。地衣芽孢杆菌的抑菌圈直径也大于10mm,且边缘清晰完整,也可以作为工作菌株使用。
2.2 最适菌层浓度的选择
依据2.1节得出的结论,选择嗜热脂肪芽孢杆菌标准菌株为工作菌株,在Ⅱ号培养基中分别加入0.01%、0.025%、0.05%、0.075%、0.10%浓度的敏感菌株的菌液储备液,每个菌层浓度分别以5μg/ml和1μg/ml的盐霉素标准稀释液为参照浓度,55℃培养16 h后测量每个平板的抑菌圈直径,结果见表2。

表2 菌层浓度对抑菌圈直径的影响(n=6)
由表2可以看出,随着菌层浓度的增加,检定平板中菌落生长由稀疏到稠密,抑菌圈边缘由不清晰到清晰,再到出现双圈现象,菌层浓度的高低直接影响着抑菌圈的直径和质量。在0.05%菌液添加量时,5μg/ml和1μg/ml的盐霉素参照浓度的抑菌圈的直径均出现最大值,在大于0.05%菌液添加量时,5μg/ml和1μg/ml的盐霉素参照浓度的抑菌圈直径均出现减小的趋势,因此得出,0.05%菌液添加量为最适菌层浓度。
2.3 标准曲线的线性分析
以0.05%菌液添加量为最适菌层浓度,用甲醇溶液稀释盐霉素标准储备液,分别配制成0.25、0.5、1.0、2.0、4.0 μg/m l和 5.0、10.0、15.0、20.0、25.0 μg/ml各五个工作浓度的两条标准曲线,前者以1.0μg/ml为标准参考浓度,后者以5.0μg/ml为标准参考浓度,培养,测定抑菌圈直径。结果见表3、表4。

表3 标准曲线1:各点平均抑菌圈直径的校正值
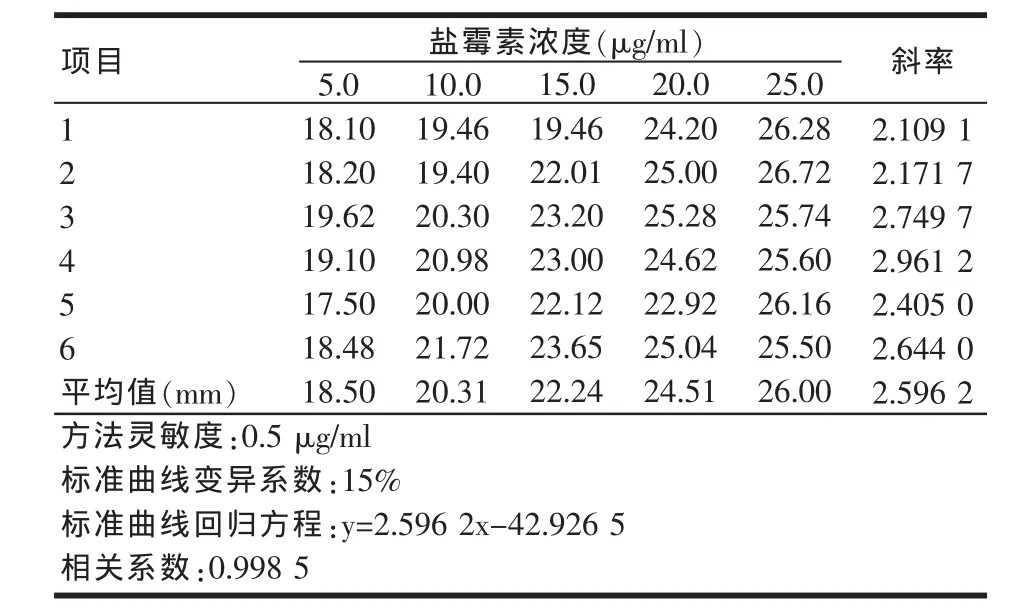
表4 标准曲线2:各点平均抑菌圈直径的校正值
由表3、表4可以看出,0.25μg/ml浓度的标准溶液产生的抑菌圈直径小于10mm,0.5μg/ml浓度的标准溶液产生的抑菌圈直径大于10mm,且边缘清晰完整,可以得出方法的灵敏度为0.5μg/ml。对两组标准曲线的回归方程进行计算,得出相关系数在0.9809~0.9985,斜率的变异系数(CV)为 10.6%~15%,符合我国关于残留检测方法对于回收率和变异系数的规定。
2.4 饲料中回收率和最低检出限的测定
2.4.1 回收率的测定
测定盐霉素添加水平为 0.5、1.0、10.0、100.0 μg/g的饲料中的回收率,试验结果见表5。
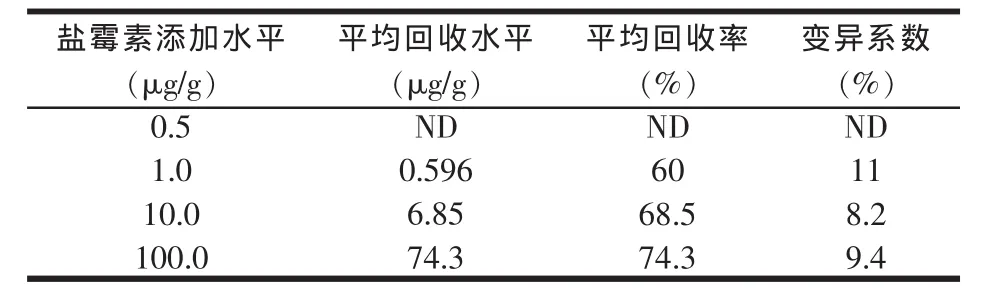
表5 饲料中的回收率
从表5可以得出:几个盐霉素添加水平,其回收率均在60%~80%,变异系数在10%左右,可以满足残留检测方面的要求。
2.4.2 最低检出限的测定
从表5可以看出,饲料中各添加水平的回收率均在60%~80%,但添加水平为0.5μg/g时,无抑菌圈,检测不出。1.0μg/g添加水平的抑菌圈边缘清晰,直径大于10mm,故在饲料中盐霉素的最低检出限为1.0μg/g。
3 讨论
3.1 微生物抑制法检测影响因素分析
微生物抑制法检测兽药残留具有很大的生物学优势,但也因其生物学特性差异而影响因素较多,并且非常复杂,最适菌层浓度、最佳菌含量、最佳培养条件、加液准确性等因素直接影响着检测结果的准确性。特别是在标准曲线的制备上,相关系数较低,差异较大,如何减少上述因素造成的平板间的差异是实现检测方法准确度和重现性的关键。
3.2 最低检出限和回收率的优缺点
试验中通过降低标准曲线浓度,使得方法的检出限进一步降低,达到1.0μg/g,比国标方法低0.25μg/g,实现了检测方法的进一步优化。该检测方法的回收率在60%~80%,属于较低水平,但生物学检测的不确定因素较多,成分损失较多,因其具有良好的快速筛选性,只要精密度符合要求,低回收率可以接受。
3.3 微生物抑制法在兽药残留检测方面的扩展性以及快速检测试剂的开发
微生物抑制法因其具有很大的广泛性和快速的筛选性在兽药残留检测方面具有很好的扩展性。只要某一种或几种抗生素对某种微生物有抑制作用,反过来就可以利用该微生物对上述抗生素进行检测。如果把相关的敏感微生物连同培养、显色等试剂一起固化,简化微生物菌株和试剂的保藏条件,延长微生物菌株和试剂的使用期限,减少试验操作步骤,结合简单的判读仪器,可以实现检测方法的快速化和商品化。
[1]徐奇友,许红.盐霉素及其在饲料中的应用[J].饲料博览,2002(6):31-32.
[2]Mortier L,Daeseleire E,Van Peteghem C.Determination of the ionophric coccidiostats narasin,monensin,lasalocid and salinomycin in eggs by lipuid chromatography mass spectrometry[J].Rapid Commun Mass Spectrom,2005,19(4):533-539.
[3]戚风娥.盐霉素的应用与生产研究[J].今日养猪业,2005(5):45-46.
[4]李娜,孙浩,祁克宗.肌肉组织中盐霉素残留的微生物法检测研究[J].饲料工业,2008,29(3):45-48.
[5]马立农,陈杖榴.高效液相色谱柱前衍生化法测定饲料中的盐霉素[J].中国兽医杂志,2002,36(2):33-35.
[6]宋荣,常碧影.饲料中盐霉素的测定方法[J].中国饲料,2003(8):25-26.
(编辑:张学智,mengzai007@163.com)
S816.17
A
1001-991X(2010)13-0045-03
赵光华,河南农业大学生命科学学院,河南省农科院质标中心,450002,河南省郑州市农业路1号。
陈红歌,河南农业大学生命科学学院。
董小海、马红芳,河南省农科院质标中心。
2010-03-14
