番茄果实中全反式番茄红素的C30-HPLC外标法定量检测
2010-03-23惠伯棣
丁 靖,惠伯棣*,刘 源
(北京联合大学应用文理学院,北京 100191)
番茄果实中全反式番茄红素的C30-HPLC外标法定量检测
丁 靖,惠伯棣*,刘 源
(北京联合大学应用文理学院,北京 100191)
为建立一种在C30-HPLC上使用外标法对番茄红素全反式异构体进行定量检测的方法,采用色谱条件:固定相:YMC Carotenoid columu C30色谱柱(4.6mm×250mm,SOD-5μm,Waters);流动相A:乙腈-甲醇(3:1,V/V);流动相B:甲基叔丁基醚(MTBE);流动相A与B中分别添加0.05%(V/V)的三乙胺;线性梯度洗脱:B在20min内由0增至80%,20~35min内B维持在80%;流速:1mL/min;色谱图检测波长470nm;进样量:20μL;柱温:室温。结果表明:此方法的最小定量限为0.10μg/mL,在10~100μg/mL范围内质量浓度与组分峰面积的线性回归方程为y=212181x,R2=0.9738。相对标准偏差为4.04%。外标加样回收率为97.34%(RSD为0.904%)。应用本方法可对番茄果实中的全反式番茄红素进行定量分析。
全反式番茄红素;定量分析;外标;C30-HPLC
番茄红素(lycopene)是一种自然界中广泛存在的类胡萝卜素(carotenoid),含有11个共轭及2个非共轭碳-碳双键,主要存在于番茄、番石榴、西瓜等食物以及一些微生物中,已被证明有多种健康功能[1-2]。由于番茄红素分子高度的不饱和结构,使其在天然的生物合成系统中存在多种几何异构体,主要包括全反式异构体(All E-isomer)和5-、9-和13-等顺式异构体(Z-isomer)。同时,番茄红素在哺乳动物体内代谢时也存在多种几何异构体[3]。不同的异构体具有不同的生物学功能。因此,无论在合成代谢、降解代谢和在食品中的应用研究中,番茄红素几何异构体的定性、定量检测是一个迫切需要解决的问题。
自从C30固定相问世以来,番茄红素几何异构体在HPLC上的分离问题已经解决。尤其是Sander等建立了乙腈-甲醇和甲基叔丁基醚(MTBE)的洗脱条件后,番茄红素几何异构体在C30柱上具有了良好的分离和稳定的色
谱行为[4-8]。目前,除全反式异构体外,只有5Z-番茄红素的定性已有报道[9]。换言之,目前番茄红素的全反式异构体在C30柱上具备定量的可行性[10-11]。本项研究旨在发展一套应用外标法在C30-HPLC上对番茄红素全反式异构体进行定量测定的方法,并尝试将该方法应用于番茄果实为原料的番茄红素源食品。这对番茄红素的生物合成和体内代谢等研究具有很强的现实意义。

图1 全反式番茄红素的分子结构Fig.1 Molecular structure of all-trans-lycopene
1 材料与方法
1.1 番茄果实样品
7、8月应季新鲜番茄果实购自各地超市与食品市场。
1.2 参比样品
番茄红素参比样品(P/N:L9879)由Sigma公司提供,纯度为90%~95%,使用前应用C30-HPLC检测其番茄红素的几何异构体组成。根据不同组分的峰面积比例,计算全反式异构体的比例大于99%。故未经进一步纯化而直接使用。
1.3 试剂
丙酮、二氯甲烷、正己烷、石油醚、三乙胺(BP:6 0~9 0℃)(均为分析纯);乙腈、甲醇、甲基叔丁基醚(MTBE)(均为色谱纯)。配制好的流动相在使用前用0.45μm的微孔滤膜(Millpore公司)过滤。配制流动相所用的水为经过逆流渗透处理的超纯水。
1.4 仪器与设备
HPLC由1525溶剂输送系统、PDA-996二极管阵列检测器组成(美国Waters公司),系统的重复性良好。在6次以上的重复性检测中,RSD<5%;MultiSpec-1501型分光光度计 日本岛津公司;半微量分析天平(0.00001g) Precisa公司;TP114(0.0001g)电子天平 Denver仪器公司。
1.5 参比样品储备液的配制
精确(0.00001g)称取番茄红素参比样品1mg,加入1mL二氯甲烷溶解,转移至10mL棕色容量瓶中,用石油醚定容至10mL,配制成100mg/mL的储备液,保存于-20℃冰箱中。在24h之内使用石油醚配成质量浓度适当的工作液,用于HPLC分析。
1.6 样品制备
将200~250g同产地、色泽均匀的果实切成碎块放入捣碎机中捣碎。捣碎时加入1g碳酸钠以中和细胞破碎时释放出的有机酸。称取1g果实匀浆,加少量石英砂和4倍体积的丙酮研磨,静置,用滴管小心移出上清液,重复6~8次萃取直至上清液和残渣均为无色。合并收集上清液,用丙酮定容至30mL,转入分液漏斗后加入等体积正己烷缓慢摇动,再加入等体积蒸馏水缓慢摇动,静置10min,收集上相。用等体积蒸馏水洗涤上相2次,直至上相体积不再变化。收集上相,用氮气吹干,并充氮气保存于-20℃冰箱中,24h内用于HPLC分析。分析前用正己烷定容,0.45μm滤膜过滤。
1.7 样品干质量测定
精确(0.0001g)称取番茄果实匀浆于玻璃表面皿(φ= 10cm)中,在70℃真空(-0.08MPa)干燥箱中烘至质量恒定。用减重法称量样品干质量。每个样品做6份平行,取平均值。
1.8 色谱条件
C30固定相:YMC Carotenoid column C30色谱柱(4.6mm×250mm,SOD-5μm);流动相A:乙腈-甲醇(3:1,V/V);流动相B:MTBE;流动相A与B中分别添加0.05%(V/V)的三乙胺;线性梯度洗脱:B在20min内由0增至80%,20~35min内B维持在80%;流速:1mL/ min;色谱图监测波长470nm;进样量:20μL;柱温:室温[12]。
1.9 质量浓度-峰面积线性关系的测定
精确量取一定体积的参比样品储备液,用稀释的方法配制成7个不同质量浓度的标准样品液,分别为0.00、10.00、20.00、40.00、60.00、80.00、100.00mg/mL。各取20μL进样,在每个色谱图上,对番茄红素全反式异构体组分峰积分,得到峰面积,做质量浓度-峰面积线性回归,得到回归曲线和方程,计算R2值。
1.10 检测下限的测定
按信噪比为2测定检测下限。
1.11 重复性分析
配制质量浓度为50.00mg/mL的番茄红素全反式异构体参比样品工作液。重复HPLC分析6次。根据已测定的质量浓度-峰面积线性关系,计算质量浓度平均值和RSD。
1.12 回收率分析
在本研究中,采用添加法进行外标参比样品回收率的分析。方法是将质量浓度为50.00mg/mL的番茄红素全反式异构体参比样品工作液添加到全反式番茄红素浓度为0.49mg/mL的新鲜番茄果实萃取物中,使添加后样品中的全反式番茄红素的质量浓度是鲜果萃取物中的2倍,然后重复6次做HPLC分析。
1.13 数据处理
每个样品的制备与检测重复6次,取平均值,RSD<5%。
1.14 操作注意事项
由于番茄红素分子的不饱和结构,使其具有极大的不稳定性。在实验室操作中最易发生的化学变化为几何
(E/Z)异构化和环氧化。所以,在进行番茄红素制备和检测工作时,要遵循以下注意事项,同时操作过程要尽可能的快速。
避氧:使用惰性气体对于番茄红素的保护是非常有效的。在蒸发浓缩和保存时,使用氮气(纯度>99.9%)或者氩气。
避光:番茄红素的所有操作和处理都必须避免阳光和紫外线的直射。所有的操作都应该在散射的自然光或者柔和的人工光下进行。番茄红素的所有溶液都应当用棕色玻璃瓶盛放。
温度控制:番茄红素的一切操作过程都应该控制在尽可能低的温度下。在-20℃以下条件下避光保存。如需使用旋转蒸发仪浓缩溶液,蒸发温度须控制在45℃以下。
避酸:番茄红素应严格避免与酸的接触。
2 结果与分析
2.1 参比样品的色谱行为、光谱特征和几何异构体组成
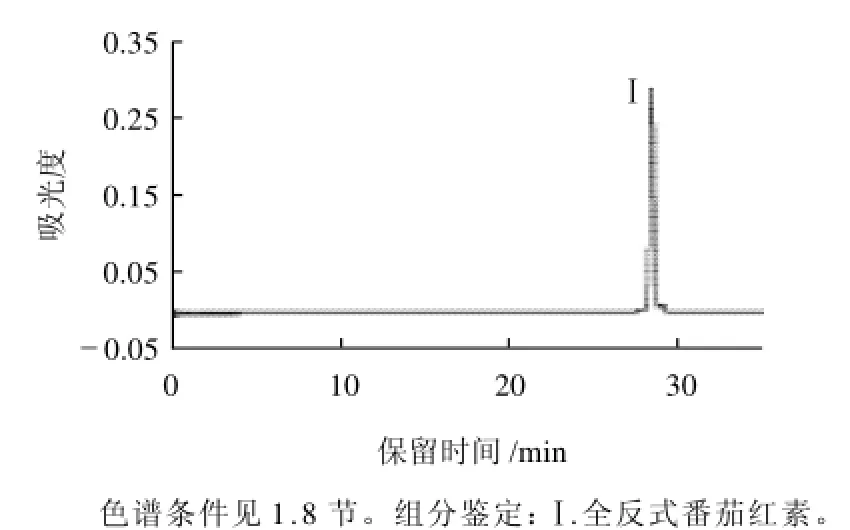
图2 番茄红素参比样品的C30-HPLC色谱行为Fig.2 Elution profile of lycopene standard separated by C30-HPLC

图3 组分Ⅰ的电子吸收光谱图Fig.3 Electronic absorption spectrum of fractionⅠ
对番茄红素参比样品进行C30-HPLC分离获得的色谱图(图2)和组分Ⅰ的电子吸收光谱图(图3)。根据其色谱行为(保留时间)和光谱特征(最大吸收波长和光谱精细结构)确定组分Ⅰ为番茄红素的全反式异构体[4-8]。图2中组分峰面积的积分显示,该参比样品中全反式异构体组分(组分Ⅰ)的峰面积比例大于99%。因此,可以作为全反式异构体的参比样品使用。
2.2 参比样品质量浓度-峰面积的线性关系

图4 番茄红素全反式异构体组分的质量浓度与其峰面积的线性回归Fig.4 Linear correlation between the concentration of all-translycopene and corresponding peak area
在C30-HPLC上测定番茄红素全反式异构体组分与其峰面积的线性关系时,将7个不同质量浓度的标准样品工作液分别进样20μL。在每个样品的色谱图上计算全反式异构体组分的峰面积,得到线性回归曲线图4及回归方程:y=212181x(R2=0.9738)。线性区间为10~100mg/mL。
2.3 检测下限
按信噪比为2测定检出下限为0.01mg/mL。
2.4 重复性分析
重复测定6次的参比样品质量浓度的平均值为48.81mg/mL,RSD为4.04%。结果见表1。

表1 重复性分析实验结果(n=6)Table1 Results of reproducibility experiments
2.5 回收率分析

表2 回收率分析实验结果(n=6)Table2 Results of recovery rate experiments
本实验采用添加法进行全反式番茄红素参比样品的回收率分析(C30系统分析结果见表2)。由表2结果与文
献[13]中C18柱上的分析结果相比较可知,番茄红素全反式异构体在C30柱上损失略高。其原因可能为按照“草丛”原理,全反式异构体与C30基团的吸附能力较与C18基团强[4]。
2.6 番茄果实中全反式番茄红素的定量测定
图5为河北沧州市7、8月产番茄果实萃取物的C30-HPLC色谱图。根据其色谱行为(保留时间)和光谱特征(最大吸收波长和光谱精细结构)与参比样品的比较,组分Ⅰ被鉴定为全反式番茄红素。根据已有的报道[4-8],组分Ⅱ鉴定为全反式β-胡萝卜素。图6为新疆库尔勒市7、8月产番茄果实萃取物的C30-HPLC色谱图。根据其色谱行为和光谱特征与参比样品的比较,组分Ⅰ鉴定为全反式番茄红素。根据其光谱特征和已有的报道[4-8],组分Ⅱ被鉴定为5Z-番茄红素,组分Ⅲ被鉴定为13Z-番茄红素。从图5可以看到,库尔勒地区产的番茄果实中有相当数量的5-和13-顺式异构体存在。从图5、6的比较可以看出,不同产地的番茄中番茄红素几何异构体的比例有明显区别。由于不同异构体的生物学功能和效价不同[12],不同产地番茄果实中番茄红素的生物学效价(甚至功能)亦可能出现差别。因此,在对番茄及其制品中番茄红素的质量进行评估时,测定其几何异构体组成是最理想的做法。由于全反式异构体在数量上的优势[2,14-15],测定其中全反式异构体的数量具有极其重要的意义。表3为应用外标法测得不同产地鲜食型番茄中全反式番茄红素的含量。

图5 河北沧州市产番茄果实萃取物的C30-HPLC色谱行为Fig.5 Elution profile of extract from tomato fruits in Cangzhou separated by C30-HPLC

图6 新疆库尔勒市产番茄果实萃取物的C30-HPLC色谱行为Fig.6 Elution profile of extract from tomato fruits in Kuerle separated by C30-HPLC

表3 不同番茄中全反式番茄红素的含量测定Table3 Contents of all-trans-lycopene from different kinds of tomato fruits
3 结 论
本研究表明,运用C30-HPLC外标法定量检测番茄果实中全反式番茄红素是切实可行的,这对确定不同番茄红素源中番茄红素顺反异构体之间的比例,从而研究其生物学功能和效价具有重要的现实意义。
[1]李京, 惠伯棣, 裴凌鹏. 番茄红素: 被关注的功能因子[J]. 食品科学, 2005, 26(8): 461-464.
[2]李京, 惠伯棣, 裴凌鹏. 番茄果实在成熟过程中类胡萝卜素含量的变化[J]. 中国食品学报, 2006(2): 122-125.
[3]李京, 惠伯棣. 番茄红素在体内代谢中的几何异构体组成变化[J]. 食品科学, 2008, 29(9): 591-594.
[4]惠伯棣, 李京, 裴凌鹏. 应用C30-HPLC-PDA分离与鉴定番茄红素几何异构体[J].食品工业科技, 2006(7): 49-54.
[5]惠伯棣, 刘沐霖, 庞克诺, 等. 食品中类胡萝卜素几何异构体组成的C30-HPLC检测[J]. 中国食品添加剂, 2007(2): 201-210.
[6]惠伯棣, 张西, 文镜. 反相C30柱在HPLC分析类胡萝卜素中的应用[J]. 食品科学, 2005, 26(1): 264-270.
[7]惠伯棣, 李京, 孙拿拿, 等. 番茄和胡萝卜中类胡萝卜素的C30与C18 HPLC分离[J]. 中国食品卫生杂志, 2006(4): 289-292.
[8]EMENHISER C, SIMUNOVIC N, SANDER L C, et al. Separation of geometrical carotenoids isomers in biological extracts using a polymeric C30 column in reversed-phase liquid chromatography[J]. J Agric Food Chem, 1996, 44: 3887-3893.
[9]FANG Liqiong, PAJKOVIC N, WANG Yan, et al. Quantitative analysis of lycopene isomers in human plasma using high-performance liquid chromatography-tandem mass spectrometry[J]. Anal Chem, 2003, 75: 812-817.
[10]惠伯棣, 李京, 郑康成, 等. 蒸发光散射检测器在番茄红素反相HPLC定量分析中的应用[J]. 食品科学, 2006, 27(2): 226-229.
[11]李京, 惠伯棣, 魏建华. 应用C30-HPLC-PDA-ELSD估算番茄红素顺式异构体吸光系数[J]. 中国食品学报, 2007(1): 125-130.
[12]李京, 惠伯棣. 几何异构化对番茄红素淬灭单线态氧功能的影响[J].食品科学, 2007, 28(8): 104-107.
[13]刘沐霖, 惠伯棣, 庞克诺. 番茄及其制品中番茄红素含量的C18-HPLC-PDA定量分析[J]. 食品科学, 2007, 28(7): 453-456.
[14]刘沐霖, 惠伯棣, 庞善春. 番茄红素人工合成品与天然产物的鉴定[J]. 食品科学, 2007, 28(9): 462-466.
[15]李京, 惠伯棣. 秋橄榄果实中番茄红素含量与几何异构体组成分析[J]. 食品工业科技, 2006(10): 64-65.
Quantification of All-trans-lycopene from Tomato Fruits by C30-HPLC with External Standard Method
DING Jing,HUI Bo-di*,LIU Yuan
(College of Applied Arts and Science, Beijing Union University, Beijing 100191, China)
An external standard method was established to determine all-trans-lycopene on C30-HPLC. Stationary phase was YMCTM Carotenoid column C30 (4.6 mm × 250 mm, SOD-5μ m, Waters); mobile phase A was acetonitrile-methanol (3:1, V/ V); mobile phase B was methyl tert-butyl ether (MTBE); both mobile phase A and B were added 0.05% (V/V) triethylamine; linear gradient elution was conducted with an increase of mobile phase B from 0 to 80% (V/V) in 20 min followed by maintaining at 80% mobile phase B for 15 min; flow rate was 1.0 mL/min; monitoring wavelength was 470 nm; injection volume was 20μ L; column temperature was set at room temperature. Under these determination parameters, the minimum detection limit was 0.10μ g/mL; in the range of 10-100μ g/mL, linear correlation equation was y = 212181x (R2= 0.9738) with a RSD of 4.04%. The recovery rate of external standard was 97.34% with a RSD of 0.904%. Therefore, this established method is suitable for determining alltrans-lycopene in tomato fruits.
all-trans-lycopene;quantification;external standard;C30-HPLC
TS201.2
A
1002-6630(2010)22-0453-04
2010-07-19
“十一五”国家科技支撑计划项目(2008BAI58B06)
丁靖(1983—),女,硕士研究生,研究方向为类胡萝卜素化学及生物化学。E-mail:ading1110@126.com
*通信作者:惠伯棣(1959—),男,教授,博士,研究方向为类胡萝卜素化学及生物化学。E-mail:bodi_hui@ygi.edu.cn
