不同收割期坛紫菜挥发性成分分析
2010-03-23应苗苗施文正刘恩玲
应苗苗,施文正*,刘恩玲
(1.温州科技职业学院,浙江 温州 325000;2.上海海洋大学食品学院,上海 201306)
不同收割期坛紫菜挥发性成分分析
应苗苗1,施文正2,*,刘恩玲1
(1.温州科技职业学院,浙江 温州 325000;2.上海海洋大学食品学院,上海 201306)
通过电子鼻和SPME-GC-MS方法对不同收割期的坛紫菜的挥发性成分进行分析,电子鼻实验表明不同收割期的坛紫菜挥发性成分差异明显;SPME萃取坛紫菜的挥发性成分,通过GC-MS分别从一水、二水、三水和四水坛紫菜中分离鉴定出35、38、51和55种化合物,其中以醛酮类和烷烃类为主,8-十七烯、壬醛和己醛是坛紫菜中主要的挥发性物质;实验结果还表明一水和二水坛紫菜挥发性成分变化较小,质量较稳定,三水和四水坛紫菜挥发性变化较大,因此一水和二水坛紫菜适宜开发作为食品。
坛紫菜;电子鼻;SPME-GC-MS;挥发性成分;收割期
紫菜的经济价值很高,仅中、日、韩3国的紫菜年产值就超过了20亿美元。在中国大陆被大规模栽培的紫菜有坛紫菜(Porphyra haitanensis)和条斑紫菜(P. yezoensis),其中坛紫菜系暖温带性海藻,在我国东南沿海均有分布,是福建省和浙江省重要的经济红藻,其年产量约占全国紫菜产量的75%,因此它在中国的紫菜产业中占有十分重要的位置[1]。一般坛紫菜可以分四次收割,即俗话说的“头水”、“二水”、“三水”、“四水”,风味方面,一般越往后营养价值降低,口味变差,“四水”以下坛紫菜一般不宜于食用[2-3]。
固相微萃取技术(solid phase microextraction,SPME) 是20世纪90年代出现的样品处理方法,是一种集萃取、浓缩、解吸于一体的样品前处理技术,具有方便、快捷、样品用量少、不使用有机溶剂等特点,同时避免了样品中不稳定成分的氧化、分解等问题,能够与气相或液相色谱仪联用[4-6]。电子鼻是一个新颖的分析、识别和检测复杂嗅味和挥发性成分的传感器阵列形式的电化学传感系统[7-10],不仅可以根据各种不同的气味测到不同的信号,而且可以将这些信号与经训练后建立的数据库中的信号加以比较,进行判断识别,因而具有类似鼻子的功能,从而在生产实践中得到了广泛的应用。
紫菜产品一般都对风味有较大的要求,而不同收割期的紫菜的挥发性成分具有的差异使开发紫菜产品具有较大难度和不确定性。本实验采用电子鼻和SPME-GCMS对产自洞头县的坛紫菜的挥发性成分进行分析,并对不同收割期坛紫菜间挥发性成分进行比较,旨在为不同收割期的坛紫菜的分类加工提供指导,并丰富风味化学的理论研究。
1 材料与方法
1.1 材料与试剂
坛紫菜样品由浙江省温州星贝海藻食品有限公司提供,品种为申福1号,采自浙江省洞头县东海海域。
1.2 仪器与设备
FOX-4000电子鼻 法国Alpha MOS公司;固相微萃取装置[手动进样手柄、萃取头(聚二甲基硅氧烷/二乙烯苯(PDMS/DVB),涂层厚度65μm)] 美国Supelco公司;GC 6890-MS5975气质联用仪 美国Agilent公司。
1.3 样品制备方法
1.3.1 电子鼻法
分别准确称取经搅碎的坛紫菜2.0g,加2.0mL 0.18 g/mL NaCl溶液,匀浆后置于10mL进样瓶中。
1.3.2 HS-SPME法[11]
分别准确称取经搅碎的坛紫菜2.5g,加2.5mL 0.18 g/mL NaCl溶液,匀浆后置于含有微型搅拌子的15mL顶空瓶中,然后进行固相微萃取。
1.4 实验条件
1.4.1 电子鼻条件
样品温度4.0℃,清洗时间120s,测样时间600s;载气:合成干燥空气;流速:150mL/min;顶空产生参数:产生时间600s、产生温度60℃、搅动速度500r/min;顶空注射参数:注射体积2500μL、注射速度2500μL/s、注射针总体积2.5mL、注射针温度70℃;获取参数:获取时间120s、延滞时间600s。每个样品均在上述条件下重复分析5次。
1.4.2 顶空固相微萃取条件
采用65μm PDMS/DVB萃取头,萃取温度60℃,萃取时间40min,0.18g/mL NaCl溶液,磁力搅拌,选用中速(500~700r/min)。
1.4.3 色谱条件
色谱柱:DB-35弹性毛细管柱(30m×0.25mm,0.25μm);程序升温:柱初温40℃,保持2min,以5℃/min升至150℃,保持2min,以10℃/min升至230℃,保持10min;进样口温度250℃;载气(He)流量1.0mL/min;解吸时间5min,解吸温度250℃。不分流模式进样。
1.4.4 质谱条件
传输线温度280℃;离子源温度230℃;四极杆温度150℃;电子能量70eV;质量扫描范围:m/z 35~350。挥发性成分通过NIST 02质谱数据库确认定性。
1.5 数据处理
1.5.1 电子鼻数据处理
用主成分分析(principal component analysis,PCA)对实验数据进行分析。
1.5.2 GC-MS数据处理
实验数据处理由Xcalibur软件系统完成。挥发性成分通过NIST和Wiley谱库确认定性,且仅当正反匹配度均大于800(最大值为1000)的鉴定结果才予以报道。通过Excel数据处理系统,按面积归一化法求得各化学成分在坛紫菜挥发性成分中的相对含量。
2 结果与分析
2.1 电子鼻法分析不同收割期坛紫菜的挥发性成分
2.1.1 不同坛紫菜响应值的比较

图1 不同坛紫菜的响应值比较Fig.1 Comparison on response values of laver harvested in different time points
从图1可以看出,检测每个样品的传感器响应强度的最大值均达到了0.5以上,满足了对电子鼻检测样品的响应值要求;除传感器TA/2和T40/1响应值十分接近外,LY2/LG传感器例外(二水最大,然后依次为四水、三水及一水),大部分传感器的响应值均为四水坛紫菜最大,三水坛紫菜次之,然后是两水紫菜和一水坛紫菜,说明随收割期的延后挥发性成分总量增加;从图中还可以看出一水和二水坛紫菜的挥发性成分精确度较好,即挥发性成分变化差异小,因此适宜加工为产品,这样产品的风味容易控制;而三水和四水坛紫菜挥发性成分变化差异就较大,这样生产的产品风味就可能差异较大,产品质量较难控制,因此实际生产中多采用一水和二水坛紫菜作为原料。
2.1.2 不同收割期坛紫菜的主成分分析
主成分分析(PCA)是一种设法将原来指标重新组合成一组新的互相无关的几个综合指标来代替原来指标,同时根据实际需要从中可去除几个较少的综合指标,以尽可能多地反映原来指标,通过改变坐标轴来达到区分样品目的的分析方法。经PCA分析所得的图主要是以二维散点图来显示,其中PCA1和PCA2包含了在PCA转换中所得到的第一主成分和第二主成分的贡献率。贡献率越大,说明主要成分可以较好的反映原来多指标的信息。一般情况下,PCA1+PCA2即总贡献率超过70%~85%的方法即可使用[12-13]。收割期坛紫菜PCA分析结果见图2。

图2 不同坛紫菜的电子鼻PCA分析结果Fig.2 PCA of response values determined by electronic nose in laver harvested in different time points
PCA分析结果图2中所显示的判别指数(DI),是对选定目标的判别质量给出一个评价,通过计算各个组之间的表面积和每个组的表面积得到的。判别指数为正,说明各个组之间互相独立,且最大值100,越接近100说明效果越好。判别指数为负,说明各组间重叠。本实验的DI为53,说明电子鼻可以较好的区分不同收割期的坛紫菜。
2.2 SPME-GC-MS分析坛紫菜挥发性物质
2.2.1 不同坛紫菜的GC-MS总离子峰图
不同坛紫菜挥发性成分的GC-MS色谱图如图3所示,总离子峰图表明HS-SPME法可以较好的吸附坛紫菜样品中的挥发性成分,并可以通过 GC-MS对挥发性成分进行分析检测。
2.2.2 不同坛紫菜挥发性成分的鉴定

图3 不同收割期坛紫菜挥发性成分总离子峰图Fig.3 Total ion current of volatile compounds in laver harvested in different time points
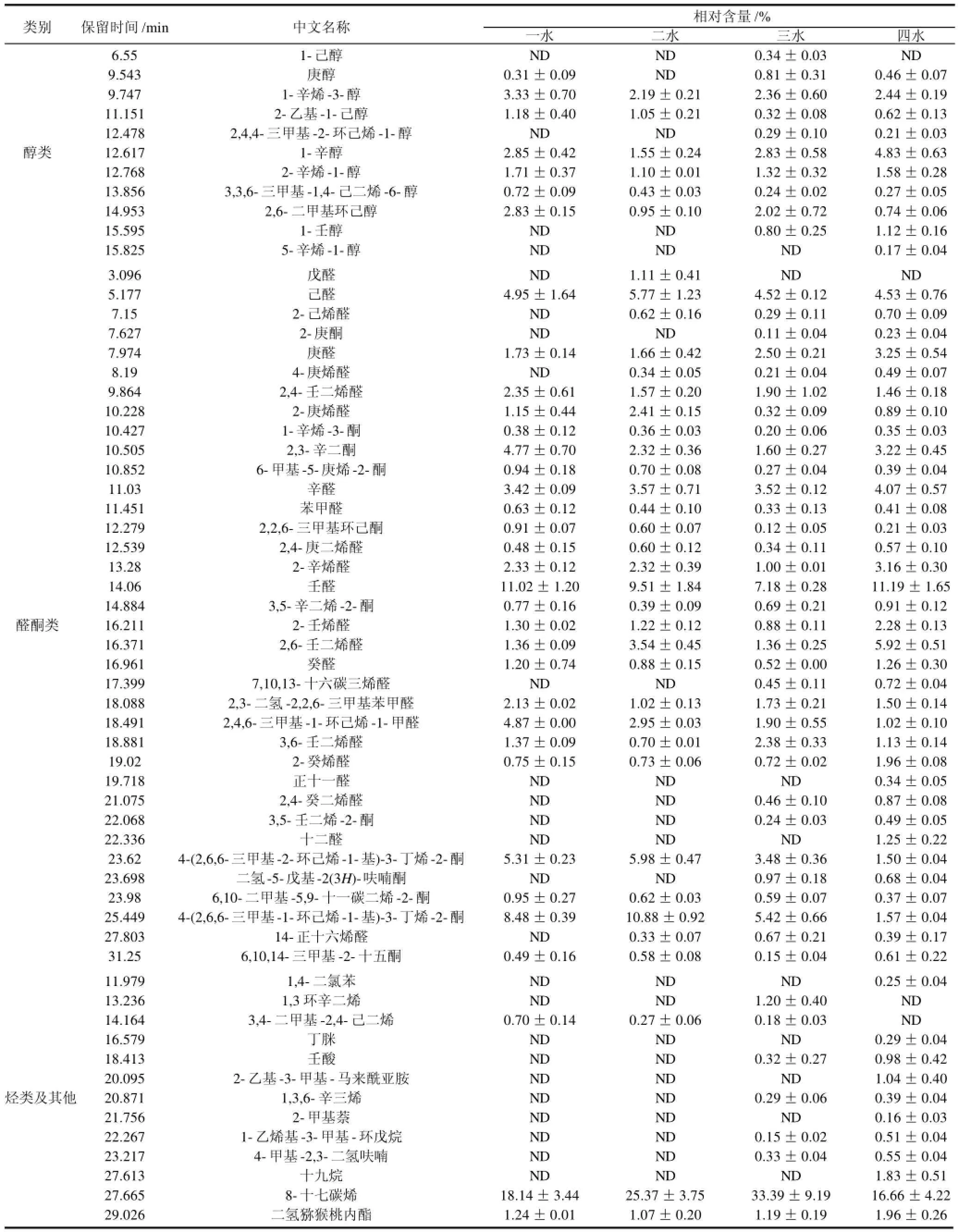
表1 不同收割期坛紫菜挥发性成分的含量比较Table1 Contents of volatile components in laver harvested in different time points
经NIST图库检索以及文献参考确认[11,14-15],一水坛紫菜确定出35种挥发性物质,二水坛紫菜确定出38种,三水坛紫菜确定出51种,四水坛紫菜确定出55种挥发性物质,其中33种为4种紫菜共有的挥发性化合物。由于各收割期紫菜的挥发性成分中均有少量物质未定性,因此按面积归一化法求得各收割期紫菜中确定的挥发性成分分别占各自有效总挥发性成分的百分含量为97.01%、97.69%、95.43%和96.72%;按面积归一化法求得各化学成分在不同收割期坛紫菜挥发性成分中的相对含量的具体结果见表1。
从表1可以看出,在确认的挥发性物质中,羰基化合物和烃类化合物为坛紫菜的主要挥发性化合物。与其他水产品的气味成分多由挥发性羰基化合物和醇组成不同[16-18],挥发性羰基化合物所产生原生的、浓郁的香味,而挥发性醇所产生品质较为柔和的气味[19],烃类中主要是以8-十七碳烯为最主要挥发性化合物,二氢猕猴桃内酯含量也较高。一般来说羰基化合物的阈值较低,因此对气味贡献较大,这些醛类物质通常被认为是红藻特征性风味的主要贡献物质,可能是以C18与C20不饱和脂肪酸为底物的酶反应生成的[20-22];而醇类的阈值就稍高,因此只有高含量的醇类才会对气味产生较大的影响;而烃类的阈值就更加高些,因此对于气味贡献就更小,除非含量很高,而对于坛紫菜来说,8-十七碳烯含量就很高,因此其对坛紫菜的气味的影响应比较大,8-十七碳烯是酶促反应生成的一类化学感应物质,作为生物信息素在愈伤中起到一定的作用[22]。结合含量和阈值来说,8-十七碳烯、壬醛和己醛是坛紫菜中主要的挥发性物质,4-(2,6,6-三甲基-1-环己烯-1-基)-3-丁烯-2-酮、4-(2,6,6-三甲基-2-环己烯-1-基)-3-丁烯-2-酮、辛醛、2,3-辛二酮、2,6-壬二烯醛、2,4-壬二烯醛、庚醛、2-辛烯醛、2,4,6-三甲基-1-环己烯-1-甲醛等醛酮类物质和1-辛烯-3-醇、1-辛醇、二氢猕猴桃内酯等对坛紫菜的气味也有较大贡献。
2.3 不同坛紫菜挥发性成分的比较
从电子鼻实验可以得出不同收割期的坛紫菜挥发性成分差异明显,可以用电子鼻区分,从响应值来看,随着收割期的延后,挥发性成分的总量增加;从响应值和PCA结果还可以得出一水坛紫菜的质量最好,其平行样本间差异较小,因此采用一水坛紫菜作出的产品风味的稳定性较好,产品质量容易控制,相对来说二水坛紫菜要稍差些,但差异只是比一水坛紫菜稍大;而三水坛紫菜间差异就非常明显,四水坛紫菜间的差异较三水要小些,但也比一水和二水大许多。
而GC-MS的结果也说明了类似的问题,总体来说一水和二水坛紫菜的相对含量的标准偏差要小,三水和四水坛紫菜的标准偏差较大。从挥发性成分的数量来说,随着收割期的延后,挥发性化合物的种类也增多,并且一水和二水坛紫菜的挥发性成分以羰基化合物为主,烃类虽然8-十七碳烯含量也很高,但是除羰基化合物和醇类外,烃类数量很少,只有8-十七碳烯、3,4-二甲基-2,4-己二烯两种,三水和四水坛紫菜中化合物的种类羰基化合物和醇类只是少量增加,最主要的是增加许多烃类及其他挥发性物质,这些物质可能是引起三水和四水坛紫菜气味不稳定的原因。当然对于紫菜的气味研究还应当结合感官分析,本实验主要通过电子鼻和SPME-GC-MS客观上分析了不同收割期坛紫菜的挥发性成分差异,坛紫菜的特征(关键)挥发性成分还应当结合感官分析等进一步确定,但是从挥发性成分含量及阈值来说,8-十七碳烯、壬醛、己醛、4-(2,6,6-三甲基-1-环己烯-1-基)-3-丁烯-2-酮、4-(2,6,6-三甲基-2-环己烯-1-基)-3-丁烯-2-酮、辛醛、2,3-辛二酮、2,6-壬二烯醛、2,4-壬二烯醛、庚醛、2-辛烯醛、2,4,6-三甲基-1-环己烯-1-甲醛等醛酮类物质和1-辛烯-3-醇、1-辛醇、二氢猕猴桃内酯等化合物将是研究坛紫菜的特征(关键)挥发性成分的重点对象。具体上述物质在坛紫菜气味中所发挥的作用还有待于进一步的研究。
3 结 论
3.1 通过电子鼻检测分析,不同收割期的坛紫菜挥发性成分差异明显,可以被电子鼻区分,且随收割期的延后挥发性成分总量增加,可以利用电子鼻仪器对不同收割期(或品质)的坛紫菜进行鉴别。
3.2 通过GC-MS分析,鉴定出35、38、51、55种化合物,通过归一化法求出鉴定的成分分别占有效峰面积的97.01%、97.69%、95.43%、96.72%,其中以醛酮类和烷烃类为主,8-十七碳烯、壬醛和己醛是坛紫菜中主要的挥发性物质。
3.3 不同收割期紫菜挥发性成分的稳定程度GC-MS实验结果与电子鼻结果趋于一致,总体来说一水和二水坛紫菜的挥发性成分差异较小;三水和四水间的紫菜挥发性成分差异较大,因此从产品质量稳定的角度来说,坛紫菜产品宜采用一水和二水坛紫菜作为原料。
[1]张鹏, 张源, 王铁杆, 等. 坛紫菜不同品系亲缘关系的SSR标记分析[J]. 中国水产科学, 2009, 16(6): 842-849.
[2]应苗苗, 施文正. 紫菜不同收割期营养成分的研究[J]. 浙江农业科学, 2009, 21(6): 1227-1228.
[3]陈必链, 林跃鑫, 黄键. 坛紫菜的营养评价[J]. 中国海洋药物, 2001, 20(2): 51-53.
[4]PAWLISZYN J. New directions in sample preparation for analysis of
organic compounds[J]. Journal of Analysis Chemistry, 1995, 14(3): 113-122.
[5]STEPHAN A, BUCKING M, STEINHART H. Novel analytical tools for food flavours[J]. Food Research International, 2000, 33: 199-209.
[6]赵钰玲, 李菊白, 戚欢阳, 等. 顶空固相微萃取-气相色谱-质谱联用快速分析八角茴香中风味物质[J]. 分析实验室, 2006, 25(9): 22-26.
[7]毕丽君, 高宏岩. 电子鼻(EN)及其在多领域中的应用[J]. 医学信息, 2006(7): 1283-1286.
[8]邹小波, 赵杰文. 电子鼻在饮料识别中的应用研究[J]. 农业工程学报, 2002, 18(3): 146-149.
[9]RAJAMAKI T, ALAKOMI H L, RITVANEN T, et al. Application of an electronic nose for quality assessment of modified atmosphere packaged poultry meat[J]. Food Control, 2006, 17(1): 5-13.
[10]RENATA B, PETRAS R V, ALGIRDAS G. Testing of microencapsulated flavours by electronic nose and SPME-GC[J]. Food Chem, 2005, 92: 45-54.
[11]伊纪峰, 朱建一, 韩晓磊, 等. HS-SPME-GC /MS联用检测红毛菜中的挥发性成分[J]. 南京师范大学学报, 2009, 32(2): 103-107.
[12]陈章玉. 茶叶香味扫描和挥发性化学成分分析[J]. 分析化学, 2005, 33(8): 1185-1187.
[13]王钦德, 杨坚. 食品试验设计与统计分析[M]. 北京: 中国农业大学出版社, 2010: 385.
[14]宋国新, 余应新, 王林详, 等. 香气分析技术与实例[M]. 北京: 化学工业出版社, 2008: 428-431.
[15]陈婉珠, 芮汉明, 张玲. 海带腥味物质的HS-SPME-GC-MS分析[J].食品工业科技, 2006, 27(12): 71-73.
[16]JOSEPHSON D. Enzymic hydroperoxide initiated effects in fresh fish[J]. J Food Sci, 1985, 52: 596-600.
[17]JOSEPHSON D B, LINDSAY R C. Volatile compounds characterizing the atoma of fresh atlantic and pacific oysters[J]. J Food Sci, 1987, 50: 5-9.
[18]DAVID B, JOSEPHSON D. Identifictation of compounds characterizing the aroma of fresh whitefish[J]. J Agric Food Chem, 1983, 31: 326-330.
[19]WURZENBERGER M, GROSCH W. Stereochemistry of the cleavage of the 10-hydroperoxide isomer linoleic acid to 1-octen-3ol by a hydroperoxidel yase from mushrooms (Psaillota bispora)[J]. J Biochem Bophys Acta, 1984, 795: 163-165.
[20]BOONPRAB K, MATSUI K, AKAKABE Y, et al. Formation of aldehyde flavor (n-hexanal, 3Z-nonenal and 2E-nonenal) in the brown alga, laminaria angustata[J]. Journal of Applied Phycology, 2006, 18(3): 409-412.
[21]KANGSADAN B, KENJIM, YOSHIHIKO A, et al. Hydroperoxy-arachidonic acid mediated n-hexanal and (Z)-3- and (E)-2-nonenal formation in Laminaria angust[J]. Phytochemistry, 2003, 63(6): 669-678.
[22]AKAKABE Y, IWAMOTO S, MIYAMURA S, et al. Induction of (Z)-8-heptadecene in marine green alga Bryopsis maxima by mechanical wounding[J]. Fisheries Science, 2007, 73(5): 1057-1060.
Analysis of Volatile Components in Laver Harvested in Different Time Points
YING Miao-miao1,SHI Wen-zheng2,*,LIU En-ling1
(1. Wenzhou Vocational College of Science & Technology, Wenzhou 325000, China;2. College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
In this study, volatile components in laver were identified by electronic nose and SPME-GC-MS. Results indicated that electronic nose could discriminate the volatile components in laver harvested in different time points and SPME could effectively extract the volatile components from laver. According to the analysis of GC-MS, 35, 38, 51 and 55 kinds of volatile compounds were identified in laver harvested in the first, second, third and fourth time, respectively. Among these compounds, volatile carbonyl compounds and alkanes such as 8-heptadecene, nonanal and hexanal were the major volatile compounds in laver. Moreover, compared with the laver harvested in the third and fourth time, the quality of laver was more stable and less change of odor was observed in laver harvested in first and second time. Therefore, the laver harvested in first and second time is suitable for food development.
laver;electronic nose;SPME-GC-MS;volatile component;harvest time point
TS254.1
A
1002-6630(2010)22-0421-06
2010-06-30
应苗苗(1983—),女,讲师,硕士,主要从事食品科学研究。E-mail:mmying0120@163.com
*通信作者:施文正(1975—),男,讲师,博士,主要从事水产品加工及风味研究。E-mail:wzshi@shou.edu.cn
