虎杖中白藜芦醇发酵和提取工艺
2010-03-23周建军刘益红
曹 亮,周建军*,魏 锐,刘益红
(陕西理工学院生物科学与工程学院,陕西 汉中 723001)
虎杖中白藜芦醇发酵和提取工艺
曹 亮,周建军*,魏 锐,刘益红
(陕西理工学院生物科学与工程学院,陕西 汉中 723001)
目的:对虎杖中白藜芦醇的发酵和提取工艺进行研究。方法:以汉中地区的虎杖为原料,通过正交试验研究虎杖中白藜芦醇自然发酵和提取条件。结果:最佳发酵条件为温度45℃、料液比1:3、发酵时间48h、白藜芦醇苷的转化率为96.1%;自然发酵后最佳提取条件为98%甲醇、料液比1:6、提取3次、每次1h,白藜芦醇的得率达1.912%;通过发酵和提取,虎杖中白藜芦醇的提取率达90%。结论:本实验可为虎杖中白藜芦醇的发酵和提取提供一定参考。
虎杖;白藜芦醇;白藜芦醇苷;发酵
虎杖(Polygonum cuspidatum Sieb.et.Zucc)为蓼科多年生灌木状草本植物,主要分布于我国长江以南各地和陕西、湖北及四川等地。虎杖含多种有效成分,主要包括蒽醌和芪类化合物,其中芪类化合物中的白藜芦醇具有重要生物活性[1-3]。
白藜芦醇(Res)化学名3,4,5-三羟基-二苯乙烯,分子式C14H12O3,熔点256~257℃。易溶于极性溶剂如甲醇、乙醇、乙酸乙酯等[4-5]。在植物体内主要以白藜芦醇苷(PDT)形式存在。
目前,虎杖中白藜芦醇提取方法主要有两类,一类是先提取白藜芦醇苷,然后再利用专一性酶[6-7]将白藜芦醇苷转化为白藜芦醇,但在提取纯化苷的过程中,原有的部分白藜芦醇会丢失;另外一类方法是采用专一性酶[8]或是筛选专一性微生物[9]先将虎杖发酵使白藜芦醇苷转化为白藜芦醇,然后再提取纯化,虽然避免了虎杖中原有白藜芦醇的损失,但操作繁琐,成本较高。也有报道[10]利用虎杖中微生物产生的酶进行发酵,但对于发酵后的提取工艺报道各异。本实验先将虎杖进行自然发酵,然后重点对提取工艺进行研究,通过优化发酵条件及提取工艺,为白藜芦醇工业化生产提供依据。
1 材料与方法
1.1 材料与试剂
虎杖(经陕西理工学院赵桦教授鉴定)产自秦岭南坡中段汉中市留坝县生产基地,先将虎杖切片,40℃干燥至质量恒定,用中药粉碎机粉碎成细粉备用。经索氏提取,HPLC测定,虎杖中白藜芦醇苷的含量3.70%,白藜芦醇含量0.27%。
甲醇(分析纯)、乙腈(色谱纯);超纯水 自制;白藜芦醇苷对照品、白藜芦醇对照品 中国生物制品研究所。
1.2 仪器与设备
高效液相色谱仪 美国Waters公司;302型电热鼓风干燥箱 山东潍坊医药集团股份有限公司医疗器械厂;FW-177型中药粉碎机 天津市泰斯特仪器有限公司;AB204型电子天平 瑞士Mettler Toledo公司;恒温气候箱、SHH421-420型恒温水浴锅 河北航天仪器厂。
1.3 方法
1.3.1 检测方法
1.3.1.1 液相色谱条件
参考周建军等[11-12]的检测方法:色谱柱Symmertry-C18(3.9mm×150mm),流动相乙腈-水(19.5:80.5),流速1.0mL/min,柱温28℃,检测波长303nm,进样量10μL,保留时间14min。
1.3.1.2 对照品溶液的制备
精确称量白藜芦醇苷4.0mg和白藜芦醇3.0mg,分别置于100mL容量瓶中,加适量甲醇,超声溶解,再定容至刻度,摇匀,作为对照品储备液(白藜芦醇苷质量浓度为40μg/mL,白藜芦醇质量浓度为30μg/mL)。
将储备液配成5个不同质量浓度的混合液作为对照品溶液:1)白藜芦醇苷质量浓度为4.00μg/mL,白藜芦醇质量浓度为27.00μg/mL的对照品溶液;2)白藜芦醇苷质量浓度为8.00μg/mL,白藜芦醇质量浓度为21.00μg/mL的对照品溶液;3)白藜芦醇苷质量浓度为12.0μg/mL,白藜芦醇质量浓度为15.00μg/mL的对照品溶液;4)白藜芦醇苷质量浓度为16.00μg/mL,白藜芦醇质量浓度为9.00μg/mL的对照品溶液;5)白藜芦醇苷质量浓度为20.00μg/mL,白藜芦醇质量浓度为3.00μg/mL的对照品溶液。
1.3.1.3 标准曲线的建立
将5个不同质量浓度的白藜芦醇苷和白藜芦醇对照品混合液依次分别进样10μL,记录峰面积,以峰面积(Y)为纵坐标、以质量浓度(X)为横坐标,用直线回归方程的方法建立标准曲线,白藜芦醇苷的直线方程为:Y=34983X+3570(r2=0.99991),其质量浓度在4.00~20.00 μg/mL范围内,线性关系良好;白藜芦醇的直线方程为:Y=57938X+19801(r2=0.99994),其质量浓度在3.00~27.00μg/mL范围内,线性关系良好。
1.3.1.4 供试品溶液的制备
精确称取虎杖粉末10.00g,按照一定的料液比加水,在恒温培养箱中按照设定的温度发酵,然后将发酵物按比例加入溶剂,回流提取3次,合并3次滤液,精确吸取滤液1mL,用甲醇定容到10mL,用0.45μm样品过滤器过滤,待测。
1.3.1.5 含量测定
样品溶液在与标准曲线相同的色谱条件下进样,重复3次,根据标准曲线计算出样品中白藜芦醇苷及白藜芦醇的含量,样品色谱图见图1。

图1 样品液相色谱图Fig.1 Chromatogram of the sample
1.3.2 试验设计
1.3.2.1 发酵条件的选择
根据瞿卫林[13]的报道和曹庸[14]的专利,选择发酵时间、温度、料液比为考察因素,设计正交试验进行发酵条件的选择,并根据最优条件进行验证性实验。因素水平见表1。

表1 发酵条件正交试验因素水平Table1 Factors and levels of orthogonal experiments for optimizing fermentation conditions
1.3.2.2 提取条件的选择
按最佳发酵条件进行发酵后,选择甲醇体积分数、料液比、提取次数和提取时间作为考察因素,进行正交试验,选择最佳提取条件,并根据最佳提取条件进行验证性实验。因素水平见表2。
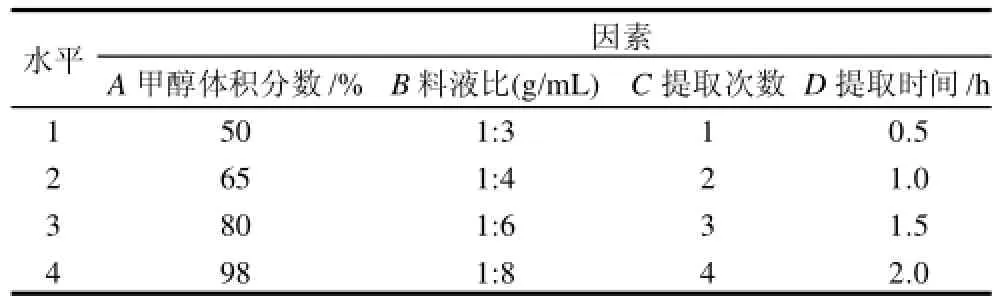
表2 提取条件正交试验因素水平Table2 Factors and levels of orthogonal experiments for optimizing extraction conditions
2 结果与分析
2.1 发酵条件正交试验
发酵条件正交试验结果和方差分析见表3、4。

表3 发酵条件正交试验设计及结果Table3 Design and results orthogonal experiments for optimizing fermentation conditions
从发酵正交试验结果和极差分析看出,各因素的影响顺序为发酵时间>温度>料液比,通过对白藜芦醇发酵条件的选择以及经济效益的综合考虑,可以得出白藜芦醇发酵的最佳条件:料液比1:3、温度45℃、发酵时间48h。

表4 发酵条件正交试验结果方差分析Table4 Variance analysis of orthogonal experiments for optimizing fermentation conditions
方差分析表明:发酵时间对白藜芦醇含量的影响极显著(F>F(0.01)),发酵温度对白藜芦醇含量的影响显著(F(0.01)>F>F(0.05)),而料液影响不显著(F<F(0.05))。
2.2 发酵条件验证性实验
根据发酵正交试验最佳工艺,进行验证性实验(n=3),结果见表5。

表5 发酵条件验证性实验结果Table5 Results of confirmatory experiments for optimizing fermentation conditions
表5结果表明,经过发酵白藜芦醇苷的转化率达96.1%[(3.683-0.143)/3.683],表明虎杖中绝大部分白藜芦醇苷已转化为白藜芦醇。
2.3 提取条件正交试验结果
提取条件正交试验结果和方差分析见表6、7。

表6 提取条件正交试验设计及结果Table6 Design and results orthogonal experiment for optimizing extraction conditions

表7 提取条件正交试验结果方差分析Table7 Variance analysis of orthogonal experiments for optimizing extraction conditions
从提取条件正交试验结果和极差分析看出,各因素的影响顺序为甲醇体积分数>提取次数>料液比>提取时间,得出虎杖发酵后白藜芦醇的最佳提取条件:98%甲醇、料液比1:6、提取3次、每次1 h。
方差分析表明,甲醇体积分数对发酵后提取影响极显著(F>F(0.01)),提取次数和料液比影响显著(F(0.01)>F>F(0.05)),而提取时间影响不显著(F<F(0.05))。
2.4 提取条件验证性实验
根据提取正交试验确定的最佳工艺,精确称取虎杖粉末10.00g,进行3次验证性实验,结果见表8。
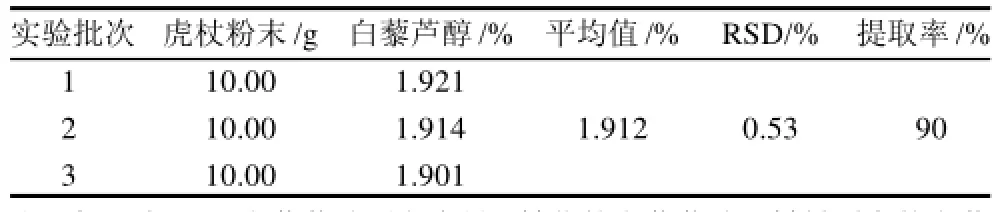
表8 提取条件验证性实验结果Table8 Results of confirmatory experiments for optimizing extraction conditions
表8表明,虎杖发酵后白藜芦醇提取的平均得率1.912%,RSD值0.53%。说明本实验能将大部分白藜芦醇提取出来,并且结果稳定。
3 讨论与结论
采用干虎杖加水自然发酵,不需要专一性的酶和培养专一性的微生物,降低了成本、简化了工艺。通过正交试验得出白藜芦醇的最佳发酵条件:温度45℃、料液比1:3、发酵时间48h;白藜芦醇苷的转化率达96.1%,这与瞿卫林[13]等的报道基本一致。
通过正交试验得出白藜芦醇的最佳提取条件:98%甲醇、料液比1:6、提取3次、每次1h。虎杖中白藜芦醇的得率为1.912%,提取率达90%,结果远远高于向海艳[15]和董学伟[6]等的报道。本实验结果为白藜芦醇的工业化生产提供了参考依据。
[1]周建军. 虎杖中二苯乙烯类化合物药理作用研究进展[J]. 西北药学杂志, 2000, 15(2): 86-87.
[2]刘培勤, 郭传勇. 白藜芦醇药理作用的研究进展[J]. 医药导报, 2006, 25(6): 524-525.
[3]王燕. 白藜芦醇的生物学功能及其应用前景[J]. 中国饲料, 2006(16): 22-24.
[4]王永红, 何丽君, 李生英, 等. 白藜芦醇[J]. 甘肃高师学报, 2009, 14 (2): 54-56.
[5]郑乾刚, 方志杰, 高军峰. 白藜芦醇的药理活性及制备方法[J]. 化学试剂, 2006, 28(2): 75-78.
[6]董学伟, 余慧琳, 陈莉, 等. 酶转化虎杖苷制备白藜芦醇[J]. 食品与发酵工业, 2008, 34(12): 122-124.
[7]宁静恒, 向海艳. 酶法提取虎杖中白藜芦醇和大黄素工艺研究[J]. 茂名学院学报, 2008, 18(3): 15-18.
[8]林玉叶, 易跃能. 酶解法提取虎杖中白藜芦醇[J]. 中南药学, 2009, 7 (4): 262-265.
[9]吕之尧, 郭崇华. 微生物酶法从虎杖中提取白藜芦醇的研究[J]. 食品科学, 2008, 29(5): 283-286.
[10]邹贤德, 舒鑫. 提取中药虎杖中白藜芦醇含量的方法: 中国, CN1385535[P]. 2002.
[11]周建军, 张宏杰, 杨培君, 等. 汉中地区虎杖中白藜芦醇甙及甙元含量的测定[J]. 中草药, 2002, 33(5): 414-416.
[12]曹亮, 周建军, 张琳. 不同生长年限虎杖中白藜芦醇苷及苷元含量比较[J]. 中成药, 2009, 31(6): 897-900.
[13]瞿卫林, 陈晓祥, 赵伯涛, 等. 酶解法提高虎杖中白藜芦醇含量的研究[J]. 中国野生植物资源, 2005, 24(4): 52-55.
[14]曹庸, 于华忠. 微生物转化虎杖材料提取高纯白藜芦醇的工艺: 中国, CN1896255[P]. 2006.
[15]向海艳, 戴开金, 罗奇志. 酶解法对提取虎杖中白藜芦醇的应用及工艺优化[J]. 中南大学学报: 自然科学版, 2008, 39(4): 700-704.
Fermentation and Extraction of Resveratrol from Polygonum cuspidatum
CAO Liang,ZHOU Jian-jun*,WEI Rui,LIU Yi-hong
(School of Bioscience and Engineering, Shaanxi University of Technology, Hanzhong 723001, China)
Objective: To explore the fermentation and extraction processing of resveratrol from Polygonum cuspidatum. Methods: Polygonum cuspidatum from Hanzhong area was used as the material to explore the optimal fermentation and extraction conditions of resveratrol by orthogonal experiments. Results: The optimal conditions for fermentation were fermentation temperature of 45 ℃, material-liquid ratio of 1:3, and fermentation time of 48 h. The conversion rate of polydatin was 96.1% under the optimal fermentation conditions. The optimal conditions for the extraction of resveratrol were 98% methanol as solvent, solid-liquid ratio of 1:6, extraction time of 1 h, and extraction repeat number of 3. The yield of resveratrol was 1.912% under the optimal extraction conditions. The extraction rate of resveratrol could reach up to 90% through optimal fermentation and extraction. Conclusion: These studies provide a theoretical reference for the fermentation and extraction of resveratrol from Polygonum cuspidatum.
Polygonum cuspidatum Sieb.et.Zucc;resveratrol;polydatin;fermentation
TQ214
A
1002-6630(2010)22-0207-04
2010-06-23
曹亮(1984—),男,硕士研究生,研究方向为植物资源开发与利用。E-mail:phas0614@tom.com
*通信作者:周建军(1953—),男,教授,硕士,研究方向为生物资源开发利用。E-mail:jjzhou01@163.com
