产共轭亚油酸植物乳杆菌的筛选、鉴定与诱变
2010-03-23沈生荣马鎏镠何国庆
刘 佩,周 倩,沈生荣,阮 晖,马鎏镠,何国庆*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
产共轭亚油酸植物乳杆菌的筛选、鉴定与诱变
刘 佩,周 倩,沈生荣,阮 晖,马鎏镠,何国庆*
(浙江大学生物系统工程与食品科学学院,浙江 杭州 310029)
从传统泡菜中筛选得到1株乳酸菌lp15能够合成共轭亚油酸(CLA),经16S rRNA全序列分析法和API系统鉴定法鉴定为植物乳杆菌(Lactobacillus plantarum)。利用人工诱变方法,以lp15为出发菌株,采用紫外线、硫酸二乙酯(DES)依次诱变处理,经进一步液体发酵复筛获得多株突变菌株,CLA合成能力较出发菌株提高了29.3%~52.2%。其中lp15-2-1突变菌株为CLA生成能力最高菌株,MRS培养液中添加0.2mg/mL LA培养48h,CLA产量达30.13μg/mL。经气相色谱(GC)检测分析,产物中cis9, trans11-共轭亚油酸(c9, t11-CLA)占76.5%,trans10, cis12-共轭亚油酸(t10,c12-CLA)占23.5%。
共轭亚油酸;植物乳杆菌;鉴定;诱变;气相色谱
共轭亚油酸(conjugated linoleic acid,CLA)是含有顺式或反式共轭双键的十八碳二烯酸,是亚油酸的一组位置和构象异构体的总称。其中CLA的两种异构体cis9, trans11-共轭亚油酸(c9,t11-CLA)和trans10, cis12-共轭亚油酸(t10,c12-CLA)具有重要的生理功能,比如抗癌(结肠癌、胃癌、乳腺癌、前列腺癌)、提高细胞免疫、降低体脂含量、预防糖尿病的发生以及抑制动脉粥样硬化等[1-2]。自然界中CLA主要来源于瘤胃动物肉及奶制品,且CLA的含量随着动物品种、饲养方式及饲养条件的改变而不同[3];人乳中CLA含量为0.29%~0.71%,马乳中为0.05%~0.12%,猪乳中为0.19%~0.27%,而海产品和菜籽油中含量较低,分别为0.03%~0.06%和 0.01%~0.07%。奶及肉制品所含的CLA中,c9,t11-CLA异构体约占75%~90%;而菜籽油中约有50%是c9,t11-CLA,40%是t10,c12-CLA[4-6]。
目前化学法合成法仍是商业CLA的主要来源,此法所得的CLA中含有约40%的c9,t11-CLA和t10,c12-CLA异构体,但其中仍含有大量的其他异构体及有毒物质,活性异构体的分离纯化及应用成本较高[7]。1967年首次报道Butyrivibrio fibrisolvens能够合成CLA[8],之后不少研究报道多种微生物能够发酵合成CLA[9-11],其中包括Propionibacterium reudenreichii、Streptococcus salivarius、Lactococcus lac tis、L. d elbrueckii、L. casei、L. acidophilus、L. fermentum、L. reuterii、L.
plantarum等,均能将亚油酸(LA)转化为CLA(产物主要为c9,t11-CLA和t10,c12-CLA)[12-19]。在CLA合成过程中起主要作用的是亚油酸异构酶,这种酶主要作用在C9和C10位上,主要作用产物为c9,t11-CLA和t10,c12-CLA,并且从P. freudenreichii、P. acidipropionici、P. ac nes、L. acido philus、L. reuterii、Clostridium sporogenes、B. fibrisolvens、Eubacterium lentum等多种微生物中都分离得到了这种酶[20]。由于B. fibrisolvens和C. sporogenes属于严格厌氧菌,而P. acnes则是致病菌,它们在工业生产上的应用价值极低。而大量乳酸菌能够转化合成CLA,这为CLA的微生物合成在工业生产上的应用开辟了广阔的前景[21-23]。
本实验从传统泡菜中筛选有较高合成CLA能力的乳酸菌株,对菌株进行诱变和菌种鉴定,并对产物进行气相色谱分析以确定CLA组成,以期为共轭亚油酸微生物转化合成提供一定的参考。
1 材料与方法
1.1 材料与试剂
泡菜 市售;硫酸二乙酯(DES) 厦门宏达国际贸易有限公司;硫代硫酸钠(SDS) 天津昊路成化工有限公司;亚油酸、共轭亚油酸、亚油酸甲酯、共轭亚油酸甲酯混合标样(c9,t11-CLAMe和t10,c12-CLAMe) Sigma公司;API 50 CHL液体培养基和API 50 CH菌种鉴定试剂条 上海祥和科学技术有限公司;Ex Taq酶、dNTPs Takara宝生物工程(大连)有限公司;PCR(聚合酶链式反应)引物:在以大肠杆菌(E. coli)16S rRNA通用引物27F"和1492R"的基础上,进行个别调整,得到引物16S rRNA 5':AGAGTTTGATCCTGGCTCAG;16S rRNA 3':GGTTACCTTGTTACGACTT,由上海生工生物工程技术服务有限公司合成。
1.2 仪器与设备
TU-1801双光束紫外-可见分光光度计 北京普析通用仪器有限责任公司;安捷伦7890气相色谱仪(配有FID检测器) 美国安捷伦科技有限公司; PTC0220 PCR仪伯乐生命医学产品有限公司;JS-380A自动凝胶图像分析仪 杭州诺丁科学器材有限公司。
1.3 方法
1.3.1 菌种分离
将泡菜汁接种于MRS肉汤液体培养基中,增殖培养后,倾注法倒MRS琼脂平板,30℃培养后,挑取单菌落接种于MRS琼脂斜面上保存。
1.3.2 产共轭亚油酸菌种的筛选
标准曲线制作:将CLA标样溶于正己烷,配制成不同质量浓度的溶液,以正己烷为空白对照,测定233nm波长处的紫外吸光度(A),以共轭亚油酸质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线[24]。
发酵培养:菌株在MRS液体培养基中30℃条件下活化两次。厌氧试管(15mm×160mm)中装入10mL MRS培养基,LA添加量为0.2mg/mL,菌种接种量为1%(体积分数),接种后30℃条件下150r/min分别振荡培养24h。
脂肪酸的提取:正己烷萃取发酵液,萃取液水洗两次,加入无水硫酸钠吸水干燥,氮气吹干。
紫外分光光度计检测:将脂肪酸提取物用3mL正己烷溶解,于233nm波长处测定吸光度,空白对照为与发酵培养条件相同的MRS(LA添加量为0.2mg/mL)培养液的正己烷提取液[24]。
气相色谱检测:在上述脂肪酸提取物中加入5mL 体积分数5%的盐酸-甲醇溶液,100℃反应1h,再用5mL正己烷萃取脂肪酸甲酯,正己烷层用无菌水洗涤后,无水硫酸钠干燥,氮气吹干,用100μL正己烷重新溶解后,气相色谱检测[25];色谱条件如下:色谱柱:安捷伦HP-88毛细管柱(60m×0.25mm,0.20μm);升温程序:90℃保持5min,以10℃/min升至180℃,保持10min;再以5℃/min升至220℃,保持15min;再以5℃/min升至250℃,保持5min;载气(H2);进样量1μL;分流比5∶1。
1.3.3 菌种的鉴定
1.3.3.116 S rRNA全长序列分析鉴定
乳酸菌菌株基因组DNA提取:取5mL过夜培养菌液,8000r/min离心2min获得菌体,将其悬浮于700μL缓冲液(50mmol/L葡萄糖、25mmol/L pH8.0的Tris-HCl、10mmol/L EDTA)中。加入质量浓度为40mg/mL的溶菌酶25μL,37℃温浴30min。再加入100μL 0.1g/mLSDS,60℃保温1h,使细菌细胞完全裂解。12000r/min离心10min,取上清液加入等体积的苯酚、氯仿、异戊醇(25∶24∶1,V/V)混合物,抽提至界面没有白色沉淀为止。取上清液加入1/10体积的3mol/L醋酸钠和两倍体积的无水乙醇,混匀后,-20℃放置30min。之后12000r/min离心10min,弃上清液,沉淀用体积分数70%乙醇溶液清洗,在空气中干燥后,用100μL TE缓冲液溶解。
菌株16S rRNA全长序列PCR扩增:PCR反应体系(50μL):取菌株基因组DNA 1μL作为PCR反应模板,dNTPs(25mmol/L)4μL,10×PCR buffer(含Mg2+)5μL,引物16S rRNA5'(10μmol/L)1μL,16S rRNA3'(10 μmol/L) 1μL,Takara Ex Taq酶(5U/μL)0.25μL。
PCR反应程序为94℃预变性5min,然后是30个循环:94℃变性30s,58℃退火40s,72℃延伸40s;最后是72℃延伸5min。PCR产物经上海生工生物技术有限公司测序,所得序列应用BLAST程序与数据库(http∶// blast.ncbi.nlm.nih.gov/Blast.cgi)中的已有细菌16S rRNA序
列进行相似性比较分析。
1.3.3.2 API试剂盒测定
将培养后的菌株lp15接入API 50CHL液体培养基中,制成菌悬液,然后接入API 5 0CHL菌种鉴定试剂条,无菌液体石蜡封口,30℃培养24、48h,观察并记录菌种对49种碳水化合物的利用情况。之后采用API公司细菌鉴定系统以及IBIS(intelligent bacteria identification system)软件系统对菌种进行鉴定[26]。
1.3.4 高产菌种的诱变选育
诱变方法参考文献[27],紫外诱变时间为5、10、15、20、25、30、35s;DES诱变体积分数为1%和2%;时间分别为10、20、30、40、50min;反应结束后分别加入2g/100mL的Na2S2O5溶液于37℃反应5min终止反应。
2 结果与分析
2.1 产CLA菌株的分离、筛选
CLA紫外吸收标准曲线:CLA紫外吸收标准曲线的线性回归方程为A=0.1058C+0.1452,式中:A为共轭亚油酸标样在233nm波长处的吸光度,C为CLA标样的质量浓度(μg/mL),线性范围为0~18μg/mL。
菌种筛选:从3种泡菜样品中分离出53株乳酸菌。利用紫外分光光度计检测发酵液中CLA含量,实验表明菌液培养24h时,43株菌中能够检测到CLA生成,含量在5~11.85μg/mL;而其中15号菌株的CLA产量最高,命名为lp15(图1)。
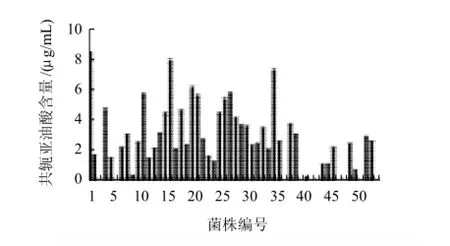
图 1 不同菌株转化合成CLA的能力Fig.1 CLA biosynthesis capabilities of various strains
2.2 菌种鉴定
16S rRNA分子鉴定:利用16S rRNA 5'和3'引物对菌株lp15以及实验室保存植物乳杆菌ACCC10171的16S rRNA序列进行扩增,PCR扩增产物大小约为1500bp(图2),测序结果表明,菌株lp15的16S rR NA全长为1471bp,Genbank登录号为:FJ763580;植物乳杆菌ACCC10171的16S rRNA全长为1468bp。经比对,菌株lp15与植物乳杆菌ACCC10171 16S rRNA序列同源性达99.2%,而Blast后绘制系统发育树(图3)结果表明,菌株lp15属于植物乳杆菌(Lactobacillus plantarum)。
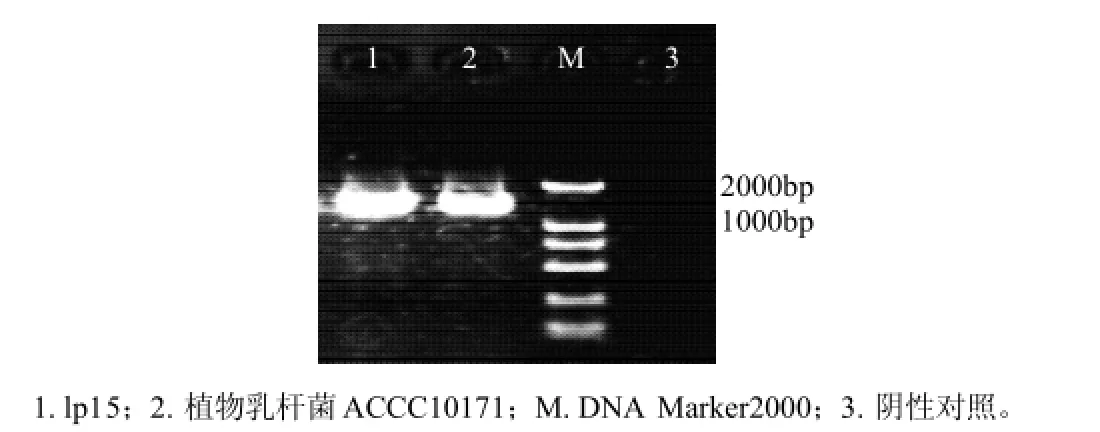
图 2 菌株lp15及植物乳杆菌ACCC10171的16SrRNA全长序列PCR扩增Fig.2 PCR amplification of 16SrRNA of strain lp15 and ACCC10171
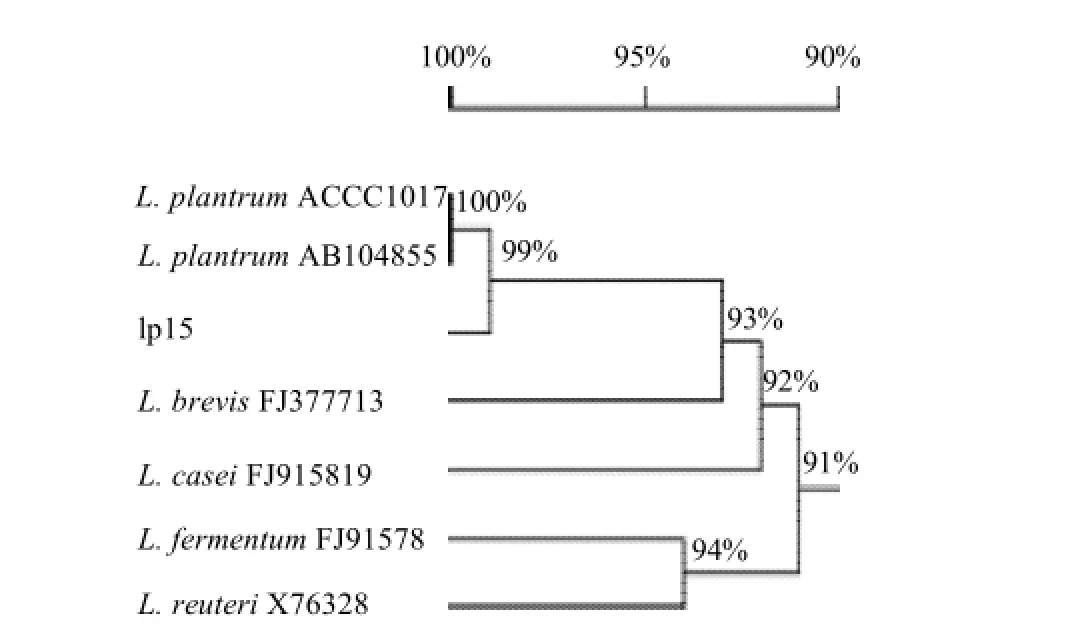
图 3 菌株lp15的16SrRNA序列系统发育树Fig.3 Phylogenetic tree of strain lp15 according to 16SrRNA

表 1 菌株lp15 API试剂盒反应结果Table 1 API reaction results of strain lp15
用API试剂盒进行菌种lp15利用49种碳水化合物的发酵实验,结果见表1。
将实验结果输入梅里埃(BioMe rieux)的API细菌鉴定系统,查询数据库,鉴定结果表明lp15为乳酸菌属的植物乳杆菌(Lactobacillus plantarum),与16S rRNA序列鉴定结果一致。
2.3 菌种诱变选育
不同剂量紫外线、DES处理与菌体致死率的关系见图4,有资料表明,用小剂量进行诱变处理时,致死率在50%~80%之间,单位存活细胞中正突变菌株数量较多[23]。
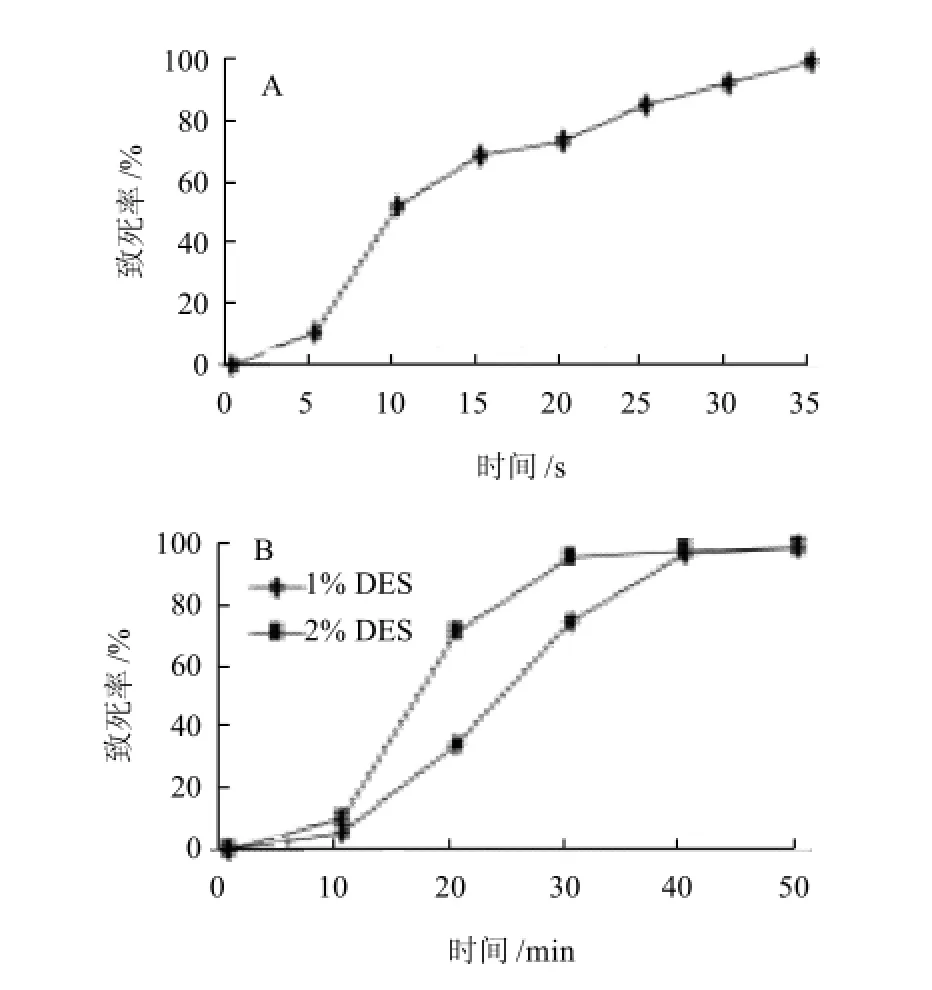
图4 紫外线照射时间(A)、DES体积分数和处理时间(B)与细胞致死率关系Fig.4 Effect of UV and DES on cell death rate of strain lp15
由图4可见,lp15最适合紫外诱变时间为20s(致死率约70%);1% DES诱变30min或者2% DES诱变20min (致死率约70%)。以lp15为出发菌株进行紫外线、DES诱变,提高了菌株生成CLA的能力,诱变得到多株突变菌株,CLA的生成能力较出发菌株提高幅度在29.3%~52.2%。其中突变菌株lp15-2-1CLA生成能力提高幅度最大,达到52.2%。
2.4 菌株lP15-2-1发酵液中CLA异构体的气相色谱分析
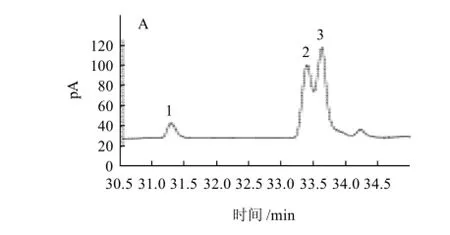
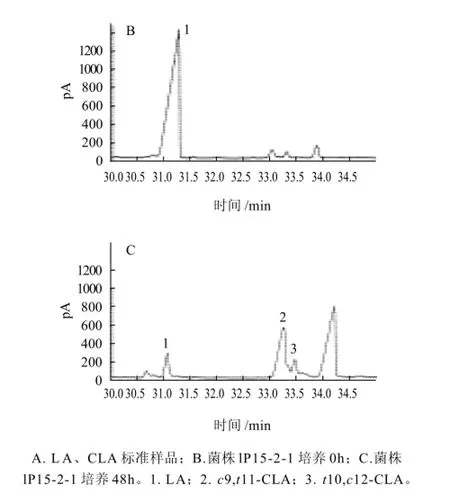
图 5 共轭亚油酸气相色谱图Fig.5 GC chromatogram of MRS broth before and after 48 h incubation with LA and CLA standard mixture
利用气相色谱分析法对lp15-2-1发酵液中的脂肪酸进行分析,结果见图5。
图5A是亚油酸甲酯和共轭亚油酸甲酯标准样品的气相色谱图,其中LA的保留时间是31.263min,而CLA两种异构体c9,t11-CLA和t10,c12-CLA得到了较好的分离,其保留时间分别为33.384min和33.617min。图5B、5C分别是lp15-2-1菌株在MRS培养基中添加0.2mg/mL LA,30℃,150r/min条件下发酵培养0h和48h的气相色谱图。发酵培养48h时,CLA总含量达30.13μg/mL;从图5C中可以看出lp15-2-1菌株主要将LA转化为两种CLA异构体,其中c9,t11-CLA是主要异构体,占76.5%,t10,c12-CLA异构体含量较少,占23.5%。
3 讨论与结论
泡菜是一种独特的乳酸发酵蔬菜制品,制作容易,营养卫生、风味可口、贮存便利;在我国四川、东北、湖南、湖北、河南、广东、广西等地民间均有自制泡菜的习惯;而泡菜汁中含有丰富的活性乳酸菌,尤其是植物乳杆菌,因此它不仅是传统的佐食,还能够成为具有我国传统特色的、廉价的、高效的天然微生态调节剂。
而近年来关于乳酸菌能够发酵合成CLA的研究大量增加,本实验从传统泡菜中筛选得到一株乳酸菌lp15,能够转化LA为CLA;通过16S rRNA全长序列分析和API试剂盒鉴定均证明该菌株为植物乳杆菌;之后,采
用紫外线、硫酸二乙酯(DES)依次诱变处理,筛选得到突变株lp15-2-1,共轭亚油酸合成能力较出发菌株提高了52.2%。在MRS培养液中添加0.2mg/mL LA培养48h,共轭亚油酸产量达30.13μg/mL;经气相色谱检测得知,产物为有生物活性的异构体c9, t11-CLA(76.5%)和t10, c12-CLA(23.5%)。研究表明:泡菜中含有大量能够合成CLA的乳酸,并且植物乳杆菌较为丰富;菌株的食品级来源大大保证了其安全性且菌株转化合成CLA异构体较为专一,因而有效的扩大了CLA的膳食来源范围并为提高食品中CLA含量开辟了新的途径。
[1]PARIZA M W, PARK Y, COOK M. The biologically active isomers of conjugated linoleic acid[J]. Prog Lipid Res, 2001, 40(4)∶ 283-298.
[2]刘佩, 沈生荣, 阮辉, 等. 共轭亚油酸的生理学功能及健康意义[J].中国粮油学报, 2009(6)∶ 161-164.
[3]PETERSON D G, KEISEY J A. Analysis in variation in cis-9, trans-11-conjugated linoleic acid (CLA) inmilk fat of dairy cows[J]. J Dairy Sci, 2002, 85(9)∶ 2164-2172.
[4]JAHREIS G, FRITSCHE J, MOCKEL P, et al. The potential anticarcinogenic conjugated linoleic acid, cis-9, trans-11-C18∶2, in milk of different species∶ Cow, goat, ewe, sow, mare, woman[J]. Nutr Res, 1999, 19(10)∶ 1541-1549.
[5]LOCK A L,BAUMAN D E,GARNSWORTHY P C. Effect of production variables on the cis-9,trans-11 conjugated linoleic acid cotent of cows’milk[J]. J Dairy Sci, 2005, 88(8)∶ 2714-2717.
[6]ZENG Z, LIN J, GONG D. Identification of lactic acid bacterial strains with high conjugated linoleic acid-producing ability from natural sauerkraut fermentations[J]. J Food Sci, 2009, 74(4)∶ 154-158.
[7]郭诤, 张根旺, 孙彦. 共轭亚油酸制备方法的研究进展[J]. 化学通报, 2003, 66(9)∶ 592-597.
[8]KEPLER C R, TOVE S B. Biohydrogenation of unsaturated fatty acid [J]. J Biol Chem, 1967, 242(24)∶ 5686-5692.
[9]熊向峰, 陈朝银, 赵声兰. 亚油酸异构酶及性质[J]. 工业微生物, 2002, 32(4)∶ 51-54.
[10]章亭洲. 共轭亚油酸的营养分配作用及生物合成研究进展[J]. 食品与发酵工业, 2004, 30(10)∶ 92-96.
[11]吴祖芳, 石清花, 翁佩芳. 生物转化法生产共轭亚油酸及其研究进展[J]. 中国粮油学报, 2005, 20(6)∶ 84-87.
[12]JIANG J, BJORCK L, FONDEN R. Production of conjugated linoleic acid by dairy starter cultures[J]. J Appl Microbiol, 1998, 85(1)∶ 95-102.
[13]LIN T Y, LIN C W, LEE C H. Conjugated linoleic acid concentrauion as affected by lactic cultures and added linoleic acid[J]. Food Chem, 1999, 67∶ 1-5.
[14]LIN T Y, H UNG T H, CHENG T S J. Conjugated linoleic acid production by immobilized cells of Lactobacillus delbrueckii ssp. bulgaricus and Lactobacillus acidophilus[J]. Food Chem, 2005, 92(1)∶1-6.
[15]OGAWA J, MATSUMURA K, KISHINO S, et al. Conjugated linoleic acid accumulation via 10-hydroxy-12-octadecannioc during microaerobic transformation of linoleic acid by Lactobacillus acidophilus[J]. Appl Environ Micobiol, 2001, 67∶ 1246-1252.
[16]邵群, 张慧, 边际, 等. 乳酸菌发酵产生共轭亚油酸条件的研究[J].山东师范大学学报∶ 自然科学版, 2001, 16(4)∶ 443-446.
[17]KIM Y J, LIU R H. Increase of conjugated linoleic acid content in milk by fermentation with lactic acid bacteria[J]. J Food Sci, 2002, 67(5)∶1731-1737.
[18]LEE S O, KIM C S, CHO S K, et al. Bioconversion of linoleic acid into conjugated linoleic acid during fermentation and by washed cells of Lactobacillus reuteri[J]. Biotechnol Lett, 2003, 25(12)∶ 935-938.
[19]张忠义, 胡锦蓉, 刘萍, 等. 产共轭亚油酸乳酸菌的筛选及产物分析[J]. 中国农业大学学报, 2004, 9(3)∶ 5-8.
[20]LIN T Y, LIN C W, WANG Y J. Linoleic acid isomerase activity in enzyme extracts from Lactobacillus acidophilus and Propionibacterium freudenreichii[J]. J Food Sci, 2002, 67(4)∶ 1502-1505.
[21]CHUNG S H, KIM I H, PARK H G, et al. Synthesis of conjugated linoleic acid by human-derived Bifidobacterium breve LMC 017∶ utilization as a functional starter culture for milk fermentation[J]. J Agric Food Chem, 2008, 56(9)∶ 3311-3316.
[22]KIM Y J, LIU R H. Increase of conjugated linoleic acid content in milk by fermentation with lactic acid bacteria[J]. J Food Sci, 2002, 67(5)∶1731-1737.
[23]ALONSO L, CUESTA E P, GILLILAND S E. Production of free conjugated linoleic acid by Lactobacillus acidophilus and Lactobacillus casei of human intestinal origin[J]. J Dairy Sci, 2003, 86(6)∶ 1941-1946.
[24]PARIZA M W, YANG X Y. Method of producing conjugated fatty acids∶USA, 6060304[P]. 2000-05-09.
[25]XU H, LEE H Y, WHANG B. Kinetics of microbial hydrogenation of free linoleic acid to conjugated linoleic acids[J]. Journal of Applied Microbiology, 2008, 105(6)∶ 2239-2247.
[26]WIJTZES T, BRUGGEMAN M R, NOUT M J, et a1. A cornputerised system for the identification of lactic acid bacteria[J]. International Journal of Food Microbiology, 1997, 38(1)∶ 65-70.
[27]张中义. 植物乳杆菌转化亚油酸生成共轭亚油酸的研究[D]. 北京∶ 中国农业大学, 2004.
Screening, Identification and Breeding of Conjugated Linoleic Acid-producing Lactobacillus plantarum by Mutation
LIU Pei,ZHOU Qian,SHEN Sheng-rong,RUAN Hui,MA Liu-liu,HE Guo-qing*
(School of Biosystems Engineering and Food Science, Zhejiang University, Hangzhou 310029, China)
A lactic acid bacterial strain, lp15, having the ability to synthesize conjugated linoleic acid (CLA) was isolated from pickle juice samples. The strain lp15 was identified as Lactobacillus plantarum based on full-length 16S rRNA sequence analysis and API system. This strain was treated by ultraviolet and DES to obtain several mutant strains, which exhibited 29.3%-52.2% enhancement for CLA production. The strain lp15-2-1 exhibited the highest CLA productivity, which was up to 30.13 μg/mL after 48 h culture in the MRS medium added with LA at 0.2 mg/mL level. According to gas chromatographic analysis, cis9, trans11-CLA was the predominant compound in the fermentation product, with a relative content of up to 76.5%. trans10, cis12-CLA approximately accounted for 23.5% of the fermentation product.
conjugated linoleic acid (CLA);Lactobacillus plantarum;identification;mutation;gas chromatography (GC)
TS218
A
1002-6630(2010)09-0135-05
2009-08-20
国家“863”计划重点项目(2007AA100402)
刘佩(1983—),女,博士研究生,研究方向为食品科学。E-mail:liupei83224@163.com
*通信作者:何国庆(1957—),男,教授,博士,研究方向为食品微生物与发酵工程。E-mail:gqhe@zju.edu.cn
