检测尿酸和葡萄糖电极式试纸条的研制
2010-03-23石平李建平方成李玉平
石平,李建平,方成,李玉平
(1.桂林优利特电子集团有限公司,广西桂林541001)(2.桂林理工大学化学与生物工程学院,广西桂林541004)
0 引言
生物传感器技术正被越来越多的应用在临床化学、生物医学的在线监测等[1~2]。这种新的检测手段和传统的分析方法相比具有分离和检测一体、响应快、样品用量少,成本低等特点。目前商业化的生物试纸条已超过十余种[3~7],大致可分为光学型和电化学型两大类,前者可视为传统酶溶液比色法的衍生与移植,缺点是显色后颜色分布不均并且易受环境光线与温度影响[8],电化学型生物试纸条可以视为同类光学型试纸条更新换代产品,基本不受环境光线与温度的影响,并且有更高的灵敏度与准确度[9~12]。
铁氰化钾是一种无机电子媒介体,比一般有机电子媒介体稳定,对pH的依赖性较小[13],被广泛使用于葡萄糖、肌胺酸、乳酸试纸条等商业化的电化学型生物试纸条中[14]。电子转移与酶反应同步,媒介体只起到酶与电极之间传递电子的桥梁作用[15~16]。基于该原理设计的酶试纸条通常由媒介体修饰的工作电极和固体参比电极(如Ag/AgCl电极)组成。这类试纸条的选择性主要通过控制极化电位来实现,因而极易受样品中易发生电极反应的电活性物质的干扰;而且电子传递的效率不高,试纸条的灵敏度不高;电子传递极易达饱和状态,检测浓度范围很窄[17]。
该文使用丝网印制双碳电极研究了溶液中铁氰化钾的伏安特性和安培响应特性,设计出了以铁氰化钾为电子媒介体的葡萄糖和尿酸试纸条,并进行临床验证。
1 实验部分
1.1 仪器与试剂
电化学测量在CHI660B电化学工作站(上海华辰仪器公司)上进行。碳油墨ERC1(Ercon Inc.)通过丝网印刷在绝缘基底上,碳双电极作为试纸条的工作电极和对电极,表观电极面积1.0 mm×2.0 mm。葡萄糖氧化酶,100 U/mg,上海生工生物工程技术服务有限公司;铁氰化钾K3[Fe(CN)6]、亚铁氰化钾K4[Fe(CN)6]购自上海试剂一厂。
溶液A:0.4 mol/L,准确称取6.585 0 g K3[Fe(CN)6]溶于50 mL二次蒸馏水,摇匀过夜;溶液B:0.4 mol/L,准确称取8.448 2 g K4[Fe(CN)6]·3H2O溶于50 mL二次蒸馏水,摇匀过夜;混合液C:将放置过夜的溶液A和溶液B以体积比1∶1混合摇匀。硼砂缓冲液pH=8.5:配制0.05 mol/L硼砂水溶液和0.1 mol/L磷酸氢二钾水溶液,两者体积比65∶35混合,摇匀。磷酸盐缓冲液pH=7.0:配制0.2 mol/L Na2HPO4和0.2 mmol/L KH2PO4标准溶液;然后体积比3∶7混合。尿酸溶液:称取60 mg碳酸锂,溶入15 mL二次蒸馏水中,室温下溶解至饱和后用定性滤纸过滤,去渣,向滤液中加入3.362 2 g尿酸,50~60℃水浴至尿酸完全溶解,冷却后用硼砂缓冲液稀释至100 mL,得到0.2 mol/L的尿酸母液,4℃下保存备用。葡萄糖溶液:称取3.963 4 g D-葡萄糖(C6H12O6·H2O,198.17 g/mol),分析纯,广东汕头西陇化工厂,溶于磷酸盐缓冲液中得0.2 mol/L葡萄糖溶液,4℃保存备用。其它试剂均为分析纯,试验用水为二次蒸馏水,试验温度25℃。
1.2 实验方法
1.2.1 铁氰化钾伏安性质
分取5 mL溶液A、溶液B和混合液C放入3支10 mL比色管,各加入5 mL磷酸盐缓冲液,摇匀,倒入10 mL电解杯中,设置扫描电位-0.6~0.6 V,扫描速度100 mV/s,分别测量溶液的伏安曲线。改变极化电压,测定不同极化电压下的电流强度。
用磷酸盐缓冲液将溶液A和溶液B稀释成0.2 mol/L,取5 mL 0.2 mol/L铁氰化钾溶液放入10 mL电解杯中,设置极化电压0.4 V,加入0.2 mol/L亚铁氰化钾溶液并搅拌均匀,静置片刻,记录各次加入后的电流强度。
在保持铁氰化钾和亚铁氰化钾的总浓度不变的情况下,测定铁氰化钾溶液随亚铁氰化钾浓度变化下的电流强度变化。
1.2.2 尿酸,葡萄糖试条制备
将相关试剂按照一定的配比制成反应液,用微量取液器在印制电极的各电极片上滴加反应液0.5 μL,室温下干燥后,加盖微池体,试纸条结构如图1。其中葡萄糖试纸条反应液由葡萄糖氧化酶、铁氰化钾和羧甲基纤维素钠组成,尿酸试纸条反应液由铁氰化钾和羧甲基纤维素钠组成。

图1 尿酸和葡萄糖试纸条结构Fig.1 Structure of Uric acid or Glucose strip(a)接头(contact);(b)工作电极(work electrode);(c)对电极(counter electrode);(d)试剂斑(reagent spot);(e)微池(micro-pool);(f)基底(substrate)
1.2.3 尿酸和葡萄糖测定
取2.5 mL铁氰化钾溶液6份放入10 mL比色管中,分别加入0、0.1、0.25、0.5、1.0、1.5 mL尿酸溶液,然后用硼砂缓冲液定容至5 mL。设置极化电压0.4 V,测定电流强度曲线。同上取铁氰化钾溶液,各加入1U固体粉状葡萄糖氧化酶,分别加入0、0.1、0.25、0.5、1.0、1.5 mL葡萄糖溶液,然后用磷酸盐缓冲液定容至5 mL,测定电流强度。
尿酸或葡萄糖试纸条测试时,取3 μL尿酸或葡萄糖试液滴加在试纸条的微池中,在工作电极与对电极之间加400 mV电压,测试电极的反应电流强度。
2 结果与讨论
2.1 铁氰化钾伏安特性
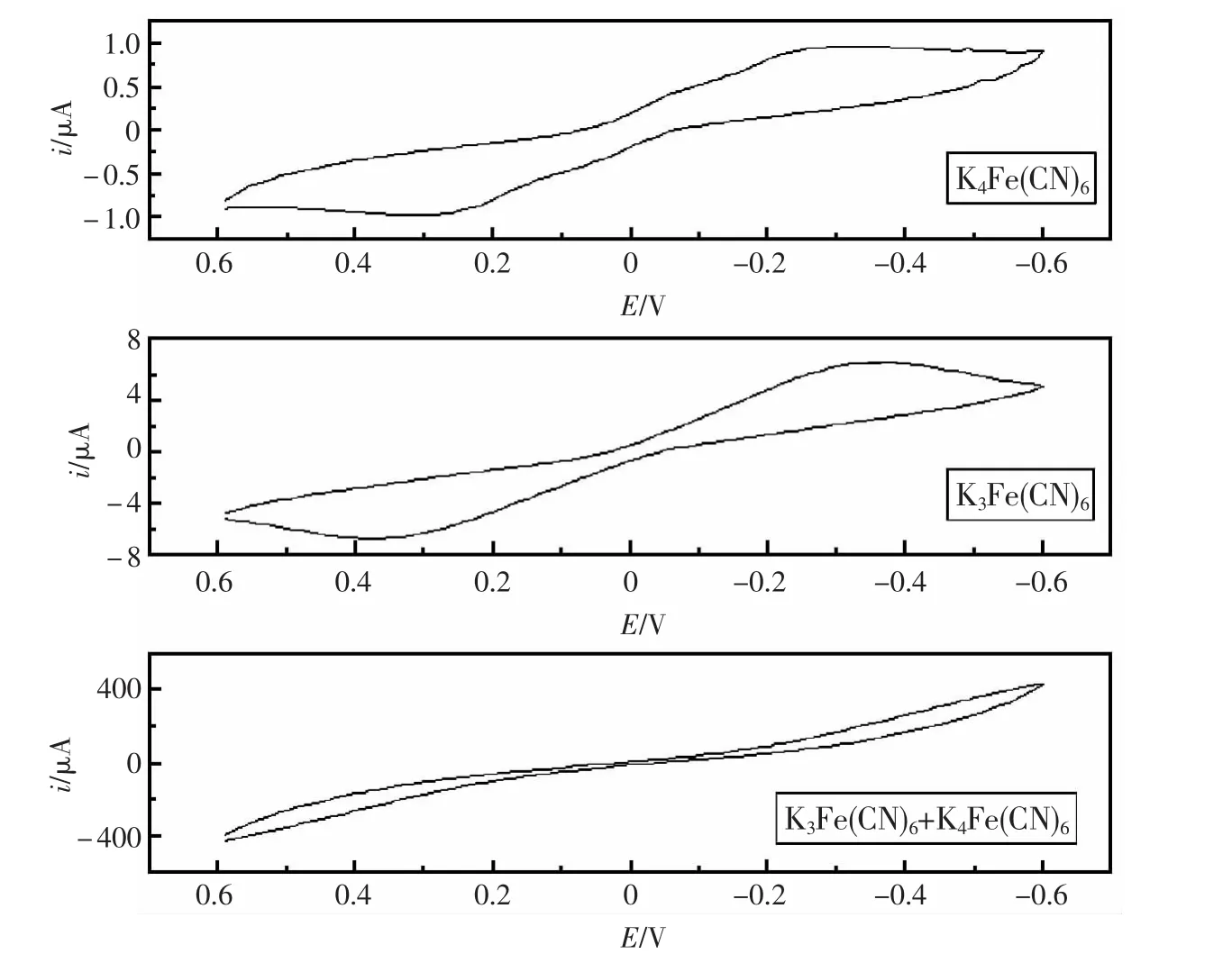
图2 铁氰化钾和亚铁氰化钾及其混合液的循环伏安曲线Fig.2 Cyclic voltammetric curves of the solutions of potassium ferricyanide,potassium ferrocyanide and their mixture
相同浓度下,铁氰化钾、亚铁氰化钾和混合液的伏安曲线如图2。可以发现三者均有双峰,且曲线关于零点中心对称。任何导电性表面在接触含氧化还原性物质的溶液时,导电表面会产生净电荷。溶液中的氧化性和还原性物种均对导电性物质充电,从而产生极化电位,其大小由溶液中Red/Ox的浓度比决定。又因为两电极性状几乎完全相同,因此两电极的极化电位应该相同,即铁氰化钾的电解电压为0 V。当在双电极上外加电压时,外加电压应该平均分配在2个电极上,如外加电压0.5 V时,则一电极升高0.25 V,而另一电极会下降0.25 V。对于铁氰化钾溶液来说,[Fe(CN)6]3-总选择在电位降低的电极上被还原,因此[Fe(CN)6]3-发生还原反应的场所会随外加电压方向改变而改变,导致伏安曲线呈中心对称。
相同浓度下亚铁氰化钾的响应值是铁氰化钾的1/8左右,差异源于电极反应速度常数(kred,kox)不同。kred=k0exp[-αF/RT(E-E0)],kox=k0exp[(1-α)F/RT(E-E0)]。
式中k0表示电对标准反应常数,α为电子转移系数,E0为标准电极电位,R是摩尔气体常数,T是绝对温度。因为铁氰化钾和亚铁氰化钾具有相同的k0、α、E0,扩散系数D也近似相同,可见电极反应速度常数随电位差|E-E0|增大而增大。
分别测定了0.2 mol/L铁氰化钾、亚铁氰化钾和铁氰化钾与亚铁氰化钾的混合液,在不同极化电压下的电流强度。从图3可以发现电流强度随极化电压增大而增大,对0.2 mol/L铁氰化钾或亚铁氰化钾来说,增速不大,但对0.2 mol/L铁氰化钾和亚铁氰化钾的混合液却表现极其明显。从曲线的对称形状可以预见极化电压的大小和正负均不会影响电流强度与浓度的线性关系,电压的大小只改变电流响应灵敏度,因此以铁氰化钾为电子媒介时,可根据检测物浓度和干扰情况,检测电压可以在-0.6~0.6 V范围内任意选定。为了便于试验对比和满足一定的灵敏度要求,试验中统一采用极化电压0.4 V。

图3 不同电位下的安培响应曲线Fig.3 Plot of amperometric response vs.measurement potential
2.2 铁氰化钾的电子媒介作用
如图4所示,在曲线的下段呈的线性关系,即当铁氰化钾转化为亚铁氰化钾的比率≤25%时,电流强度与生成的亚铁氰化钾的量成线性关系。因此可以认为铁氰化钾的电子媒介作用是通过其转化成亚铁氰化钾来实现的,所以任何可导致上述转化发生的物质都可以借助铁氰化钾为电子媒介来测定。

图4 亚铁氰化钾浓度与电流强度变化曲线(虚线表示在曲线的下段呈的线性关系)Fig.4 Plot of amperometric response vs.concentration of potassium ferrocyanide
由于在pH=8.5时尿酸能与铁氰化钾反应,定量生成亚铁氰化钾;pH=7.0时葡萄糖在葡萄糖氧化酶催化下与铁氰化钾反应,定量生成亚铁氰化钾,电流强度见图5。与图4对比,发现响应趋势极其相似,从而应证前面的原理。
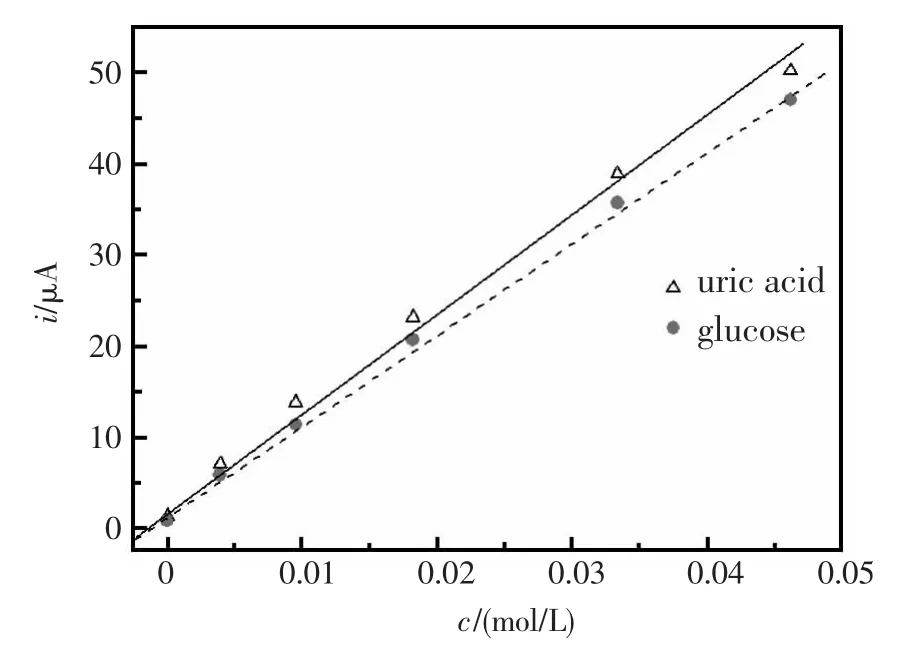
图5 尿酸,葡萄糖浓度与电流强度值变化曲线Fig.5 Plot of amperometric response vs.concentration of uric acid or glucose
2.3 尿酸和葡萄糖试纸条测试性能
为检测尿酸和葡萄糖试纸条的临床使用效果,取35例病人血液样品,使用尿酸和葡萄糖试纸条测试样品中尿酸和葡萄糖的含量,并将测试结果与医院生化分析常规方法的测试结果对比。常规方法中,尿酸测试为磷钨酸还原法,葡萄糖测试为邻甲苯胺法(o-Toluidin,O-TB),样品测定结果对照见图6。两种方法间均有较好的相关性(y=0.995x+2.317 5,r=0.987 6;y=0.981x+0.032 7,r=0.983 1)。

图6 尿酸(a)和葡萄糖(b)试纸条与常规方法测试结果比对Fig.6 Result of comparing conventional method with uric acid(a)or glucose strip(b)
样品测定结果与医院生化分析结果经统计分析两组间比较用配对T检验,尿酸检验结果t为-0.804,双侧检验的概率P为0.427;葡萄糖检验结果t为1.814,双侧检验的概率P为0.079;可见,尿酸和葡萄糖试条检测结果与常规方法测定结果,其差别在统计上无显著性意义。
2.4 临床检测
为检测尿酸和葡萄糖试纸条的使用效果,取35份临床血清样品,使用尿酸和葡萄糖试纸条测试样品中尿酸和葡萄糖的含量,并将测试结果与医院常规全自动生化分析仪的测试结果(酶反应-光度法)对比。
2.5 统计学分析
使用SPSS 16.0统计检验软件进行统计分析,将自制试纸条测定结果与常规生化检测方法检测结果进行直线线性相关性分析比较,两组间比较用配对T检验(Paired-samples T Test),若P>0.05,则认为没有显著差异。
3 结论
该文使用印制双碳电极研究了铁氰化钾电子媒介体的伏安性质,提出了铁氰化钾的电子媒介作用的新模式:铁氰化钾的电子媒介作用可以通过其转化成亚铁氰化钾来实现,任何可导致上述转化发生的物质都可以借助铁氰化钾为电子媒介来测定,合理使用媒介体可以达到检测非电活性物质或放大检测信号等目的。设计了性能优越的尿酸、葡萄糖试纸条。利用试条对病人血液样品进行检测,测试结果与医院生化分析常规方法的测试结果一致。该试条电子传递的效率高,试条制作过程简单。对于临床血糖和尿酸的临床检验有重要意义。
[1]Wang J.Electrochemical glucose biosensors[J].Chem.Rev.,2008,108:814~825.
[2]Alcock S J.Technology for continuous invasive monitoring of glucose[A].Proc IEEE Eng.Med.Biol.,18th Ann Int Conf of the IEEE Amsterdam,1996,838:1~3.
[3]McAleer J F,Scott D,Hall G,et al.Disposable glucose test strips,and methods and compositions for making same[P].US Patent,5708247,1998-01-13.
[4]Yamamoto T,Yoshioka T,Nankai S.Cholesterol sensor and method for producing the same[P].US Patent,6117289,2000-09-12.
[5]Schou C,Schulein M,Vollmond T.Cellobiose oxidase,and enzymatic agent and a process for treating paper pulp[P].US Patent,5866392,1999-02-02.
[6]Anaokar S G,Antonopoulos G L,Cunningham P.Test Strip for determining concentration of triglycerides[P].US patent,7214504,2007-05-08.
[7]Nishidate K,Suzuki Y,Inaba S.Method of determining glucose-6-phosphate and composition therefore[P].US Patent,5492815,1996-02-20.
[8]Brahim S,Narinesingh D,Guiseppi-Elie A.Amperometricdeterminationof cholesterol in serum using a biosensor of cholesterol oxidase contained within a Polypyrrole-hydrogel membrane[J].Anal.Chim.Acta,2001,448:27~36.
[9]Singh A K,Flounders A W,Volponi J V,et al.Development of sensors for direct detection of organo-phosphates.Part I:immobilization,characterizationand stabilization of acetylcholinesterase and organophosphate hydrolase on silica supports[J].Biosens.Bioelectron.,1999,14:703~713.
[10]Chen Z,Fang C,Qiu G,et al.Non-enzymatic disposable test strip for detecting uric acid in whole blood[J].J.Electroanal.Chem.,2009,633:314~318.
[11]Li J P,Wei X P,Yuan Y H.Synthesis of magnetic nanoparticles composed by Prussian blue and glucose oxidase for preparing highly sensitive and selective glucose biosensor[J].Sens.Actuat.:B.Chem.,2009,139:400~406.
[12]Li J P,Liu R,Pan H C,et al.Preparing of hybrid bio-organic-inorganic composite membrane for amperometric mediatorless glucose micro biosensor[J].Sensor Lett.,2009,7(4):557~562.
[13]Li J P,Zhao J,Wei X P.A sensitive and selective sensor for dopamine determination based on a molecularly imprinted electropolymer of o-aminophenol[J].Sens.Actuat.:B.Chem.,2009,140:663~669.
[14]Taniguchi I,Miyamoto S,Tomimura S,et al.Mediated electron transfer of lactate oxidase and sarcosine oxidase with octacyanotungstate(Ⅳ)and octacyanomolybdate(Ⅳ)[J].J.Electroanal.Chem,1988,240:333~339.
[15]Bartlett P N,Tebbutt P,Whitaker R G.Kinetic aspects of the use of modified electrodes and mediators in bioelectrochemistry[J].Prog.Reaction Kinetics,1991,16:55~155.
[16]Li J P,Yu J G.Fabrication of Prussian Blue modified ultramicroelectrode for GOD imaging using scanning electrochemical microscopy[J].Bioelectrochemistry,2008,72(1):102~106.
[17]Buck R P,Bowden E F,Umatia M,et al.Biosensor Technology:Fundamentals and Applications[M].Marcel Dekker,New York,1990,pp3.
