大豆分离蛋白水解物降血压活性的体外检测
2010-03-22孙春玉
孙 旸, 孙春玉, 陈 光*
(吉林农业大学生命科学学院,吉林 长春 130118)
大豆分离蛋白水解物降血压活性的体外检测
孙 旸, 孙春玉, 陈 光*
(吉林农业大学生命科学学院,吉林 长春 130118)
采用Alcalase酶处理大豆分离蛋白,对产物及其层析组分的降血压活性进行研究,结果表明Alcalase酶处理大豆分离蛋白产物具有一定的降血压活性;通过分子筛层析分离后,所得小分子组分降血压活性较高;增加外切酶处理可以改善水解产物的口味,但与不加酶处理相比其降血压活性降低。
大豆分离蛋白;Alcalase蛋白酶;水解;降血压活性
大豆功能性低聚肽是大豆蛋白经蛋白水解酶作用后,再经过特殊处理而得到的低肽混合物,具有许多生理功能,如降低胆固醇、抑制血压升高、增强免疫功能和抗自由基损伤等[1-2]。血管紧张素转化酶(angiotensin converting enzyme,ACE)在人体内通过肾素-血管紧张素系统和激肽释放酶-激肽系统参与血压的调节:通过ACE作用于血管紧张素Ⅰ,从其C末端去掉His-Leu生成血管紧张素Ⅱ,血管紧张素Ⅱ作用于小动脉,使血管平滑肌收缩,从而引起血压升高。服用ACE的抑制剂可减少血管紧张素Ⅱ的生成,达到治疗高血压的目的[3-4]。多种人工合成或由蛋白质降解得到的短肽都可在一定程度上抑制血管紧张素转移酶的活性起到降血压的功效[5-7]。大豆肽能抑制ACE活性,而对正常血压没有降压作用,安全可靠[8]。本实验采用Alcalase酶解大豆分离蛋白,对所得的大豆肽及其层析分离组分的降血压活性进行研究,以期提高大豆产品的附加值,为大豆肽作为新一代蛋白营养素和多功能保健物质提供参考。
1 材料与方法
1.1 材料、试剂与仪器
Alcalase碱性内切蛋白酶、Flavourzyme风味蛋白酶 丹麦Novo公司;金龟2200大豆分离蛋白 吉林不二蛋白有限公司;考马斯亮兰 G-250 Fluka公司;葡聚糖凝胶Sephadex G-50 Pharmacia公司;HHL(Hip-His-Leu)、ACE (兔肺血管紧张素转化酶) Sigma公司。
Agilent 1100型高效液相色谱仪和C18反相色谱柱 美国Agilent公司;UV-1100型紫外-可见分光光度计 北京瑞利分析仪器公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;LG-3型冷冻干燥机 宁波市生化仪器厂; HD-21-1核酸蛋白检测仪、BSZ-100自动部分收集器 上海青浦沪西仪器厂;XWT-S小型台式记录仪 上海自动化仪表三厂;层析柱(4cm×100cm) 上海锦华层析设备厂。
1.2 方法
1.2.1 酶活力的测定
酶活力测定采用福林酚法[9]。
1.2.2 大豆肽的酶水解
Alcalase酶水解大豆分离蛋白参照文献[10]中的工艺。
1.2.3 水解度(DH)的测定
水解度测定采用pH-Stat法[11]。
1.2.4 水解产物的层析分离
采用G-50葡聚糖凝胶对混合肽进行分子筛层析分离。柱末端与核酸蛋白检测仪、记录仪相联,柱参数为:柱径4cm、填料高度80cm、检测波长254nm、流速3.5mL/min、加样量为25mL、室温下以蒸馏水进行洗脱。
1.2.5 分子质量分布的测定
采用SDS-PAGE不连续电泳[12]方法。
1.2.6 降血压活性测定
参照文献[13]方法。HHL(Hip-His-Leu)与血管紧张素Ⅰ的C末端结构类似,可作为ACE催化反应的底物。本实验中以ACE催化降解HHL,反应在40℃恒温水浴中进行,通过高效液相色谱分离并检验产物马尿酸的含量。HPLC色谱分析条件为:C18分析型色谱柱;检测波长:228nm;流速:0.5mL/min;上样量:6μL,自动进样;缓冲液A:水(含体积分数为0.05%的冰醋酸),缓冲液B:乙腈(含体积分数为0.05%的冰醋酸);梯度洗脱:0~30%(45min)缓冲液B;柱温:25℃。
ACE受到抑制会使马尿酸的产量减少,以马尿酸产量相对于空白实验减少的百分率代表大豆肽及其层析组分的ACE抑制率。

式中:Si为i组分作用下生成马尿酸的峰面积;S0为空白实验中生成马尿酸的峰面积。
2 结果与分析
2.1 水解度测定
采用pH-Stat法测定水解度为22.02%。
2.2 水解混合肽的分离效果
大豆分离蛋白经Alcalase碱性蛋白酶水解后,所得到的是各种肽的混合物,根据分子筛分离原理,采用葡聚糖凝胶G-50对混合肽进行分离,以提取活性组分,图1为Alcalase酶解产物分离图谱。
由图1可知,G-50凝胶可将混合肽按分子质量分成5种组分,前3种含量较大,而后两种较低,5个峰的分离效果较好。将G-50凝胶分离单酶水解混合肽所得的5种组分分别收集,记为层析组分1~5。各组分浓缩后进行SDS-PAGE凝胶电泳,以检验凝胶分离的效果,并确定各组分的分子质量,见图2。
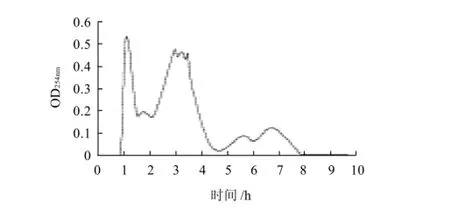
图1 G-50凝胶对单酶水解混合肽的分离效果Fig.1 Separation effect of Sephadex G-50 on hydrolysates by a single enzyme

图2 G-50凝胶分离各组分的电泳图谱Fig.2 Electrophoresis pattern of all components using Sephadex G-50
由图2可见,G-50凝胶分离单酶水解混合肽所得5种组分中:层析组分1~3条带清晰;层析组分4、5经浓缩后仍不能显示清晰的条带,认为是由于此两种组分的分子质量较小已经跑出分离胶所致,或是由于在实验的染色条件不适合小肽的显色。分别计算图2中各组分的迁移率,以分子质量标准品的迁移率作迁移率关于分子质量对数的标准曲线,并求出其回归方程为y =-1.958x+4.9487。将凝胶分离得到的显色清晰的3种组分的迁移率代入该方程,计算其平均分子质量分别约为22550、13548、3517u,标准曲线见图3。
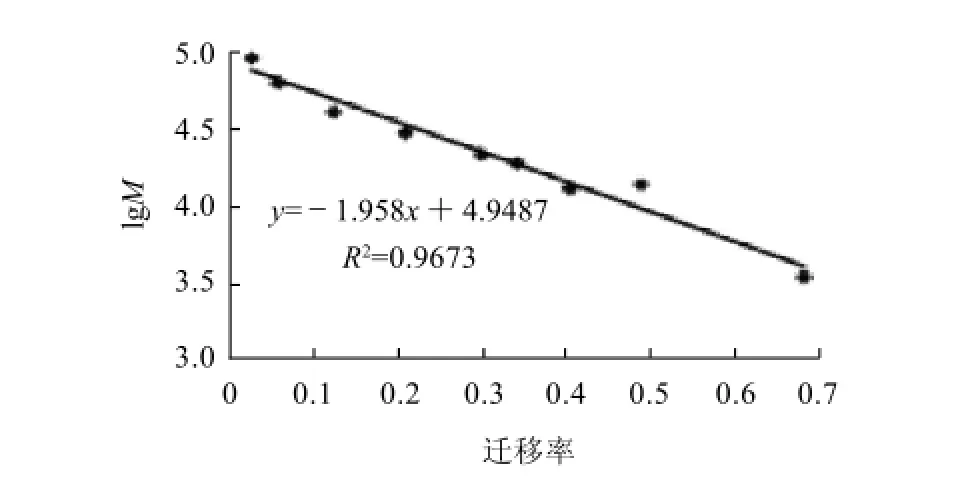
图3 G-50凝胶分离单酶水解混合肽所得各组分的分子质量Fig.3 Molecular mass of hydrolysates separated by Sephadex G-50
2.3大豆肽的降血压活性(ACE抑制率)

图4 空白(无抑制剂)色谱图Fig.4 Chromatograph of blank sample without inhibitory agents
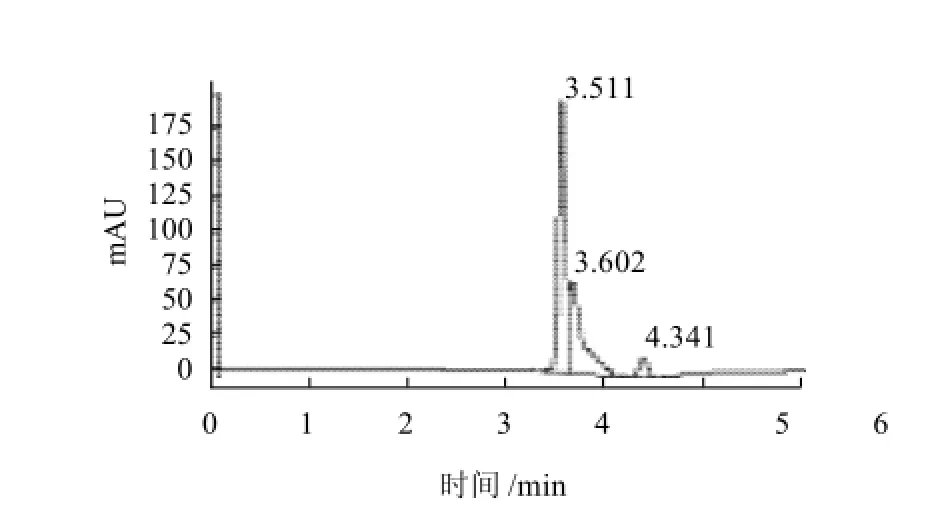
图5 Alcalase酶解产物抑制ACE活性效果色谱图Fig.5 Inhibitory effect of hydrolysates through alcalase hydrolysis on ACE
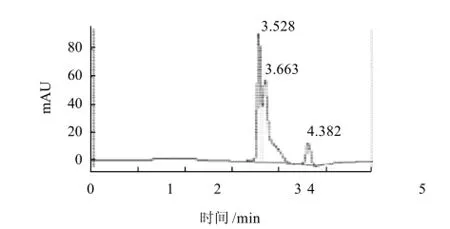
图6 层析组分1抑制ACE活性效果色谱图Fig.6 Inhibitory effect of fractionⅠ on ACE
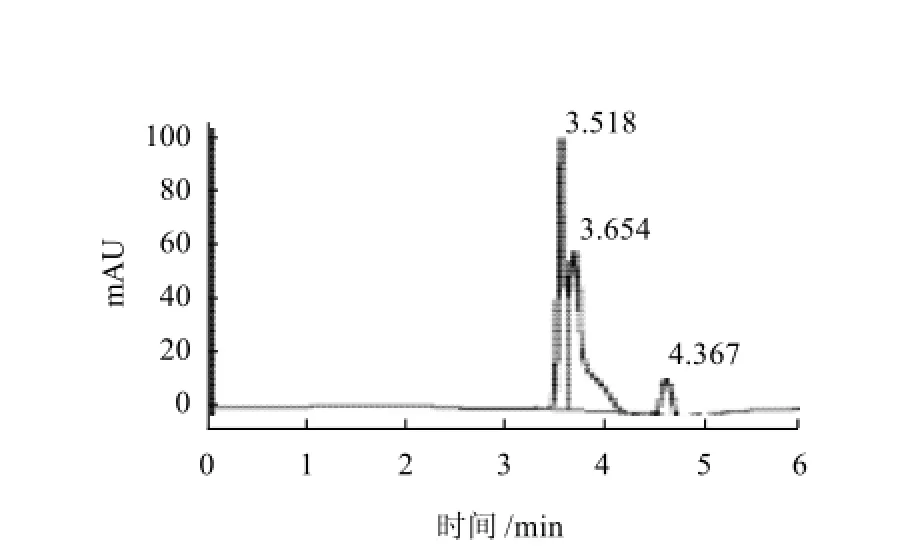
图7 层析组分2抑制ACE活性效果色谱图Fig.7 Inhibitory effect of fraction Ⅱ on ACE
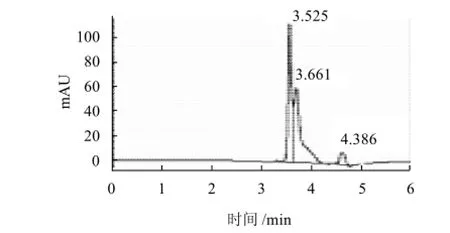
图8 层析组分3抑制ACE活性效果色谱图Fig.8 Inhibitory effect of fractionⅢ on ACE
马尿酸分子质量小,保留时间短而先出峰,其峰面积代表了马尿酸的产量。与空白实验相比,添加大豆蛋白的酶解产物及其层析分离组分都能使马尿酸的产量减少,即对ACE的活性起到抑制作用。Alcalase酶解产物具有较强的ACE抑制活性,为明确其中的活性组分,又用葡聚糖凝胶色谱对其进行分离,分别进行ACE抑制活性研究,结果见图4~8。
Alcalase酶解产物对ACE活性的抑制率达31.4% (图5);层析组分1、2、3对ACE抑制率分别为7.9%、24.7%和39.7%(图6~8),其质量分数分别达到总水解物的14.1%、7.8%和62.5%;总体看来ACE抑制活性有随水解物分子质量减小而加强的趋势。实验中采用Flavourzyme风味蛋白酶进行双酶作用,经双酶连续作用后大豆蛋白水解产物的苦味明显减少,但经检测,其ACE抑制率仅有12.5%,尚不足单酶水解产物的一半。分析可能的原因为ACE属于外切酶,其抑制剂的C端结构对抑制活性影响较大,而Flavourzyme风味蛋白酶具有外切酶活性,破坏了抑制剂的C端的结构,导致活性的下降[14-16]。
3 结 论
对Alcalase酶处理大豆分离蛋白产物及其层析组分的降血压活性进行研究,结果表明Alcalase酶水解大豆分离蛋白产物具有一定的降血压效果,其ACE活性抑制率达31.4%;Alcalase酶水解大豆分离蛋白产物抑制ACE活性有随水解物分子质量减小而加强的趋势;引入外切酶作用可能会破坏Alcalase酶水解大豆分离蛋白产物中抑制ACE活性成分结构。
[1]ADLER-NISSEN J. Dtermination of the degree of hydrolysis of food protein hydrolyzates by trinitrobenzene sulfonnicacid[J]. Agric Food Chem, 1989, 27∶ 17-20.
[2]黄骊虹. 大豆肽生理功能及应用(一)[J]. 食品科技, 1999(3)∶ 50-51.
[3]COSTA-NETO C M, DILLENBURG-PILLA P, HEINRICH T A, et al. Participation of kallikrein-kinin system in different pathologies[J]. Inter-
national Immunopharmacology, 2008, 8(2)∶ 135-142.
[4]陈多锦. 血管紧张素转化酶的生物化学及其应用[J]. 生理科学, 1983, 3(2)∶ 24-36.
[5]OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensin-converting enzyme in digest s of gelatin by bacterial collagenase[J]. Biochimicaet Biophysica Acta, 1979, 566∶ 128-137.
[6]陈季旺, 孙勤, 夏文水. 鱼降压肽的大孔吸附树脂分离及其活性稳定性[J]. 食品科学, 2009, 30(18)∶ 25-28.
[7]KAWAMURA Y. Food protein and antihypretensive peptides[J]. Farming Japan, 1997, 31(1)∶ 14-19.
[8]吴建平, 丁霄霖. 食品蛋白质降血压肽的研究进展[J]. 中国粮油学报, 1998, 13(5)∶ 10-14.
[9]诸葛健, 王正祥. 工业微生物试验技术手册[M]. 北京∶ 中国轻工业出版社, 1994∶ 205-209.
[10]孙旸, 陈光, 刘艳秋. Alcalase 碱性蛋白酶水解大豆分离蛋白的研究[J]. 吉林农业大学学报, 2005, 27(2)∶ 162-166.
[11]ADLER-NISSEN J. Newer uses of microbial enzymes in food processing [J]. Trends in Biotechnology, 1987, 5(6)∶ 170-174.
[12]石继红, 赵永同, 王俊楼, 等. SDS-聚丙烯酰胺凝胶电泳分析小分子多肽[J]. 第四军医大学学报, 2000, 21(6)∶ 761-763.
[13]CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin converting enzyme of rabbit lung[J]. Biochemical Pharm, 1971, 20∶ 1637-1645.
[14]KUBA M, TANAKA K, SESOKO M, et al. Angiotensin I-converting enzyme inhibitory peptides in red-mold rice made by Monascus purpureus [J]. Process Biochemistry, 2009, 44(10)∶ 1139-1143.
[15]MARUYAMAS S, SUZUKI H. A peptide inhibitor of angiotensin I -converting enzyme in the tryptic hydrilysis of casein[J]. Agric Biol Chem, 1982, 46(5)∶ 1393-1394.
[16]MATSUI T, MATSUFUJI H, SEKI E, et al. Inhibition of angiotensin converting enzyme by Bacillus licheniformis alkaline protease hydrolyzates derived from sardine muscle[J]. Biosci Biotech Biochem, 1993, 57(6)∶ 922-925.
in vitro Hypotensive Effect of Hydrolyzed Soybean Protein
SUN Yang,SUN Chun-yu,CHEN Guang*
(College of Life Sciences, Jilin Agricultural University, Changchun 130118, China)
Soybean protein hydrolysates were prepared by enzymatic hydrolysis with alcalase. Inhibitory activities of enzymatic hydrolysates and the purification fractions to angiotensin I converting enzyme (ACE) were determined for evaluating their hypotensive effects. Results showed that both enzymatic hydrolysates and purified fractions with smaller molecular weights exhibited higher hypotensive activity. However, exonuclease treatment could result in the improvement of flavor and reduction of hypotensive activity for hydrolysates.
soybean protein;alcalase;hydrolysis;hypotensive effect
R151.2
A
1002-6630(2010)09-0272-04
2009-10-13
吉林省科技发展重点项目(20070207)
孙旸(1976—),男,讲师,博士研究生,研究方向为酶工程。E-mail:robsuny@163.com
*通信作者:陈光(1961—),女,教授,博士,研究方向为酶工程。E-mail:chg61@163.com
