土壤中正己醇降解菌的多样性研究
2010-03-22张锦华师俊玲
张锦华,师俊玲*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
土壤中正己醇降解菌的多样性研究
张锦华,师俊玲*
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
目的:筛选能够有效降低正己醇含量的微生物菌种,了解自然界中正己醇降解菌的分布与多样性。方法:以正己醇生产厂废水排放口周围的土壤为分离源,通过富集培养和分离筛选。结果:获得了6株对正己醇有显著降解作用的菌种,根据其在PDA培养基上的菌落形态和孢子形态初步分类鉴定为镰孢菌属、地霉属、毛霉属和曲霉属。其中,地霉属的菌株最多(3株),对正己醇的降解能力强,适用pH值范围广。地霉属菌株S12和S13在中性和酸性条件下对3g/L正己醇的降解率均达60%以上。结论:自然界中的正己醇降解菌在种类、生态、降解能力、作用条件等方面都具有丰富的多样性。
正己醇;多样性;正己醇降解菌;分离;筛选;分类鉴定
正己醇属于高级醇,是食品中杂醇油的主要成分之一。杂醇油是一类高沸点的混合物,具有特殊强烈的刺激性臭味,在口味上弊多利少,其含量过多会导致辛辣苦涩,给酒带来不良影响。其对人体的中毒和麻醉作用强于乙醇,能使神经系统充血,引起头痛;而且在体内的氧化速度比乙醇慢、停留时间长[1-2],具有一定的生理毒性[3]。此外,正己醇也是引起大豆豆腥味的主要成分之一[4-5]。因此,降低食品中正己醇的含量对于提高产品风味和安全性具有重要意义。
据报道,在化学催化条件下,正己醇可转化为正己醛[6-7]或己酸己酯[8-9]。考虑到化学催化过程中会产生很多的负反应,安全有效的生物转化方法在食品加工中将更具优势。微生物个体及其产生的丰富酶系是进行生物转化的重要资源。据报道,乙醇脱氢酶ADH[10]、固醇氧化酶[11]、聚乙烯醇降解酶[12-13]等能够对相应醇类进行转化,这些酶类都可以由微生物产生,有关的降解机理及特性也有广泛研究。在本实验的前期研究中,从苹果园的土壤中分离得到了一株能够降低正己醇含量的
微生物菌种,经鉴定为白地霉[14],从而证明了自然界中存在能够降解正己醇的微生物。
为了证明自然界中正己醇降解菌的微生物多样性,分离筛选正己醇降解能力强的微生物菌种,本实验以正己醇生产厂废水排放口周围的土壤为分离源,从中分离筛选能够降解正己醇的微生物菌种,对其进行分类鉴定,评价其对正己醇的降解能力。
1 材料与方法
1.1 材料与试剂
1.1.1 土壤
兰州正己醇生产厂(兰州恒澳工贸有限公司)废水排放口周围的表层土壤,直接过60目筛网,将土壤与未通过60目筛的石块分离,分别用作微生物的分离源。
1.1.2 培养基
液体富集培养基:葡萄糖20g,蒸馏水1000mL,不同质量浓度梯度正己醇(400、800、1200、1600、2000、2400、2800、3200mg/L),pH7.0。
液体分离筛选培养基:MgS O4·7H2O 0.5 g、KH2PO41.0g、NH4NO31.0g、6.67g/L CaCl2溶液3mL、17g/L的FeCl3溶液3mL、FeSO4·7H2O 0.05g、NaNO31.0g,蒸馏水1000mL。使用时设定两组pH值水平,一组为自然pH值(7.0),另一组用HCl和NaOH调节pH值至4.6。上述组分灭菌后加入经0.22μm无菌滤膜(醋酸纤维膜)过滤除菌的正己醇3mL。其中,正己醇在加入前先用0.5mL吐温-80溶解,再加入2mL无菌水,充分振荡混合均匀后过滤除菌。此处,正己醇作为培养基中的唯一碳源。
分离筛选用固体培养基:在上述液体分离筛选培养基中加入20g/L的琼脂粉。
分类鉴定用培养基:马铃薯葡萄糖琼脂培养基(PDA),其中加入20g/100mL的马铃薯浸汁1000mL,葡萄糖20g,琼脂粉20g。
1.1.3 试剂
正己醇(色谱纯) 国药集团化学试剂有限公司进口分装;其他试剂均为分析纯
1.2 仪器与设备
SW-CJ-2FD 超净工作台 苏净集团安泰公司;ES-315 TOMY高压蒸汽灭菌锅 Kogy有限公司;SPX-300B-Ⅱ生化培养箱 上海跃进医疗器械厂;ZHWY-2102 型恒温培养振荡器、HZS-H水浴振荡器 哈尔滨市东明医疗仪器厂;GC9800气相色谱仪 上海科创色谱仪器有限公司;丹佛T-203型电子天平 北京赛多利斯仪器系统有限公司;Motic BA400型数码成像光学显微镜上海精密仪器仪表有限公司。
1.3 方法
1.3.1 正己醇降解菌的驯化与富集
参照瓶富集培养技术[15-16],对过筛后的土壤样品和石块分别进行菌种的驯化富集培养,分别取土壤和石块样品10g加入到100mL不含正己醇的液体富集培养基的三角瓶中(250mL),28℃、150r/min摇床培养3d后,取含菌的培养液按体积分数10%的接种量转接至100mL含正己醇400mg/L的液体富集培养基中培养3d,完成一个驯化周期后将菌液转移到新的富集培养液中进行下一轮驯化富集培养。富集液培养条件为28℃、150r/min,按照400、800、1200、1600、2000、2400、2800、3200mg/L的水平依次提高富集培养液中的正己醇质量浓度,共计培养27d,得到富集降解正己醇菌株的培养物种子。
1.3.2 正己醇降解菌的筛选与分离纯化
采用固体平板培养的方法筛选[17]。按分离筛选用固体培养基所示成分制备平板培养基,富集驯化结束后,吸取1mL菌悬液直接涂布接种于表面,在28℃生化培养箱中培养,待有菌落长出后,选择不同形态特征的菌落,重新转接至固体筛选培养基上进行划线分离,转接3次后将初步筛选到的菌株接种至PDA培养基上继续进行进一步的纯化直到分离出纯菌种。
1.3.3 正己醇降解菌的鉴定
将待鉴定的纯化后的菌种用5mm打孔器打孔接种于PDA固体培养基上,28℃培养5d后观察其菌落生长情况和形态,挑取菌丝和孢子制成玻片,置于光学显微镜下观察菌丝形态、孢子形态以及孢子与营养体之间的着生关系,对照有关文献确定真菌的分类学地位[18-19]。
1.3.4 正己醇降解菌降解能力的检验
[20-21]将分离到的正己醇降解菌在PDA平板上活化培养3d后用打孔器打取直径为5mm的带菌培养物,按3块/30mL的量接种至pH7.0和pH4.6的正己醇基础培养液中(50mL三角瓶中装30mL培养液),水浴恒温28℃、120r/min摇床培养7d。
培养结束后,取全部培养物于3500r/min离心10min,取上层清液用0.22μm无菌滤膜过滤除菌,收集滤液用顶空进样法气相色谱测定正己醇含量(GC9800/ FID检测器),以体积分数5% 4-甲基-2-戊醇(丙酮定容)为内标,进行定量分析,考察正己醇残留量。对照为经过相同培养的含同样质量浓度正己醇的无菌体培养液。
1.3.5 正己醇残留量和降解率的测定
对照和样品中正己醇残留量用顶空进样法气相色谱检测。检测条件为:FID检测器;弹性石英毛细管柱DB-WAX-10(30m×0.32mm,0.25μm);载气为N2,进样量300μL;采取程序升温(第一阶段初始温度55℃,初温保持时间3min,升温速率:15℃/min,终止温度
200℃,终温保持时间3min;第二阶段,初始温度0℃,升温速率0℃/min,终止温度0℃)。通过内标法(以体积分数5% 4-甲基-2-戊醇(丙酮定容)为内标)获得正己醇的保留时间和峰面积。按照下式计算正己醇降解率。
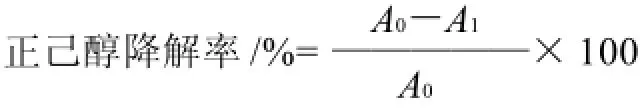
式中:A0为对照样的正己醇峰面积;A1为正己醇降解菌培养液中正己醇峰面积。
2 结果与分析
2.1 正己醇降解菌的分离筛选
通过富集驯化培养,从土壤和石块样品中初步分离得到菌种8株,经反复纯化、确认,最终获得6个不同的菌株,其中2株来自土壤,4株来自石块,且全部为真菌。
2.2 菌种的正己醇降解能力
对照样和样品的气相色谱图如图1所示。


图1 对照样(A)和样品(B)的气相色谱图Fig.1 Gas chromatography of the control and samples
培养结束后,对分离到的正己醇降解菌进行降解能力的测定,结果见表1。

表 1 所得菌株对正己醇的降解作用Table 1 Degradation of hexanol using isolated strains

表2 所筛选正己醇降解菌的菌落特征和个体特征Table 2 Morphological characteristics of colonies and spores from isolated strains
设定对照中正己醇的降解率为100%,则方差分析和多重比较分析表明,分离得到的6株菌均能显著降低样品中正己醇含量(P<0.05;6株菌与对照间差异均在α=0.05水平上达到显著水平),但不同菌株对正己醇的
降解能力和条件各不相同。除菌株S12以外,其他菌株在中性条件下对正己醇的降解率均高于酸性条件;菌株T1、T2、S2在中性条件下对正己醇的降解率可达酸性条件下的3倍以上;菌株S11对正己醇的降解作用最小,在中性和酸性条件的降解率均在30%以下。总体而言,菌株S12和S13对正己醇的降解能力最强,它们在中性和酸性条件下对正己醇的降解率均可达60%以上,是降解正己醇的优势菌株。
2.3 正己醇降解菌的分类鉴定
参考《真菌鉴定手册》[20],根据菌种在固体培养基上的菌落形态、菌丝形态、产孢方式、孢子形态和大小可知,所得正己醇降解菌分属于镰孢霉属、地霉属、毛霉属和曲霉属。其中,有3株均为地霉属。各菌株的具体特征及形态见表2及图2~7。

图2 菌株T1在PDA培养基上的菌落(A)与孢子(B)(×40)Fig.2 Colonies and spores of strain T1 on PDA (×40)

图3 菌株T2在PDA培养基上的菌落(A)与孢子(B)(×40)Fig.3 Colonies and spores of strain T2 on PDA (×40)

图4 菌株S12在PDA培养基上的菌落(A)及显微特征(B)(×40)Fig.4 Colonies and microscopic characteristics of strain S12 on PDA (×40)

图5 菌株S13在PDA培养基上的菌落(A)及显微特征(B)(×40)Fig.5 Colonies and microscopic morphology of strain S13 on PDA (×40)

图6 菌株S11在PDA培养基上的菌落(A)与孢子(B)(×40)Fig.6 Colonies and spores of strain S11 on PDA (×40)

图7 菌株S2在PDA培养基上的菌落(A)及孢子(B)(×40)Fig.7 Colonies and spores of strain S2 on PDA (×40)
3 讨论与结论
综合菌种的分类鉴定结果及其对正己醇的降解能力可以发现,自然界中的正己醇降解菌在种类、生态、降解能力、作用条件等方面都具有丰富的多样性。
3.1 自然界中正己醇降解菌的种类多样性
本研究在继令桢民等[14]之后,再次证明了自然界中存在能够降解正己醇的微生物,而且其在种类上具有一定的多样性。与其不同的是,本研究除了发现3株地霉属有正己醇降解能力以外,还发现镰孢菌属、毛霉属、曲霉属的一些菌株也能够在一定条件下降解正己醇;与其相同的是,本研究也未发现能够降解正己醇的细菌和放线菌。
3.2 正己醇降解菌的生态多样性
本实验在土壤和石块表面都分离得到了能够降解正己醇的真菌,其中来自土壤的有2株,分别为镰孢菌属和地霉属;来自石块的有4株,分别为毛霉属、曲霉属和地霉属。这可能跟菌种的生长特性,及其与土壤颗粒和石块的黏附性能有关。此外,本次采集的土壤主要来自于正己醇富集量较大的正己醇生产厂的废水排放口,令桢民等[14]所用土壤则来自于苹果园。这说明,自然界中的正己醇降解菌在生态分布上具有一定多样性。
3.3 真菌降解正己醇能力的多样性
研究发现,不同菌种和菌株在相同条件下对正己醇的降解能力存在较大差异。综合分析,毛霉属的正己醇降解能力最弱,在中性和酸性条件下的正己醇降解率均在30%以下;地霉属的正己醇降解能力较强。中性条件下,地霉属菌株S13对正己醇的降解率可达77%,
而毛霉属菌株S11的降解率仅为23%;即使同为地霉属,菌株S 1 2在酸性条件下对正己醇的降解率可达71%,而菌株T2则只有18%。
3.4 正己醇降解菌降解条件的多样性
本实验发现,不同菌种降解正己醇时所需条件和同一菌株在不同条件下对正己醇的降解能力间存在很大差异。中性条件下对正己醇降解能力最强的是菌株S13,酸性条件下对正己醇降解能力最强的是菌株S12;大多数菌株在中性条件下的正己醇降解能力均大于酸性条件,除地霉属的两株菌株S12和S13以外,其他的镰孢菌属、毛霉属、曲霉属和地霉属菌株T2在酸性条件下的正己醇降解率约为中性条件下的1/3左右。地霉属菌株S12和S13的正己醇降解率在中性和酸性条件下无显著变化,菌株S12在酸性条件下的正己醇降解率反而稍高于中性条件。这说明,不同菌株对正己醇的降解条件存在很大差异,表现出丰富的多样性。
参考文献:
[1]周新虎, 崔如生. 引起白酒口干、上头问题的初探[J]. 酿酒科技, 2001(5)∶ 44-45.
[2]张跃廷, 刘琼, 王佐民. 浅谈杂醇油[J]. 酿酒, 2002, 29(5)∶ 18-20.
[3]GAUKE V, CATHERINE W, HANS S, et al. Human health risk assessment of long chain alcohols[J]. Ecotox Environ Safe, 2009, 72(4)∶1016-1030.
[4]谢继志, 肖丽霞, 夏玉雷, 等. 脱腥方法对豆浆中正己醛和正己醇含量的影响[J]. 江苏农学院学报, 1996, 17(1)∶ 155-173.
[5]MOREIRA M A, TAVARES S R, RAMOS V, et al. Hexanal production and TBA number are reduced in soybean [Glycine max (L.) Merril] seeds lacking lipoxygenase isozymes 2 and 3[J]. Journal of Agricultural and Food Chemistry, 1993, 41(1)∶ 103-106.
[6]周广栋, 郭晓红, 刘延, 等. 正己醇氧化生成正己醛磷钨杂多酸催化剂的过氧化氢分解活性[J]. 分子催化, 2001, 15(4)∶ 267-272.
[7]王磊, 程铁欣, 周广栋. 正己醇(氧化)脱氢制正己醛的研究[J]. 分子催化, 2003, 17(6)∶ 434-438.
[8]何建英, 刘素环, 陈丹红. 己酸己酯的催化合成[J]. 化工中间体, 2007 (4)∶ 7-8.
[9]YANG W, BILLY J, TAAIT Y B, et al. H3PW12O40 supported on Cs modified mesoporous silica∶ catalytic activity in n-butane isomerisation and in situ FTIR study∶ Comparison with microporous CsxH3-xPW12O40 [J]. Catalysis Today, 2002, 73(1/2)∶ 153-165.
[10]曾芳芳, 刘盛元, 王滨有. 乙醇脱氢酶基因多态性与饮酒行为及所致相关疾病的研究进展[J]. 疾病控制杂志, 2008, 12(2)∶ 164-167.
[11]张国华, 丛爱日, 徐国宾, 等. 3α-羟类固醇脱氢酶的表达、纯化和酶学性质研究[J].微生物学报, 2004, 44(4)∶ 496-499.
[12]SUZUKI T, ICHIHARA Y, YAMADA M. Some characteristics of Pseudomonas O-3 which utilizes polyvinyl alcohol[J]. Agricultural and Biological Chemistry, 1973, 37(4)∶ 747-756.
[13]TOKIWA Y, KAWABATE G, JARERAT A. A modified method for isolating (polyvinyl alcohol) degrading bacteria and study of their degradation patterns[J]. Biotechnoogy Letters, 2001, 23∶ 1937-1941.
[14]令桢民, 师俊玲, 杨保伟. 正己醇降解菌的分离、筛选及分类鉴定[J]. 菌物学报, 2009, 28(6)∶ 769-775.
[15]黄星, 何健, 潘继杰, 等. 甲磺隆降解菌FLDA的分离鉴定及其降解特性研究[J]. 土壤学报, 2006, 43(5)∶ 821-827.
[16]王学东, 欧晓明, 王慧利, 等. 除草剂咪唑烟酸高效降解菌的筛选及其降解性能的研究[J]. 农业环境科学学报, 2006, 22(1)∶ 102-105.
[17]杨文博. 微生物学实验[M]. 北京∶ 化学工业出版社, 2004∶ 44-48.
[18]魏景超. 真菌鉴定手册[M]. 上海∶ 科学技术出版社, 1979∶ 1-780.
[19]巴尼特 H L, 亨特B B. 半知菌属图解[M]. 北京∶ 科学出版社, 1977∶1-240.
[20]王春艳, 丁永生. 石油降解菌的筛选及其降解特性[J]. 大连海事大学学报, 2008, 34(3)∶ 9-12.
[21]李爱华, 樊明涛, 师俊玲. 杜仲内生菌的分离及产PDG菌株的筛选[J]. 西北植物学报, 2007, 27(3)∶ 616-619.
Diversity of Hexanol-degrading Strains in Soil
ZHANG Jin-hua,SHI Jun-ling*
(College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
Hexanol is an unfavorable flavor in food. Too much hexanol in food is harmful for human health. Screening and understanding diversity of hexanol-degrading microorganisms are helpful for biological degradation of hexanol and its potential application in food industry, which will provide basic information for further research on hexanol-degrading mechanisms. Soil around wastewater outfalls of hexanol-producing plants was used as the resources to screen hexanoldegrading microorganisms. After enrichment and isolation, 6 strains with degradation capability for hexanol were obtained. Based on morphological characteristics of colonies and spores, 6 strains were classified as fungi, which belonged to Fusarium Link, Geotrichum Link, Mucor Link and Aspergillus P. Micheliex Link, respectively. Geotrichum Link had 3 isolated strains, which exhibited higher hexanol-degrading capacity and wider suitability of pH. The strains in Geotrichum Link, S12 and S13 could result in the degradation of 3 g/L hexanol up to 60% under both neutral and acidic conditions. The rich diversity of hexanol-degrading strains in soil was reflected in species, ecology, degradation capacity, conditions and other aspects.
hexanol;diversity;hexanol-degrading strains;isolation;screening;identification
Q939.5
A
1002-6630(2010)09-0177-05
2009-08-17
国家葡萄产业技术体系项目(nycytx-30-ch-03);西北农林科技大学科技创新专项(cx200905)
张锦华(1984—),女,硕士研究生,研究方向为食品生物技术。E-mail:orange04zhang@yahoo.com.cn
*通信作者:师俊玲(1972—),女,教授,博士,研究方向为食品生物技术。E-mail:sjlshi2004@yahoo.com.cn
