鸡源大肠杆菌的分离鉴定及药敏试验研究
2010-03-22黄翠峰山东省青岛市城阳区农业局266109
李 萍 黄翠峰 (山东省青岛市城阳区农业局 266109)
鸡大肠杆菌病是大肠埃希氏杆菌引起的鸡病的总称。近年来,在一些养殖密集区广泛流行,个别地方呈暴发性流行的趋势,且在使用抗菌药物防治后,疗效往往不明显。用药时稍好,停药后复发,发病率和死亡率居高不下。随着养禽业的迅速发展与高度集约化饲养,鸡大肠杆菌病已成为鸡群重要的疾病之一[1]。
为了控制鸡大肠杆菌在鸡群中的传播,对鸡场采集的疑似大肠杆菌病例进行病原的分离和药敏试验研究,通过对鸡源大肠杆菌进行分离纯化、生化鉴定和药敏试验,检测出药敏试验中分离到的大肠杆菌菌株对哪些药物高度敏感,对哪些中度敏感,对哪些不敏感,以便能更好地指导对家禽进行科学用药,减少损失。
1 材料与方法
1.1 材料
1.1.1 病料 城阳某养鸡场病鸡、死鸡的肝脏。
1.1.2 抗菌药物 氨基糖苷类:庆大霉素(GEN)、新霉素(NEO)、链霉素(STR)、安普霉素(ANP)、阿米卡星(AN)。氟喹诺酮类:诺氟沙星(NOR)、恩诺沙星(ENO)、环丙沙星(CIP)、达氟沙星(DFL)、左氧氟沙星(OFL)。大环内酯类:大环霉素、泰乐菌素。硫酸菌素类:硫酸黏菌素。双萜类:泰妙菌素
1.2 方法
1.2.1 培养基的制备 肉汤:称取12.5g溶于500ml蒸馏水中,加热煮沸至完全溶解,经121℃15min高压灭菌,置于4℃保存备用。营养琼脂:称取33g于1000ml蒸馏水中,加热煮沸至完全溶解,经121℃15min高压灭菌,制成平板和斜面,置于4℃保存备用。麦康凯琼脂:称取55g溶于1000ml蒸馏水中,加热煮沸至完全溶解,115℃20min高压灭菌,制成平板,置于4℃保存备用。三糖铁琼脂:称取32.5g于1000ml蒸馏水中,加热煮沸至完全溶解,分装试管,115℃15min高压灭菌,制成高层斜面,置于4℃保存备用
1.2.2 大肠杆菌的接种 无菌采取病鸡、死鸡的肝脏接种在麦康凯琼脂平板,平板倒置于37℃温箱培养24h。
1.2.3 大肠杆菌的增菌与分离纯化 从培养24h的麦康凯琼脂平板上挑取粉红色、边缘光滑的大肠杆菌可疑菌落接种于肉汤中,37℃恒温培养24h进行增菌。将纯化的大肠杆菌接种到琼脂斜面,37℃恒温培养24h。然后用20%甘油生理盐水冲洗斜面,4℃保存。
1.2.4 大肠杆菌的生化鉴定(1)五糖发酵试验。在无菌操作台上,用接种针将分离纯化的疑似大肠杆菌单菌落接种于五糖微量反应管,并封口标号,置于37℃恒温培养22~24h。(2)三糖铁试验。用接种针将疑似大肠杆菌单菌落划线接种于三糖铁斜面上并进行穿刺,37℃恒温培养22~24h。(3)IMVC试验。将疑似大肠杆菌的菌样分别接种于蛋白胨水培养基(吲哚试验),葡萄糖蛋白胨水培养基(甲基红试验和VP试验),柠檬酸盐斜面培养基(柠檬酸盐试验)中,置于37℃ 2d[6]。(4)尿素酶试验。用接种针将疑似大肠杆菌菌落接种于尿素微量反应管,37℃恒温培养22~24h。(5)枸橼酸盐试验。用接种针将疑似大肠杆菌菌落接种于枸橼酸盐微量生化反应管,37℃恒温培养22~24h。
1.2.5 大肠杆菌的药敏试验(1)标准菌液的制备。①肉汤增菌:在已分离纯化的待测菌平板上挑取4~5个相同菌落,接种到3~5ml MH肉汤中,置于35℃增菌2~8h[7],以待生长至轻微或中等浊度。根据平板计数法测出菌液所需稀释倍数以制成标准菌液,使菌液中细菌的浓度为108个/ml,稀释时用生理盐水或MH肉汤。平板计数:编号,取无菌平板18套,分别用记号笔标明10-6、10-8、10-9、10-10、10-11、10-12(稀释度)各3套。另取4支盛有4950µl无菌水的试管,依次标示10-2、10-4、10-6、10-8,另取4支盛有4.5ml无菌水的试管,依次标示10-9、10-10、10-11、10-12。稀释:用微量加样器取50µl已充分混匀的大肠杆菌菌悬液,加至10-2试管中,此即为100倍稀释。将10-2试管置于试管振荡器上振荡,使菌液充分混匀。取一支1ml吸管插入10-2试管中来回吹吸菌悬液3次,进一步将菌体分散、混匀。用微量加样器取10-2菌液50µl加至10-4试管中,此即为104倍稀释,以此类推,至10-8试管时,用微量加样器取0.5ml菌悬液加至10-9试管中,混匀。之后进行10倍稀释,整个过程表1所示。②大肠杆菌菌悬液。取样:用6支1ml无菌吸管分别吸取10-6、10-8、10-9、10-10、10-11和10-12、的稀释菌悬液各1ml,对号放入编好号的每个无菌平皿中。倒平板:尽快向上述盛有不同稀释度菌液的平皿中倒入融化后冷却至45℃左右的牛肉膏蛋白胨培养基约15ml/平皿,置水平位置迅速旋动平皿,使培养基与菌液混合均匀,而又不使培养基荡出平皿或溅到平皿盖上。待培养基凝固后,将平板倒置与37℃恒温培养箱中培养。计数:培养48h后,取出培养平板,算出同一稀释度三个平板上的菌落平均数,并按下列公式进行计算:每毫升菌落形成单位(cfu)=同一稀释度三次重复的平均菌落数×稀释倍数。一般选择每个平板上长有30~300个菌落的稀释度计算每毫升的含菌量较为合适。同一稀释度的三个重复对照的菌落数不应相差很大,否则表示试验不准确。③肉汤菌液的稀释。根据平板计数结果可以得出每毫升肉汤菌液中含有的细菌个数,然后按照相应的稀释倍数将菌液稀释至108个/ml,即为标准菌液。(2)抗生素原液的制备。配制各种抗菌药物原液的溶剂和稀释剂不尽相同,可参考下表2,原液浓度常为测定最高浓度的10倍以上。原液配好后用过滤法除菌,小量分装备用。大部分抗菌药物原液在-20℃以下保存3个月,在4℃下保存1周[7]。(3)药物敏感性的测定。用肉汤常量稀释法对大肠杆菌的药物敏感性进行测定。①抗菌药物的稀释。将每种药物用其相应的稀释剂稀释至待测最高浓度的两倍。另取9支试管,每支试管中加MH肉汤2ml,向第一支试管中加入2ml稀释的待测抗菌药物,依次对倍稀释至第8管,第9管不加抗菌药物,第10管只加肉汤作为对照。②测试菌的准备。用MH肉汤10倍稀释标准菌液,使之含菌量为107个/ml。③接种。用微量加样器取0.1ml待测菌液依次由低浓度到高浓度加到各稀释度的试管中,最终接种菌量约为5×105个/ml。加样时加样器吸头需插至管内液面下加菌并注意避免与管内壁接触,加好菌液后的试管应避免晃动。④孵育及阅读结果。35℃孵育16~20h后,完全抑制测试菌肉眼可见生长的最低药物浓度为该药对测试菌的MIC。
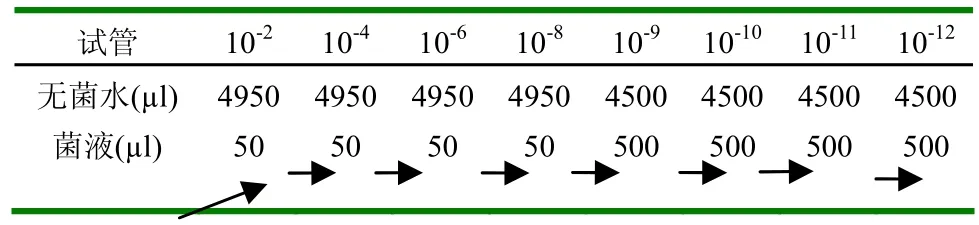
表1 平板计数法稀释过程

表2 常用抗菌药物的溶剂及稀释剂
2 结果与分析
2.1 生化鉴定结果
葡萄糖、乳糖均能被利用产酸产气,麦芽糖和甘露糖可被利用产酸,而蔗糖则不能被利用。(1)吲哚试验:在培养48h后的蛋白胨水培养基内加3~4滴乙醚,摇动数次,静置1~3min,待乙醚上升后,沿试管壁徐徐加入两滴吲哚试剂,在乙醚和培养物之间产生红色环状物为阳性反应。(2)甲基红试验:培养48h后,将葡萄糖蛋白胨水培养物内加入甲基红试剂2滴,培养基变为红色为阳性。(3)VP试验:培养48h后,将葡萄糖蛋白胨水培养物内加入5~10滴40%KOH,然后加入等量的5%α-萘酚溶液,用力振荡,再放入37℃恒温箱中保温15~30min,以加快反应速度。反应结果为阴性。(4)柠檬酸盐试验:培养48h后观察弄檬酸盐斜面培养基上有无细菌生长和是否变色。结果呈绿色为阴性。
另外在尿素酶试验和枸橼酸盐试验中反应结果都为阴性。
以上鉴定结果符合大肠杆菌的生化特征,本试验成功分离出3株大肠杆菌。
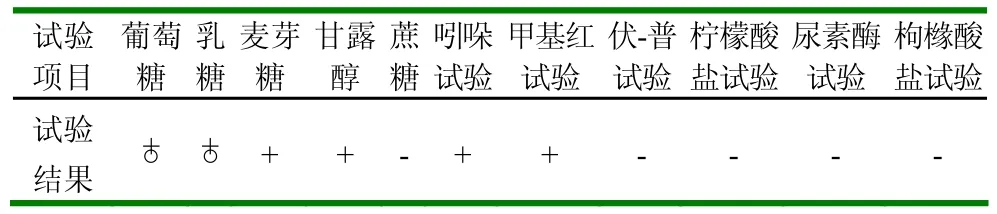
表3 生化鉴定结果
2.2 菌落计数结果

表4 菌落计数结果
选择每个平板上长有30~300个菌落的稀释度计算每毫升的含菌量较为合适,因此,选取10-9稀释度较为合适,则肉汤菌液的菌落密度为5.1×1010cfu数/ml。将该菌液稀释500倍即可制成标准菌液。
2.3 药敏试验结果
其中全部3株大肠杆菌都对硫酸庆大霉素、硫酸安普霉素、硫酸黏菌素、恩诺沙星、诺氟沙星、达氟沙星、左氧氟沙星、阿米卡星、环丙沙星、硫酸新霉素敏感。对大环霉素一株中度敏感,两株不敏感即耐药。对硫酸链霉素1株中度敏感,两株耐药。其中全部三株大肠杆菌对泰妙菌素耐药,而泰乐菌素则不起任何有效作用。
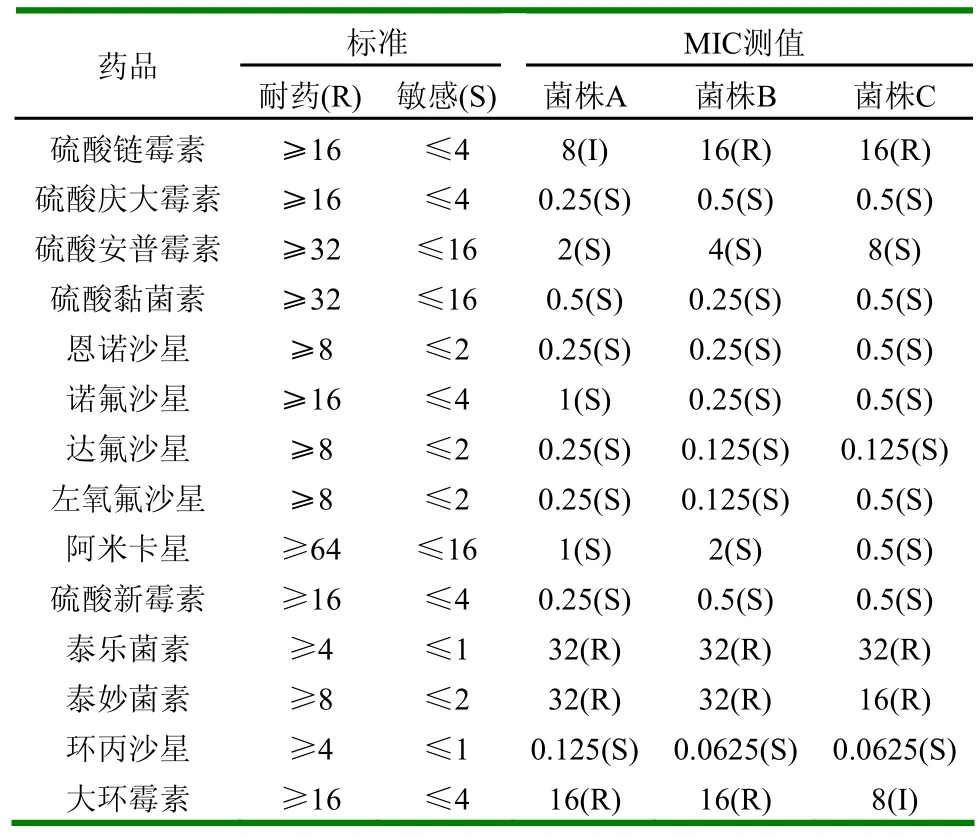
表5 各种抗生素对大肠杆菌的MIC及MIC (µg/ml)
3 讨论
试验结果表明,大肠杆菌除对硫酸庆大霉素、硫酸黏菌素、恩诺沙星、诺氟沙星、达氟沙星、左氧氟沙星、阿米卡星、硫酸新霉素、环丙沙星有较高的敏感性外,对其他抗菌药物链霉素、大环霉素、硫酸安普霉素、泰妙菌素、泰乐菌素等具有不同程度的抗药性,这可能与大肠杆菌的耐药性质粒基因的差异有关。对于有的药,原来是敏感的,但现在不敏感,可能是因为药物存放时间过长其抗菌性减弱及其操作过程中人为因素所导致,因此,对结果应当综合评定。这对临床上正确、合理地选用抗菌药物有一定参考意义。正确利用药敏试验的结果,从而选取高效药物对患病家禽进行治疗。平时应当多注意积累经验,掌握技巧,就能真正在实际生产中发挥积极的作用。
[1]汪毅,刘永德,刘帅等.鸡大肠杆菌分离鉴定与药敏试验[J].上海畜牧兽医通讯,2001,6(4):18-19.
[2]许兰菊,蒋媛媛,刘红英等.鸡大肠杆菌病的病原分离鉴定与药敏试验研究[J].河南农业大学学报,2003,12(4):392-395.
[3]牛艺儒,宁官保.大肠杆菌的药敏试验[J].山西农业大学学报,2005, 12(5):30-34.
[4]Craig,W.A.Qualitative susceptibility tests[J].Diagn Microbiol Infect Disease,2003,6 (16) : 231-236.
[5]Fenover,F.C.and J.Tokars.Ability of clinical laboratories to detect antimirobial resistant enterocci[J].Clin Microbial,2003,12(31):17-18.
[6]沈萍,范秀容,李广武.微生物学实验[M].北京:高等教育出版社,2004,120-123.
[7]管远志,王艾琳,李坚.医学微生物学实验技术[M].北京: 化学工业出版社,2005,8:115-117.
