非晶化玉米淀粉的理化性质
2010-03-14刘天一李德海
刘天一,马 莺,李德海,2
(1.哈尔滨工业大学食品与工程学院,哈尔滨150090,ltyone80@gmail.com; 2.东北林业大学林学院,哈尔滨150040)
淀粉是一种天然多晶化合物,包含结晶区和无定形区,结晶区主要由支淀粉分子以双螺旋结构形成,结构较为致密,不易被外力和化学试剂作用;无定形区主要由直链淀粉分子以松散的结构形成,容易受外力和化学试剂作用.淀粉的非晶化是采用外力破坏淀粉结晶区的结构,形成了一种介于淀粉的多晶颗粒态和糊化态的中间体系——非晶化淀粉,其具有非晶性,但不具有糊化性;具有颗粒性,但不具有结晶性[1-2].非晶化淀粉的化学、物理和生物反应活性明显不同于原淀粉[3].
其中球磨研磨法制备的非晶化淀粉最具有可行性,既不需添加任何试剂,且操作便利、环境污染小,因此,以球磨研磨法来制备非晶化淀粉.通过扫描电子显微镜、X射线衍射法、差式扫描量热计、快速黏度分析仪和全自动气体吸附仪等分析手段讨论其形态、晶体结构、热特性、糊化特性以及其他性质等的变化.
1 试验
1.1 试验材料和仪器
原料:食品级玉米淀粉:长春黄龙食品工业有限公司.
仪器:QM-DK2行星式低温球磨机;RVAEzi快速黏度分析仪;DSC-6差示扫描量热仪; Autosorb-1-c全自动气体吸附仪;BA300POL偏光显微镜;S-3400N扫描电镜;Mastersizer S粒度分析仪;D-max-2500型X射线衍射仪;UV-754紫外可见分光光度计.
1.2 实验方法
1.2.1 非晶化淀粉的制备
将定量的玉米淀粉和研磨球一起加入到陶瓷罐中,选用球数比Φ20 mm∶Φ10 mm=1∶2的陶瓷球,控制球磨罐的填料率在25%左右,球磨罐的内容积约为500 mL,球料比即研磨球和淀粉的质量比约为5.7∶1,在10~20℃、球磨机转速约为480 r/min的条件下干法研磨2.35 h,制得样品密封保存,并及时分析.
1.2.2 颗粒形貌与粒度分析
扫描电子显微镜(SEM):通过S-3400N型扫描电镜观察其表面结构,并拍摄照片记录,扫描电镜加速电压为15 kV.
偏光显微镜(PLM):将质量分数为1%的淀粉乳滴于载玻片上,于偏振光下观察和拍摄淀粉颗粒的形貌及偏光十字的变化情况.
淀粉颗粒分布:在超声波作用下以乙醇作为溶剂均匀分散淀粉后,将其倒入Mastersizer S粒度分析仪的大烧杯中测定粒度分布及粒度大小.
1.2.3 X射线衍射(XRD)分析
测试条件:衍射角2 θ,4°~37°;步长,0.02°;扫描速度,8°/min;积分时间,0.2 min;靶型,Cu;管压、管流,40 kV、30 mA;狭缝,DS 1°,SS 1°,RS 0.3 mm;滤波片,Ni.淀粉相对结晶度(CR)的计算参照文献[4]的方法,使用MDI Jade软件进行分析计算,取3次拟合结果平均值.
1.2.4 热特性分析(DSC)
称取淀粉样品3.0 mg(干基)于铝盘中,并以1∶3的比例加入去离子水,密封后平衡24 h,以水作为参比,加热范围为20~120℃,加热速率10℃/min.相变参数分别用起始温度(to)、峰值温度(tp)、最终温度(tc)和焓变(ΔH)表示.
1.2.5 糊化性质分析(RVA)
测试过程的温度采用Std1升温程序进行,具体步骤参照文献[5].RVA谱特征值用峰值黏度(υP)、谷值黏度(υT)代表热糊黏度、最终黏度(υF)代表冷糊黏度、衰减度(υB=υP-υT)和回生值(υS=υF-υT)表示.粘滞值单位用cP表示.
1.2.6 比表面积及孔径的测定
将样品在70℃下真空脱气处理24 h以去除样品表面吸附的空气,采用 Micromertics ASAP 2000系统在液氮温度(77.35 K)下,以高纯N2做吸附质测定样品的吸附-脱吸等温线,由BET (Brunauer-Emmett-Teller)方程计算比表面积,BHJ(Barrett-Joyner-Halenda)法分析孔比表面积、孔容、孔径和孔分布.N2的分子截面积为16.2[6].
1.2.7 非晶化玉米淀粉特性研究
以原玉米淀粉为对照样品,分别测定非晶化玉米淀粉的溶解度、膨胀度、浊度和持水能力.溶解度和膨胀度的测定参照Clement等[7]的方法;浊度测定参照singh等[8]的方法,连续观测17 d;持水能力测定参照singh等[9]的方法.
1.2.8 数据处理
采用SPSS软件进行数据统计分析,所有数据均重复3次.
2 结果与分析
2.1 颗粒形态与粒度分布
非晶化玉米淀粉的颗粒形貌、偏光十字如图1所示.原玉米淀粉颗粒为圆形或多角形,表面光滑且有细小的微孔存在,在偏光显微镜下观察时,淀粉的双折射现象明显,可看到淀粉颗粒脐点处有交叉的偏光十字.而非晶化玉米淀粉由于受到机械活化作用,淀粉颗粒表面破裂、发生变形、颗粒膨胀,部分颗粒出现层状剥落现象,双折射现象几乎完全消失,观察不到偏光十字的存在,这种现象是非晶化淀粉的典型特征之一.Stolt等人用超过550 MPa超静压力处理大麦淀粉时发现,淀粉的双折射现象也完全消失,证实此时淀粉已经从多晶态转变成非晶态[10].
非晶化玉米淀粉颗粒的中位径(D50)和颗粒分布情况如表1所示.原玉米淀粉颗粒分布比较集中,约70%的颗粒都分布在10~20 μm范围内,中位径为13.81 μm;而非晶化玉米淀粉颗粒粒径分布范围则变宽(1~80 μm),颗粒从集中分布转向均匀分布,颗粒尺寸变大,中位径增大到18.13 μm.这是因为在研磨球与粉末的碰撞、摩擦、冲击、剪切作用下淀粉颗粒发生脆性断裂,而当淀粉颗粒尺寸小于其韧-脆半径时则向韧性破裂转变,从而产生能量弛豫现象,淀粉颗粒表面活性能增高,出现“阈效应”使得颗粒内部出现断层流动,进而导致颗粒变形,内部产生晶格缺陷,结晶程度降低,向大颗粒尺寸方向移动,粒径分布变得均匀而广泛[11].

图1 非晶化玉米淀粉的SEM(×3 000)和POM(×600)

表1 淀粉颗粒粒度分布
2.2 X射线衍射分析
XRD主要用来研究淀粉的聚集状态,即淀粉的结晶性.那些晶粒线度大、晶形完整即长程有序的区域在XRD曲线上表现出明显的尖峰衍射特征,称为结晶区;而那些处于短程有序、长程无序的区域在XRD曲线上表现出明显的弥散衍射特征,称为无定形区(即非晶区).
非晶化玉米淀粉的XRD曲线如图2所示,原玉米淀粉分别在衍射角2 θ为15.28°、17.32°、18.10°和22.98°处有几个特征峰,这是典型的A -型衍射结构特征,而非晶化玉米淀粉的XRD图中尖峰衍射特征消失转而呈现出弥散峰,相对结晶度由原来的23.4%下降到1.91%.说明淀粉中结晶结构已经转变为无定形结构,淀粉从多晶态转变为非晶态[2].这一结论也证实了偏光显微镜的观察结果.在机械力强烈的研磨作用下,淀粉颗粒层状结构的层间质点结合力因相对较弱而容易受到破坏,产生晶格缺陷,形成非晶态层且逐步变厚,最后整个结晶结构被破坏,淀粉由多晶态转变为非晶态[12].
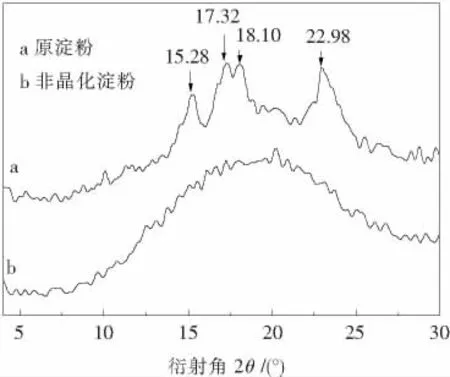
图2 非晶化玉米淀粉的XRD曲线
2.3 热特性分析
DSC主要用来测量淀粉的物理性质与温度的关系,通过研究在一定温度范围内淀粉颗粒的热相变过程来判定淀粉的结构变化.
从图3可见,原玉米淀粉在30~120℃范围内存在一个明显的吸热峰,该吸热峰的热焓约为14.07 J/g,糊化温度为61.6~72.6℃.而非晶化淀粉在测量温度内观察不到吸收峰,检测不到糊化温度和热焓.原玉米淀粉颗粒是由无定形区与结晶区连结,在其发生水合/溶胀的同时伴随着微晶的融化,因而产生了吸热峰,此吸热峰是淀粉颗粒由多晶态向非晶态转变引起的,而不是由颗粒态向糊化态转变产生的,因此,该吸收峰也是淀粉多晶体系发生了明显相变的一个标志[2,13],而非晶化淀粉在此温度范围内的吸收峰完全消失,这一现象再次证实了以上的试验结果,淀粉已由多晶态转变为非晶态.
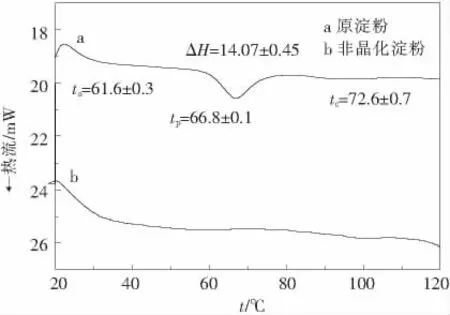
图3 非晶化玉米淀粉的DSC曲线
2.4 颗粒糊化特性分析
图4所示为非晶化玉米淀粉的RVA曲线,RVA曲线是一定质量浓度的淀粉溶液在加热、高温、冷却过程中,其黏滞性发生一系列变化的过程曲线,其在加热、高温和冷却过程中的特征黏度值依次为υP、υT和υF,分别代表淀粉溶液在加温过程中因微晶束熔融形成胶体网络时的最高黏度值,保温过程中淀粉从凝胶态渐变为溶胶态出现稀懈现象时的最低黏度值,以及在冷却过程中,淀粉分子因重新缔合出现胶凝现象时黏度回升后的最终值[8];还有两个特征黏度值为υB和υS,其中υB为υP与 υT的差值,反映了淀粉的热糊稳定性[14].υS为υF与υT的差值,这一特征值反映了淀粉糊的稳定性和老化趋势[15].非晶化后的淀粉结晶度低、颗粒破裂程度大,形成淀粉糊的流动阻力下降,因此特征黏度值υP、υT和υF相应分别低于原淀粉2 916 cP、1 988 cP和3 301 cP,并且非晶化玉米淀粉的υB值和υS分别小于原淀粉4.2倍和6.9倍,这一现象说明非晶化玉米淀粉的热糊稳定性要优于原淀粉,且此种淀粉不易老化、回生,提高了淀粉颗粒的冷糊力学稳定性.因此,非晶化玉米淀粉的黏度均低于原玉米淀粉,更适用于应用到高浓低黏的体系中,且非晶化玉米淀粉的热糊稳定性和冷糊稳定性都优于原玉米淀粉.
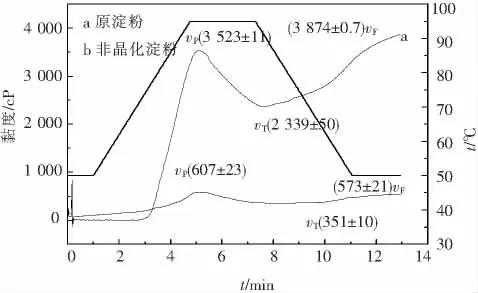
图4 非晶化玉米淀粉的RVA曲线
2.5 N2吸-脱附等温线、比表面积和孔径的测定
非晶化玉米淀粉的N2吸-脱附等温线、孔径微分分布图分别如图5,6所示.图5中等温线曲线呈现上凸的形状,且两种淀粉吸附和脱附时等温线均不重合,分别在分压段出现对应的滞后环,而非晶化玉米淀粉的滞后环要相对大于原玉米淀粉的滞后环.根据国际纯粹与应用化学联合会IUPAC分类方法,此类等温线均属于第Ⅱ类多层吸附[16],表明吸附剂具有5 nm以上的孔,发生吸附时吸附剂上的第一层吸附热要大于吸附质的凝聚热.滞后环的产生则是由于N2在淀粉内产生毛细凝聚的结果,环越大表示孔径越大,经研究发现,酶解多孔淀粉也会出现相同的结果,且淀粉颗粒表面可见清晰的孔洞存在[6].孔径的微分分布能反映出淀粉中大小孔径的分布几率,由图6可知非晶化玉米淀粉的孔径分布曲线几乎都在原淀粉的上方,且两种淀粉的孔均为中孔(2~50 nm).因为两种淀粉对N2吸附在低压区服从BET二常数方程,由BJH法计算得出两种淀粉的孔结构测试结果见表2.非晶化玉米淀粉的比表面积和平均孔径分别大于原淀粉2.9倍和1.2倍.
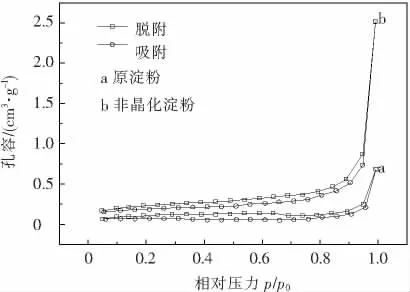
图5 非晶化玉米淀粉N2吸附-脱附等温曲线
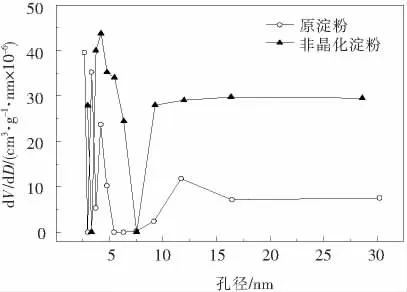
图6 非晶化玉米淀粉孔径微分分布图
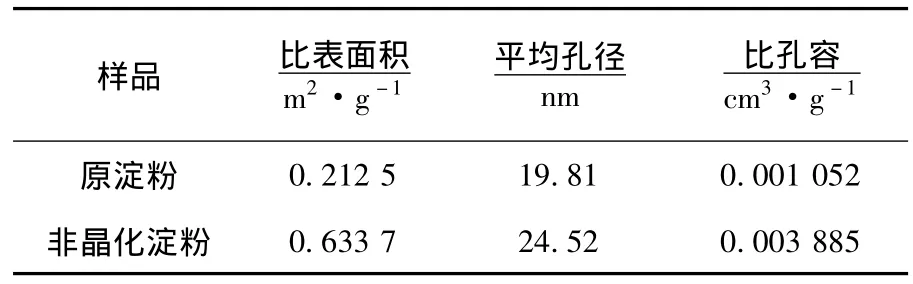
表2 淀粉孔结构参数
2.6 淀粉的溶解性和膨胀性
由图7可知,原玉米淀粉和非晶化玉米淀粉的溶解度和膨胀度都随着温度的提高而增大,这是因为随着温度的提高,淀粉分子结晶区中被切断的氢键数目增多,结晶结构破坏加剧,使得游离水更易于渗入淀粉分子内部.因此,淀粉的溶解度和膨胀度越来越大[17];且图中非晶化玉米淀粉的溶解度与膨胀度均高于原淀粉,原玉米淀粉在机械力作用下,淀粉颗粒外壳逐渐破裂,比表面积增大,导致表面能增加,活性点增多,同时机械作用也破坏了淀粉的晶格结构,解离了淀粉的双螺旋结构,这些机械力化学效应极大地促进了水分子和淀粉分子游离羟基的结合,所以非晶化玉米淀粉的溶解度和膨胀度均大于原淀粉[7].这一特性说明非晶化玉米淀粉与水这种溶剂的亲和力更强,反应活性更高.
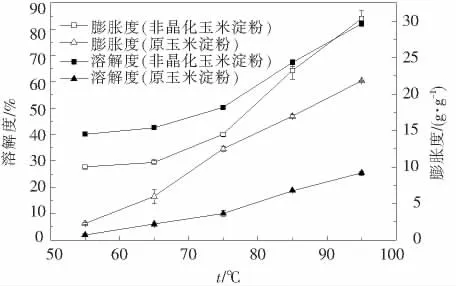
图7 非晶化玉米溶解度和膨胀度的变化
2.7 淀粉的浊度和持水能力
非晶化玉米淀粉的持水能力和浊度的变化见图8所示,与原淀粉相比,非晶化玉米淀粉的持水能力增加明显,是其持水能力的5.3倍.非晶化玉米淀粉的结晶结构受到破坏,使得水分子更容易与其直链和支链淀粉形成氢键,从而引起淀粉持水能力的提高[7].随着贮藏时间的延长,淀粉糊的浊度逐渐增大,但非晶化淀粉糊浊度变化远远低于原淀粉.在第17天时,原玉米淀粉的浊度是非晶化玉米淀粉浊度的2.6倍.淀粉糊的浊度不但与颗粒大小有关,还与颗粒膨胀能力、浸出直链、支链淀粉含量、淀粉直链和支链链长以及淀粉链在分子内和分子间结合方式等有关[8].浊度的增加说明淀粉在贮藏期间发生了老化,分子发生重新排列生成重结晶结构.与原淀粉相比非晶化淀粉颗粒尺寸增大,颗粒发生形变,膨胀度大,在水中易成为伸展的分子状态,对光的反射减小,吸光度小而表现出较低的浊度[18].因此,非晶化玉米淀粉的浊度低于原玉米淀粉说明非晶化玉米淀粉不易回生,这一结果又与糊化特性研究结果相一致.
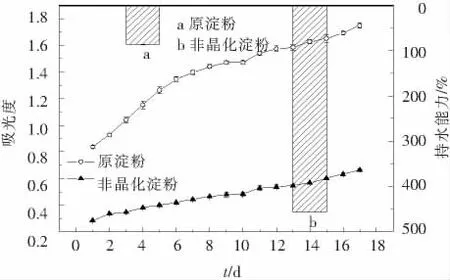
图8 非晶化玉米淀粉持水能力和浊度的变化
3 结论
1)非晶化玉米淀粉的结晶结构和颗粒形貌都受到了破坏,相对结晶度由原玉米淀粉的23.4%下降到1.91%,颗粒偏光十字消失,淀粉颗粒从多晶态转至无定形态,颗粒比表面积从原玉米淀粉的0.212 5 m2/g增大到0.633 7 m2/g,粒径分布拓宽到1~80 μm,中位径增大到18.13 μm,颗粒中平均孔径增大1.2倍.
2)非晶化玉米淀粉的糊化温度、热焓值都降低无法检测,表明支链淀粉中双螺旋结构被打开,淀粉已转至非晶化状态;非晶化玉米淀粉的υP、υT和υF均低于原玉米淀粉,原玉米淀粉的υB和υS分别是非晶化玉米淀粉的4.2倍和6.9倍,说明非晶化玉米淀粉的热糊稳定性和冷糊力学稳定性都强于原淀粉.
3)非晶化玉米淀粉的溶解度、膨胀度比原玉米淀粉要高,且都随着温度的增加而增大;浊度低于原淀粉,随着贮藏时间的延长增加缓慢,至第17天时原玉米淀粉的浊度是非晶化玉米淀粉浊度的2.6倍.其持水能力是原玉米淀粉的5.3倍.
[1] TANG H,MITSUNAGA T,KAWAMURA Y.Molecular arrangement in blocklets and starch granule architecture[J].Carbohydrate Polymers,2006,63(4): 555-560.
[2] HUANG Z Q,LU J P,LI X H,et al.Effect of mechanical activation on physico-chemical properties and structure of cassava starch[J].Carbohydrate Polymers,2007,68(1):128-135.
[3] 刘培玲,张本山.非晶颗粒态淀粉[J].中国粮油学报,2006,21(2):18-22.
[4] NARA S,KOMIYA T.Studies on the relationship between water-satured state and crystallinity by the diffraction method for moistened potato starch[J]. Starch,1983,35(12):407-410.
[5] YAO N,PAEZ A V,WHITE P J.Structure and function of starch and resistant starch from corn with different doses of mutant amylose-extender and floury-1 alleles[J].Journal of Agricultural and Food Chemistry,2009,57(5):2040-2048.
[6] 徐忠,王鹏,嵺铭.玉米多空淀粉吸附性能研究[J].哈尔滨工业大学学报,2007,39(4):581-585.
[7] CLEMENT A O,VASUDEVA S.Physico-chemical properties of the flours and starches of two cowpea varieties(Vigna unguiculata(L.)Walp)[J].Innovative Food Science&Emerging Technologies,2008,9(1): 92-100.
[8] SINGH J,SINGH N.Studies on the morphological,thermal and rheological properties of starch separated from some Indian potato cultivars[J].Food Chemistry,2001,75(1):67-77.
[9] SINGH N,SINGH S K,KAUR M.Characterization of starches separated from Indian chickpea(Cicer arietinum L.)cultivars[J].Journal of Food Engineering,2004,63(4):441-449.
[10] STOLT M,OINONEN S,AUTIO K.Effect of high pressure on the physical properties of barley starch[J].Innovative Food Science&Emerging Technologies,2001,1(1):167-175.
[11] BOLDYREV V V,PAVLOV S V,GOLDBERG E L. Interrelation between fine grinding and mechanical activation[J].International Journal of Mineral Processing,1996,44/45:181-185.
[12] MORRISON W R,TESTER R F,GIDLEY M J. Properties of damaged starch granules.II.crystallinity,molecular order and gelatinisation of ballmilled starches[J].Journal of Cereal Science, 1994,19(3):209-217.
[13] 张本山,徐立宏,高大维.用差示扫描量热法研究高交联非糊化淀粉的物态性质[J].食品科学,2002,23(5):91-93.
[14] VITURAWONG Y,ACHAYUTHAKAN P,SUPHANTHARIKA M.Gelatinization and rheological properties of rice starch/xanthan mixtures:Effects of molecular weight of xanthan and different salts[J]. Food Chemistry,2008,111(1):106-114.
[15] JUHÁSZ R,SALGÓ A.Pasting behavior of amylose,amylopectin and their mixtures as determined by RVA curves and first derivatives[J].Starch,2008,60(2):70-78.
[16] 傅献彩,沈文霞,姚天扬.物理化学[M].5版.北京:高等教育出版社,2006.
[17] NúÑEZ-SANTIAGO M C,BELLO-PÉREZA L A,TECANTE A.Swelling-solubility characteristics,granule size distribution and rheological behavior of banana(Musa paradisiaca)starch[J].Carbohydrate Polymers,2004,56(1):65-75.
[18] JEONG H Y,LIM S T.Crystallinity and pasting properties of freeze-thawed high amylose maize starch[J].Starch,2003,55(11):511-517.
