原发性肝细胞癌的 CT动态增强表现与细胞 DNA增殖水平的关系及其临床意义
2010-03-07杨建伟胡鸿涛黎海亮郭晨阳杜峰宋涛
杨建伟 胡鸿涛 黎海亮 郭晨阳 杜峰 宋涛
根据以往增强 CT文献报道[1],原发性肝细胞癌主要 CT表现为:病灶“快速增强,快速衰减”,即造影剂“快进快退”,而良性肿瘤则表现为“快进慢退”。但是在工作实践中,我们发现部分原发性肝细胞癌在肝脏CT动态增强中亦表现为“快进慢退”。由于其各期增强表现形式与良性肿瘤相似,故设想可能与肿瘤生物学特性,即肿瘤细胞的DNA增殖水平有关。为此,本研究对比观察呈典型“快进快退”表现的原发性肝细胞肝癌28例与呈不典型“快进慢退”表现的原发性肝细胞型肝癌7例,并对各肿瘤组织行流式细胞术检测,探讨原发性肝细胞型肝癌的 CT动态增强各期增强表现与其 DNA增殖水平关系及其临床意义。
1 资料与方法
1.1 一般资料 选择 2006年 6月至 2007年 3月在我院进行肝脏 CT动态增强检查的原发性肝细胞型肝癌患者 35例,共计35个肿瘤,其中伴有门静脉癌栓 4例,伴有门静脉癌栓 4例;所有患者均有肝硬化背景,均无远处转移。根据动态增强CT检查表现分为典型组(A组)28例,即造影剂始退时间≤50 s的“快进快退”组;非典型组(B组)7例,即始退时间 >50 s的“快进慢退”组。 A组 28例中男 25例,女 3例;年龄 29~71岁,平均年龄(52±11)岁;肿瘤结节共计 28个,右肝 19个,左肝 9个;直径为 2.2~11.1 cm,平均直径(4.7±1.9)cm。 B组 7例中男6例,女 1例;年龄 44~62岁,平均年龄(53±6)岁;肿瘤结节共计 7个,右肝 5个,左肝 2个;直径为 2.1~3.3 cm,平均直径(2.7±0.4)cm。所有肝占位性病变患者 CT动态增强后均在2周内行原发性肝癌根治术,手术新鲜标本立即送病理学检查及流式细胞术检查。
1.2 扫描方案 要求患者禁食至少 12 h。应用GE公司 CT(HiSpeed NX/i)进行固定层面动态扫描。以 4.0ml/s的速度自静脉注入非离子型对比剂优维显(300mg/ml)100m l。自对比剂注入后延迟 8 s开始扫描,电压 120 kV,电流 60mAs,矩阵512×512,层厚 10mm,取 4 s时间间隔共扫描 80 s,后取 6 s间隔再扫描 42 s。
1.3 后处理方案 扫描数据传入 GE工作站,利用 Perfusion中的肝脏肿瘤软件进行数据处理。动态增强扫描结束后,逐个回放每个病例的增强过程并准确记录各病灶的始增时间、峰值时间、始退时间及增强持续时间,增强持续时间为肿瘤开始增强直到明显低于肝实质回声或与肝实质一起减退至显像不清晰时的时间段。以上每个肿瘤结节动态增强扫描过程由 3人各自独立观察记录各时间点,取 3次时间的平均值。
1.4 手术标本组织学检查及生物学检查 35例均为单发肿瘤病灶,有手术适应症,均在行动态增强 CT扫描后 2周内行“原发性肝癌根治术”切除肿瘤。取 3~4块手术标本立即置 10%福尔马林固定送至病理科行组织学检查,所有患者组织学均确诊为肝细胞型肝癌。同时另取新鲜标本的肿瘤组织使用流式细胞仪(美国,贝克曼库尔特公司,Epics XL流式细胞仪)进行DNA含量测定与细胞周期分析,观察肿瘤组织 DNA增殖各期细胞比率及 DNA倍体变化情况,计算各肿瘤结节增殖系数PI(PI=[(S+G 2M)/(G 0/1+S+G 2M)] ×100%)。
1.5 观察指标 观察 2组瘤结节动态增强始增时间,峰值时间,始退时间及增强持续时间,计算细胞增殖的 DNA各期比率、增殖系数以及DNA非整倍体(异倍体)干系的百分比率。
1.6 统计学分析 应用 SPSS 11.5统计软件,计量资料以±s表示,采用 t检验,计数资料采用 χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 35例原发性肝细胞癌 CT动态增强检查后呈典型“快进快退”表现的为 28例(A组,图 1A~图 1C),呈“快进慢退”不典型表现的 7例(B组,图 2A~图 2C);2组肿瘤结节的始增时间及峰值时间差异无统计学意义(P>0.05),始退时间差异有统计学意义(P<0.05),增强持续时间差异亦有统计学意义(P<0.01)。见表 1。
2.2 2组 DNA分析结果见表 2。A组 DNA表现为高增值的 S期比率及增殖系数均显著高于B组(P<0.05)。A组肝癌异倍体峰出现率为53.57%(15/28)(图 3),而 B组则无 1例出现异倍体峰(图 4)。

图 1A 轻度肝硬化,动脉相示右肝肿块均匀强化,明显高于肝实质密度
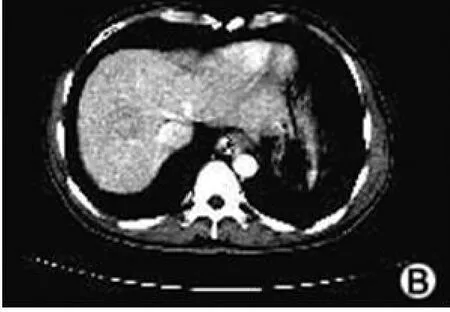
图 1B 门静脉相造影剂减退,肿块密度稍低于肝实质密度

图 1C 延迟相肿块密度明显低于肝实质
2.3 35例原发性肝细胞癌动态增强持续时间与DNA分析中表现为高增殖的 S期比率及增殖系数间差异有统计学意义(r值分别为 -0.72、-0.80,P<0.05)。其中 A组造影增强持续时间与 DNA S期比率及增殖系数间差异有统计学意义(r值分别为-0.47,-0.39,P<0.05)。而 B组造影增强持续时间与DNA S期比率及增殖系数间差异无统计学意义(P>0.05)。
2.4 2组间S期细胞比率及增殖系数差异有统计学意义(P<0.05)。见表 2。
3 讨论
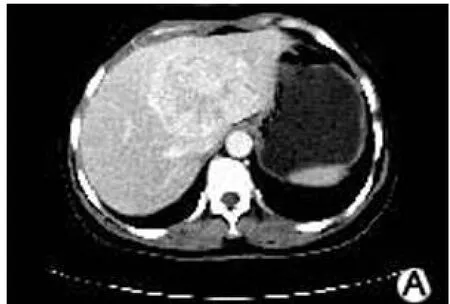
图 2A 动脉相示肝左叶肿块明显强化,高于肝实质密度,肝实质轻度强化

图 2B 门静脉相造影剂减退,肿块密度仍然高于肝实质密度

图 2C 延迟相肿块密度大部分呈等密度,中心密度低于肝实质

图 3 图 1肝癌组织 DNA分析,出现异倍体峰(黄色峰)

图 4 图 3肝癌结节组织 DNA分析,见二倍体峰(红色峰),未见黄色异倍体峰,S期比率(斜线峰)为19.52%,相对于典型组肝癌较稳定
表1 2组肝脏肿瘤CT动态增强动态时相变化s,±s

表1 2组肝脏肿瘤CT动态增强动态时相变化s,±s
注:与B组比较,*P<0.05,#P<0.01
组别 始增时间 峰值时间 始退时间 持续时间A组(n=28) 17±6 25±5 36±6* 54±9#B组(n=7) 16±4 27±6 62±8 123±10
表2 2组肝脏肿瘤细胞增殖比率%,±s

表2 2组肝脏肿瘤细胞增殖比率%,±s
注:与B组比较,*P<0.05
组别 细胞增殖各期G1期 S期 G2/M期 增殖系数(PI)A组(n=28) 49±5 35±6* 16±4 51.4±1.6 B组(n=7) 68±5 22±4 10±9 32.9±6.2
肝脏具有肝动脉和门静脉双重供血,赵虹等[2,3]以往的研究结果表明,肿瘤开始强化的时间平均为 21.6 s(15~30 s),动脉期开始的时间平均为16 s(12~22 s),而动脉期结束时间平均为 40 s,持续时间为平均 23 s。病灶动脉期强化是原发性肝癌诊断的主要依据[4],现在一般行头尾方向全肝多期扫描,难以全面显示其特征[5,6]。主要是因为原发性肝癌动脉期强化较早、持续时间短,许多患者的多期增强扫描并不能真实的反映肝脏及病灶的血液动力学改变,因此造成诊断困难。
大多肝癌 C动态增强表现为“快进快退”,但临床中还存在少部分原发性肝癌 CT动态增强并非“快进快退”,而是呈“快进慢退”表现[7],类似于良性肿瘤CT增强扫描时相改变。本组 7例不典型肝癌(B组)的始增时间为(16±4)s,峰值时间为(27±6)s,始退时间为(62±8)s,持续时间为(123±10)s,造影增强持续时间明显长于典型肝癌组(A组)(P<0.05)。
DNA倍性是恶性肿瘤的重要生物学特性之一,DNA异倍体是恶性肿瘤的重要标志物[8]。文献报道,恶性肿瘤组织增殖活性越高,其生物学特性越活跃,恶性度越高,预后越差[9-11]。细胞核 DNA含量检测的原理是根据 DNA是细胞遗传物质染色质的基础成分,DNA含量增加提示细胞处于S期,生长活跃。因此,增殖活跃的恶性肿瘤细胞 DNA含量检测应异常增加[12]。检测肿瘤细胞DNA含量及其倍体情况,仍是目前估测肿瘤恶性程度及患者预后的可靠指标。
本组资料显示采用流式细胞仪对肿瘤结节行 DNA分析,B组反应细胞高增殖状态的 S期细胞比率和增殖系数分别为(22±4)%和(32.9±6.2)%,明显低于 A组的(35±6)%和(51.4±1.6)%(P<0.01)。表明典型组的肝癌组织多处于高增殖状态,生物学特性活跃,恶性度高,而不典型肝癌组则多处于低增殖状态,生物学特性相对稳定,恶性度低。此外,DNA倍性也是恶性肿瘤的生物学特性之一,肿瘤组织DNA倍体类型不同,其增殖活性及愈后显著不同[13,14]。随着肿瘤细胞DNA从二倍体向异倍体转变,反应其增殖活性的S期细胞比率和增殖系数也逐渐增高,肿瘤的恶性度也相应增高,直接影响肿瘤治疗方案选择及预后。本组资料 DNA倍体分析,典型肝癌组出现异倍体峰肝癌结节高达 53.57%(15/28),而B组各结节则均未出现异倍体峰,进一步说明典型肝癌组生物学特性活跃,恶性程度高于相对稳定的不典型肝癌组。
本研究结果表明,肝癌结节CT动态增强的增强持续时间与 DNA S期细胞比率和增殖系数呈负相关性,DNA S期细胞比率和增殖系数越大,其组织增殖水平越高,生物学特性越活跃,恶性度越高,反之则恶性度越小。因此,CT动态增强的增强持续时间可以一定程度反应肝癌的生物学特性及恶性度,增强持续时间越长,反应肝癌增殖水平的 S期细胞比率和增殖系数就越小,其增殖水平相对较低,肝癌生物学特性越稳定,恶性程度就越小。究其原因,可能由于不典型组肝癌细胞生物学特性相对稳定,恶性度相对较低,肿瘤细胞的异型性小,肿瘤血管密度较小,动静脉瘘数量少,肿瘤血管内皮细胞功能较好,肿瘤组织内枯否细胞含量相对多于典型肝癌组的肿瘤组织,以上多种原因导致造影剂进入肿瘤组织后不易快速退出[15,16]。
通过 CT动态增强可以较好地反映肿瘤细胞的增殖程度,与组织学方法相比,具有不需组织标本、能更大范围反映肿瘤情况、解剖与功能信息同时显示、可重复检查等优点,从而为活体判断肿瘤细胞的增殖程度提供方法,有助于制定治疗措施、判断疗效及预后。
1 周康荣主编.螺旋 CT.第 1版.上海:上海医科大学出版社,1998.101.
2 赵虹,周康荣,严福华.多层螺旋 CT肝脏多期扫描对肝细胞癌检出的初步评价.中华放射学杂志,2003,37:747-750.
3 薛众,王叶蒂,朱奎.多层螺旋CT在小肝癌诊断中的作用.中国医药研究,2004,2:27-28.
4 乔颖,马立公,严福华,等.肝癌的螺旋 CT表现及鉴别诊断.中华肿瘤杂志,2002,22:164-165.
5 Weberling R.DryView laser imager:a new and economical image recording process.Aktuelle Radiol,1996,6:355-360.
6 文利,丁仕义,周代全,等.正常肝脏 CT灌注的研究.第三军医大学学报,2002,24:670-672.
7 涂备武,周康荣.小肝癌 CT增强动脉期时间密度曲线特征及其病理分析.实用放射学杂志,2005,21:926-928.
8 左连富主编.流式细胞术与生物医学.第 1版.沈阳:辽宁科学技术出版社,1996.129-198.
9 Ito T,Shiraki K,Sugimoto K,et al.Survivin promotes cell proliferation in human hepatocellular carcinoma.Hepatology,2000,31:1080-1085.
10 靳文生,晏才杰,麻晓林,等.胃粘膜癌变过程中细胞增殖活性的研究.重庆医学,2001,30:203-204,207.
11 于志勇,于金明,吴泰璜,等.乳腺癌分子生物学特性检测的临床意义.中华肿瘤杂志,2005,27:420-422.
12 Francis DL,Freeman A,Visvikis D,et al.In vivo imaging of cellular proliferation in colorectal cancer using positron em ission tomography.Gut,2003,52:1602-1606.
13 Schm idt D,Wischmeyer P,Leuschner I,et al.DNA analysis in hepatoblastoma by flow and image cytometry.Cancer,1993,72:2914-2919.
14 温险峰,马曾辰,林芷英,等.肝细胞肝癌中 DNA含量分析提示复发的价值 -Logistic回归.中国普外基础与临床杂志,2001,8:237-239.
15 Watanabe R,Matsumura M,Chen CJ,et al.Characterization of tumor imaging withmicrobubble-based ultrasound contrast agent,sonazoid,in rabbit liver.Biol Pharm Bull,2005,28:972-977.
16 王兴华,董宝玮,于晓玲.超声造影评价肝肿瘤血流灌注及其机理的研究进展.消化外科,2004,3:144-147.
